天津市重点中学2022-2023学年高一上学期期中考试化学试卷
试卷更新日期:2022-11-03 类型:期中考试
一、单项选择题:(本题共30分,每小题2分,每小题只有1个正确答案)
-
1. 按照物质的树状分类法和交叉分类法,对于HCl的分类正确的是( )
① 酸 ②强酸 ③一元酸 ④多元酸 ⑤含氧酸 ⑥无氧酸 ⑦化合物 ⑧混合物
A、全部 B、①②④⑤⑧ C、①②③⑥⑦ D、①③④⑤⑥2. 下列物质的分类结果全部正确的是( )A、水煤气-混合物;胆矾-纯净物;金刚石-单质 B、小苏打-酸式盐;碳酸钙-可溶性盐;食醋-纯净物 C、盐酸-纯净物;硫酸钾-钾盐;氯化铵-易溶性盐 D、豆浆-胶体;Fe(OH)3胶体一分散系;冰水共存物-混合物3. 甲、乙、丙三种物质间通过一步反应就能实现如图转化。下列选项中符合转化关系的是( ) A、甲为氢氧化钠、乙为氯化钠、丙为硝酸钠 B、甲为氧化铜、乙为氯化铜、丙为氢氧化铜 C、甲为碳酸钠、乙为二氧化碳、丙为碳酸钙 D、甲为硫酸、乙为硫酸钡、丙为硫酸钠4. 下列各组离子能大量共存的是( )A、无色透明溶液中:K+、Cu2+、Na+、SO42- B、强碱性溶液中:K+、NH4+、Cl-、HCO3- C、能使酚酞溶液变红的溶液中:Na+、Cl-、CO32-、NO5- D、含有Ba2+的酸性溶液中:Mg2+、Na+、SO42-、S2-5. 逻辑推理是化学学习中常用的科学思维方法,以下四项推理中正确的是( )A、电解质在溶液里的复分解反应都是离子反应,离子反应都是电解质在溶液里的复分解反应 B、酸类物质都有酸性,使溶液呈酸性的化合物都是酸 C、氧化还原反应的实质是发生电子转移,凡是有电子转移的化学反应都是氧化还原反应 D、碱性氧化物都是金属氧化物,酸性氧化物都是非金属氧化物6. 下列说法错误的是( )A、钠与水反应的离子方程式:Na+2H2O=Na++20H-+H2↑ B、Na2O2吸收CO2产生O2 , 因此可用作呼吸面具供氧剂 C、过氧化钠与二氧化碳反应可制备氧气 D、二氧化碳使Na2O2固体变白过程中,CO2未被还原,也未被氧化7. 下列关于氯及其化合物的说法正确的是( )A、漂白粉在空气中久置变质是因为漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 B、ClO2具有强氧化性,可用于自来水的杀菌消毒 C、将Cl2与HCl混合气体通过饱和食盐水可得到纯净的Cl2
A、甲为氢氧化钠、乙为氯化钠、丙为硝酸钠 B、甲为氧化铜、乙为氯化铜、丙为氢氧化铜 C、甲为碳酸钠、乙为二氧化碳、丙为碳酸钙 D、甲为硫酸、乙为硫酸钡、丙为硫酸钠4. 下列各组离子能大量共存的是( )A、无色透明溶液中:K+、Cu2+、Na+、SO42- B、强碱性溶液中:K+、NH4+、Cl-、HCO3- C、能使酚酞溶液变红的溶液中:Na+、Cl-、CO32-、NO5- D、含有Ba2+的酸性溶液中:Mg2+、Na+、SO42-、S2-5. 逻辑推理是化学学习中常用的科学思维方法,以下四项推理中正确的是( )A、电解质在溶液里的复分解反应都是离子反应,离子反应都是电解质在溶液里的复分解反应 B、酸类物质都有酸性,使溶液呈酸性的化合物都是酸 C、氧化还原反应的实质是发生电子转移,凡是有电子转移的化学反应都是氧化还原反应 D、碱性氧化物都是金属氧化物,酸性氧化物都是非金属氧化物6. 下列说法错误的是( )A、钠与水反应的离子方程式:Na+2H2O=Na++20H-+H2↑ B、Na2O2吸收CO2产生O2 , 因此可用作呼吸面具供氧剂 C、过氧化钠与二氧化碳反应可制备氧气 D、二氧化碳使Na2O2固体变白过程中,CO2未被还原,也未被氧化7. 下列关于氯及其化合物的说法正确的是( )A、漂白粉在空气中久置变质是因为漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 B、ClO2具有强氧化性,可用于自来水的杀菌消毒 C、将Cl2与HCl混合气体通过饱和食盐水可得到纯净的Cl2D因漂白粉在空气中不稳定,故可用于漂白纸张
8. 下列叙述中正确的是( )序号
氧化剂
还原剂
其他反
应物
氧化
产物
还原产
物
①
Cl2
FeBr2
FeCl3
②
KMnO4
H2O2
H2SO4
O2
MnSO4
③
KClO3
HCl(浓)
Cl2
Cl2
④
KMnO4
HCl(浓)
Cl2
MnCl2
A、①中反应的氧化产物一定只有FeCl3 B、氧化性:KMnO4>Cl2>Fe3+>Br2>Fe2+ C、还原性:H2O2>Mn2+>Cl- D、④中的HCl(浓)既做还原剂,又起到酸的作用9. 建国70周年阅兵式上,飞机拉烟原理是吊舱中彩色物质被加压N2吹出,送入高温燃气中,形成“彩烟”。下列有关说法正确的是( )A、彩烟是一种纯净物 B、蒸汽凝结为雾发生了化学变化 C、蒸汽遇冷形成的雾是一种分散系 D、拉烟原理与丁达尔效应的原理相同10. 偏二甲肼(C2H8N2)是一种高能燃料,燃烧产生巨大能量,可作为航天运载火箭的推动力。下列叙述中正确的是( )A、偏二甲肼的摩尔质量为60g B、6.02×1023个偏二甲肼分子的质量为60g C、1 mol偏二甲肼的质量为60g/mol D、6g偏二甲肼含有NA个偏二甲肼分子11. 下列实验过程中,不会产生气体的是( )A、 B、
B、 C、
C、 D、
D、 12. 用如图装置进行实验:加热钠至熔化后,停止加热并通入氯气,钠剧烈燃烧并生成大量白烟。以下叙述错误的是( )
12. 用如图装置进行实验:加热钠至熔化后,停止加热并通入氯气,钠剧烈燃烧并生成大量白烟。以下叙述错误的是( ) A、钠着火燃烧产生苍白色火焰 B、反应生成的大量白烟是氯化钠固体小颗粒 C、棉花球处发生的化学反应是Cl2+2NaOH=NaCl+NaClO+H2O D、可在棉花球右侧用湿润的淀粉-碘化钾试纸判断氯气是否被碱液完全吸收13. 在反应X+2Y=R+2M中,已知R和M的摩尔质量之比为22:9,当1.6gX与一定量Y完全反应后,生成4.4gR。则在此反应中Y和M的质量之比为( )A、16:9 B、23:9 C、32:9 D、46:914. 下列关于阿伏加德罗常数的说法中正确的是( )A、6.02×1023叫作阿伏加德罗常数 B、阿伏加德罗常数的数值约为6.02×1023 C、含有阿伏加德罗常数个原子的物质的物质的量是1摩尔 D、1摩尔氯含有6.02×1023个氯分子15. 下列关于物质的量的说法中,正确的是( )A、1mol任何纯净物都约含有6.02×1023个原子 B、1mol NaCl中约含有6.02×1023个NaCl分子 C、0.5mol O2中约含有3.01×1023个氧分子 D、1molH2中含有2mol氢离子和2×6.02×1023个电子
A、钠着火燃烧产生苍白色火焰 B、反应生成的大量白烟是氯化钠固体小颗粒 C、棉花球处发生的化学反应是Cl2+2NaOH=NaCl+NaClO+H2O D、可在棉花球右侧用湿润的淀粉-碘化钾试纸判断氯气是否被碱液完全吸收13. 在反应X+2Y=R+2M中,已知R和M的摩尔质量之比为22:9,当1.6gX与一定量Y完全反应后,生成4.4gR。则在此反应中Y和M的质量之比为( )A、16:9 B、23:9 C、32:9 D、46:914. 下列关于阿伏加德罗常数的说法中正确的是( )A、6.02×1023叫作阿伏加德罗常数 B、阿伏加德罗常数的数值约为6.02×1023 C、含有阿伏加德罗常数个原子的物质的物质的量是1摩尔 D、1摩尔氯含有6.02×1023个氯分子15. 下列关于物质的量的说法中,正确的是( )A、1mol任何纯净物都约含有6.02×1023个原子 B、1mol NaCl中约含有6.02×1023个NaCl分子 C、0.5mol O2中约含有3.01×1023个氧分子 D、1molH2中含有2mol氢离子和2×6.02×1023个电子二、多项选择题:(本题共15分,每小题3分,每小题有1-2个正确答案)
-
16. 下列有关物质的说法正确的是( )A、不能与酸反应的氧化物一定能与碱反应 B、能与金属镁反应产生氢气的溶液一定是酸溶液 C、一种元素可能有多种氧化物,同种化合价也可能对应多种氧化物 D、酸性氧化物肯定是非金属氧化物17. 实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气)。下列说法正确的是( )
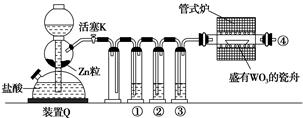 A、①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液 B、管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度 C、结束反应时,先关闭活塞K,再停止加热 D、装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气18. 下列有关说法正确的是( )A、在酒精灯加热条件下,Na2CO3、NaHCO3固体都能发生分解 B、不同条件下,23g钠在空气中充分反应时转移电子数均为NA C、11gCO2与足量Na2O2反应转移的电子数为0.5NA D、将Na2O2加入Ba(HCO3)2溶液中同时有气体和沉淀产生19. 现有NO、NO2、O3三种气体,它们含有的氧原子数目相同,则三种气体的物质的量之比为( )A、6:3:2 B、3:2:1 C、1:2:3 D、1:1:120. 钠在液氨中溶剂化速度极快,生成蓝色的溶剂合电子,如图为钠投入液氨中的溶剂化图。钠沉入液氨中,快速得到深蓝色溶液,并慢慢产生气泡。下列说法错误的是( )
A、①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液 B、管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度 C、结束反应时,先关闭活塞K,再停止加热 D、装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气18. 下列有关说法正确的是( )A、在酒精灯加热条件下,Na2CO3、NaHCO3固体都能发生分解 B、不同条件下,23g钠在空气中充分反应时转移电子数均为NA C、11gCO2与足量Na2O2反应转移的电子数为0.5NA D、将Na2O2加入Ba(HCO3)2溶液中同时有气体和沉淀产生19. 现有NO、NO2、O3三种气体,它们含有的氧原子数目相同,则三种气体的物质的量之比为( )A、6:3:2 B、3:2:1 C、1:2:3 D、1:1:120. 钠在液氨中溶剂化速度极快,生成蓝色的溶剂合电子,如图为钠投入液氨中的溶剂化图。钠沉入液氨中,快速得到深蓝色溶液,并慢慢产生气泡。下列说法错误的是( ) A、钠的密度比液氨大 B、溶液的导电性增强 C、钠和液氨可发生以下反应:2NH3+2Na=2NaNH2+H2↑ D、0.1mol钠投入液氨生成0.01molH2时,Na共失去0.02mol 电子
A、钠的密度比液氨大 B、溶液的导电性增强 C、钠和液氨可发生以下反应:2NH3+2Na=2NaNH2+H2↑ D、0.1mol钠投入液氨生成0.01molH2时,Na共失去0.02mol 电子三、非选择题
-
21. 下列三组物质中,均有一种物质的类别与其他三种不同:
a.MgO、Na2O、CO2、CuO
b.HCl、H2O、H2SO4、HNO3
c.NaOH、Na2CO3、KOH、Cu(OH)2
(1)、三种物质依次是(填化学式):A:B:C(2)、这三种物质相互作用可生成一种新物质 NaHCO3 , 该反应(填“是”或“不是”)氧化还原反应。(3)、写出物质C与足量稀硫酸反应的离子方程式:(4)、HCO3-与H+、OH-在溶液中能共存吗?试用离子方程式说明。22. 饮用水中的 , 对人类健康会产生危害,为了降低饮用水中的浓度,可以在碱性条件下用铝粉将 , 还原为N2 , 其化学方程式为:Al+NaNO3+NaOH=NaAlO2+N2+H2O。请配平该反应
上述反应中,元素的化合价升高,则该元素的原子 (填“得到”或“失去”)电子。用“单线桥法”表示反应中电子转移的方向和数目。
23. 在第一次世界大战期间,有一次德军与英、法军在比利时对峙,黎明时,英、法军前线战壕的士兵突然看到一股黄绿色气体逐渐袭来,很快数百名英、法军战士窒息而死。后来人们在打扫战场时,发现跑到山坡上的士兵竟幸免于难。(1)、由上述事例可归纳出氯气的性质有(2)、写出下列反应的化学方程式。①铁丝在氯气中燃烧:
②铁粉溶于盐酸中:
(3)、将新鲜的花瓣放入干燥的氯气中可观察到的现象是原因是(4)、氯水久置或光照条件下均会变成稀盐酸,同时释放出氧气,说明次氯酸反应的化学方程式为24.(1)、3.01×1023个SO2分子中含有氧原子的个数为 SO2气体的质量为(2)、常温常压下,92gNO2气体含有的原子数为(用NA表示阿伏加德罗常数的值)。(3)、NO和O2可发生反应:2NO+O2=2NO2 , 现有a molNO和bmol O2 , 充分反应后氮原子与氧原子的个数比为(4)、1个12C的质量是akg,1个Na的质量是bkg,Na的摩尔质量是 (用含a、b的表达式表示)。25. 下图中,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物。它们的焰色试验均为黄色。 (1)、写出下列物质的化学式:BE(2)、以上反应中属于氧化还原反应的有(填写编号)。(3)、写出B→C反应的离子方程式:
(1)、写出下列物质的化学式:BE(2)、以上反应中属于氧化还原反应的有(填写编号)。(3)、写出B→C反应的离子方程式:C→E的化学方程式:
(4)、加热5.00gD和E的固体混合物,使E完全分解,固体混合物的质量减少了0.31g,则原混合物中D的质量为26. 二氧化氯(ClO2)是一种优良的消毒剂,熔点为-59℃,沸点为11℃,浓度过高时易发生分解,甚至爆炸。某课外兴趣小组通过氯气与NaClO2溶液反应来制取少量ClO2 , 装置如图所示: (1)、甲装置中圆底烧瓶内发生反应的化学方程式是(2)、丙装置中发生的反应可能经两步完成,请将其补充完整:(用化学方程式表示)。
(1)、甲装置中圆底烧瓶内发生反应的化学方程式是(2)、丙装置中发生的反应可能经两步完成,请将其补充完整:(用化学方程式表示)。②HClO+HCl+2NaClO2=2ClO2↑+2NaCl+H2O。
(3)、Cl-存在时会催化:ClO2的生成,若无乙装置,则丙装置内产生ClO2的速率明显加快。乙装置中试剂瓶内的液体是 。实验过程中常需通入适量的N2稀释ClO2 , 其目的是(4)、戊装置烧杯中 NaOH 溶液吸收ClO2后,生成了ClO2-、ClO3- , 该反应的离子方程式是(5)、ClO2与酸性碘化钾溶液反应(还原产物为Cl-),反应的离子方程式为: