吉林省长春市市名校2022-2023学年高一上学期期中考试化学学科
试卷更新日期:2022-11-03 类型:期中考试
一、单项选择题(每小题只有一个选项符合题意,每题2分,共30分)
-
1. 目前在我国少数地区轻度缺碘,市民补碘需要科学适量。市场上销售的某种“加碘食盐”中加入含碘元素的物质是碘酸钾(KIO3),碘酸钾属于( )A、酸 B、碱 C、盐 D、氧化物2. 下列有关的化学知识,错误的是( )A、胶体区别于溶液的本质是胶体中分散质大小介于1nm和100nm之间 B、进行焰色反应实验时,没有铂丝可用无锈铁丝代替进行实验 C、胶体都可以用来净水 D、实验室中取用后剩余的钠要放回原试剂瓶中3. 下列物质属于强电解质的是( )A、KOH B、H3PO4 C、SO3 D、C2H5OH4. 下列物质在水溶液中的电离方程式书写正确的是( )A、Ca(OH)2→Ca2++ 2OH- B、NaHSO4=Na+ +HSO42- C、CH3COOH=H++CH3COO- D、Al2(SO4)3=2Al3++3SO42-5. 下列说法正确的是( )A、氧化铜的摩尔质量是80g B、氨气的摩尔质量是17 mol C、氧气的摩尔质量是32 g·mol-1 D、氢原子的质量是2g6. 下列不属于四种基本反应类型,但属于氧化还原反应的是( )A、2KClO32KCl+3O2↑ B、2Na+Cl22NaCl C、Zn+2HCl=ZnCl2+H2↑ D、Fe2O3+3CO2Fe+3CO27. 下列物质中不能用化合反应的方法生成的是( )
①Na2O ②H2SiO3 ③NaHCO3 ④Cu(OH)2 ⑤Na2O2 ⑥Na2CO3
A、①③④⑥ B、②④ C、②④⑥ D、①②④8. 下列变化需加氧化剂才能实现的是( )A、CaCO3→CO2 B、Fe2+→Fe3+ C、Cu2+→Cu D、SO42-→BaSO49. 已知2Fe3++2I-=2Fe2++I- , 2Fe2++Cl2=2Fe3++2Cl- , 则有关离子的还原性由强到弱的顺序为( )A、Cl->Fe2+>I- B、Fe2+>I->Cl- C、I->Fe2+>Cl- D、Fe2+>Cl->I-10. 常温下,将金属钠放入盛有下列溶液的小烧杯中,既有气体,又有沉淀产生的个数是(反应后恢复到原温度)( )①MgSO4溶液 ②饱和Na2CO3溶液 ③CuSO4溶液 ④饱和澄清石灰水 ⑤Ca(HCO3)2溶液
A、2 B、3 C、4 D、511. 下列单质既能跟氯气直接反应,又能跟稀盐酸反应,且产物不相同的是( )A、Al B、Cu C、Fe D、Zn12. 已知1.505×1023个X气体分子的质量为8g,则X气体的摩尔质量是( )A、16g B、32g C、64g·mol-1 D、32g·mol13. 某溶液中含有HCO3-、SO32-、CO32-、CH3COO-4种阴离子。向其中加入足量的Na2O2固体后,溶液中离子浓度基本保持不变的是(假设溶液体积无变化)( )A、CH3COO- B、SO32- C、CO32- D、HCO3-14. 将CO和O2的混合气体7.6g通入Na2O2 , 充分反应后,气体质量变为4.8g,原混合气体中O2的质量是( )A、6.4g B、3.2g C、1.6g D、0.8g15. 对于反应:KClO3+6HCl=KCl +3Cl2↑+3H2O,若有0.1molKClO3参加反应,下列说法正确的是( )A、被氧化的HCl为0.6mol B、转移电子1.806×1023个 C、还原性:KClO3大于Cl2 D、还原剂占参加反应HCl的5/6二、单项选择题(每小题只有一个选项符合题意,每题3分,共30分)
-
16. 下列物质在给定条件下的转化均能一步实现的是( )A、Fe3O4→(CO)Fe→(HCl)FeCl3 B、H2O2→(加热)H2→(O2)H2O C、CaCl2溶液→(CO2)CaCO3→(HCl)CO2 D、CuSO4溶液→(Fe)Cu→(O2)CuO17. P单质在反应4P+3KOH+3H2O—3KH2PO2+PH3中( )A、被氧化 B、被还原 C、既被氧化又被还原 D、既未被氧化又未被还原18. 下列选项中给的相关的量的物质中含原子总数最多的是( )A、16 g SO3 B、4℃时1L H2O C、1.3×1023个CO2 D、0.6 mol甲烷(CH4)分子19. 在无色透明强酸性溶液中,能大量共存的离子组是( )A、K+、Na+、MnO4-、SO42- B、Na+、OH-、Cl-、CO32- C、Zn2+、Al3+、Cl-、NO3- D、Na+、Fe2+、SO42-、Ba2+20. BrCl是一种工业消毒剂,其结构和性质与氯气相似,下列有关BrCl的预测正确的是( )A、是一种有毒、有色的单质 B、Br、Cl元素的化合价都为0价 C、具有强氧化性,能使Fe2+转化为Fe3+ D、与H2O反应的化学方程式:BrCl+H2O=HClO+HBr21. 实验室用如图装置制取、提纯、收集Cl2以及尾气处理,不能达到实验目的的是( )
 A、用装置甲制取Cl2 B、用装置丙收集Cl2 C、用装置丁吸收尾气中的Cl2 D、用装置乙除去Cl2中的少量HCl22. 下列离子方程式书写正确的是( )A、NH4HCO3溶液与足量NaOH溶液反应:NH4++OH-=NH3•H2O B、澄清石灰水与过量NaHCO3溶液反应:HCO3-+Ca2++OH-=CaCO3+H2O C、氢氧化钠溶液通入过量SO2:OH-+SO2=HSO3- D、Cl2与FeBr2物质的量之比1:1的离子反应方程式:Cl2 +2 Fe2+= 2Fe3++ 2Cl-23. 在120℃的条件下,将质量为5.6g的CO与1.6g的H2的混合气体在足量的O2中充分燃烧,然后将产生的气体通过足量的Na2O2固体中充分反应,反应后固体增加的质量为( )A、4.5 g B、7.2g C、9.3g D、无法计算24. “侯氏制碱法”是我国化工专家侯德榜为世界制碱工业作出的突出贡献。某实验小组模拟“侯氏制碱法”的工艺流程如图:
A、用装置甲制取Cl2 B、用装置丙收集Cl2 C、用装置丁吸收尾气中的Cl2 D、用装置乙除去Cl2中的少量HCl22. 下列离子方程式书写正确的是( )A、NH4HCO3溶液与足量NaOH溶液反应:NH4++OH-=NH3•H2O B、澄清石灰水与过量NaHCO3溶液反应:HCO3-+Ca2++OH-=CaCO3+H2O C、氢氧化钠溶液通入过量SO2:OH-+SO2=HSO3- D、Cl2与FeBr2物质的量之比1:1的离子反应方程式:Cl2 +2 Fe2+= 2Fe3++ 2Cl-23. 在120℃的条件下,将质量为5.6g的CO与1.6g的H2的混合气体在足量的O2中充分燃烧,然后将产生的气体通过足量的Na2O2固体中充分反应,反应后固体增加的质量为( )A、4.5 g B、7.2g C、9.3g D、无法计算24. “侯氏制碱法”是我国化工专家侯德榜为世界制碱工业作出的突出贡献。某实验小组模拟“侯氏制碱法”的工艺流程如图:
下列有关说法正确的是( )
A、A气体是NH3 , B气体是CO2 B、第II步得到晶体是Na2CO3·10H2O C、第IV步操作用到的主要仪器是酒精灯、蒸发皿、玻璃棒 D、在整个流程中可循环利用的物质只有NH325. 工业上常用NaClO碱性溶液吸收工业废气中的SO2 , 为了提高吸收效率,常用Ni2O3 , 作为催化剂,在反应过程中产生的四价镍和氧原子都具有极强的氧化能力,可加快对SO2的吸收,其中的催化过程如图所示:
下列说法不正确的是( )
A、NaClO碱性溶液吸收SO2的离子方程式是:ClO-+SO2+2OH-=Cl-+SO42-+H2O B、过程1的离子方程式是:ClO-+Ni2O3=2NiO2+Cl- C、过程2中,氧化剂是ClO- , 还原剂是NiO2 D、此催化过程的离子反应为:ClO-Cl-+O三、实验题(本题10分)
-
26. 二氧化氯(ClO2)是一种高效消毒剂,易溶于水,沸点为11.0℃,极易爆炸分解,若用空气、二氧化碳、氮气等惰性气体稀释时,爆炸性则降低。用干燥的氯气与固体亚氯酸钠(NaClO2)制备二氧化氯,装置如图:
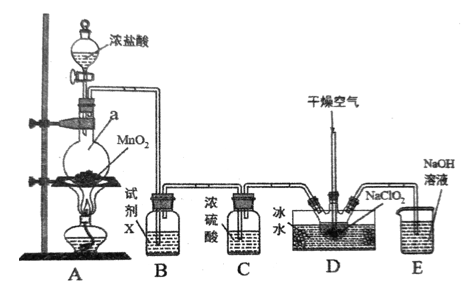 (1)、仪器a的名称为 , 装置A中反应的离子方程式为。(2)、试剂X的作用是。(3)、装置D中通入干燥空气的作用是。(4)、该实验装置的缺陷是。
(1)、仪器a的名称为 , 装置A中反应的离子方程式为。(2)、试剂X的作用是。(3)、装置D中通入干燥空气的作用是。(4)、该实验装置的缺陷是。四、填空题(本题共20分)
-
27. 含氯消毒剂是指溶于水产生具有杀死微生物活性的次氯酸的消毒剂,无机含氯消毒剂包括液氯、次氯酸钠、次氢酸钙等。其中,“84消毒液”是日常生活中常用的消毒液,在抗击新冠肺炎中被广泛应用。(1)、下列叙述正确的是____(填字母)。A、液氯和新制氯水都是游离态氯,都能作杀菌消毒剂 B、因为Cl2能与水反应,所以自来水中不存在游离态氯 C、溶液中H+的浓度适当的增加,可以增强次氯酸钠的消毒效果 D、含氯消毒剂应密封保存(2)、“84消毒液”与适量硫酸混合使用可增强消毒能力,某消毒组成员欲用浓盐酸代替硫酸,是否可行(填“是”或“否”),用离子反应方程式说明原因是。(3)、Cl2是最早用于饮用水消毒的物质,ClO2是一种广谱消毒剂,等质量的Cl2和ClO2消毒效率高的是(填化学式);工业上ClO2常用NaClO3和Na2SO3溶液混合酸化反应制得,反应中NaClO2和Na2SO3的物质的量之比为。28. 过氧化钙(CaO2)广泛应用于水产养殖、污水处理,是优良的供氢剂。
为了测定CaOz的含量,具体的操作:把样品中的过氧化钙转化为碳酸钙,通过测定碳酸钙沉淀的质量,根据钙元素守恒,求得过氧化钙的质量,具体流程如图:
 (1)、在流程中过氧化钙(CaO2)与水反应的离子反应方程式。(2)、滴加的Na2CO3溶液要过量的原因是。(3)、检验沉淀已经洗涤干净的方法是:。(4)、若供氧剂的质量m=5g,碳酸钙质量n=6g,请通过计算得出供氧剂中的过氧化钙含量的质量分数为%。(5)、若CaCO。沉淀过滤后不洗涤,则过氧化钙的含量将(填“偏大”、“偏小”或“无影响”)。
(1)、在流程中过氧化钙(CaO2)与水反应的离子反应方程式。(2)、滴加的Na2CO3溶液要过量的原因是。(3)、检验沉淀已经洗涤干净的方法是:。(4)、若供氧剂的质量m=5g,碳酸钙质量n=6g,请通过计算得出供氧剂中的过氧化钙含量的质量分数为%。(5)、若CaCO。沉淀过滤后不洗涤,则过氧化钙的含量将(填“偏大”、“偏小”或“无影响”)。五、计算题(本题共10分)
-
29.(1)、在常温条件下,某密闭容器中含有由3.4gH2和O2组成的混合气体,共含有0.4mol的原子。回答下列问题:
①该混合气体的平均摩尔质量为。
②混合气体中H2的分子数为 , H2和O2质量比为。
(2)、12.4 g Na2X中含Na+0.4 mol,X的相对原子质量是。(3)、在催化剂的作用下,NH3和NO2发生反应生成N2和H2O,每生成7molN2转移电子的物质的量为。
-