河北省唐山市2021-2022学年高一上学期期末考试化学试题
试卷更新日期:2022-11-01 类型:期末考试
一、单选题
-
1. 下列化学药品与其化学品图形标志不一致的是( )
A
B
C
D




漂白粉
酒精
双氧水
浓硫酸
A、A B、B C、C D、D2. 在全国人民众志成城抗击新冠病毒期间,使用的“84消毒液”的主要有效成分是( )A、NaOH B、NaCl C、NaClO D、Na2CO33. 反应 可用于氯气管道的检漏。下列表示相关微粒的化学用语正确的是( )A、中子数为9的氮原子: B、N2分子的电子式: C、Cl2分子的结构式:Cl-Cl D、Cl-的结构示意图: 4. 下列分散系中能出现丁达尔效应的是( )A、硫酸钡是浊液 B、蔗糖溶液 C、Al(OH)3胶体 D、石灰水5. 下列说法正确的是( )A、CaCl2和Na2O中的化学键类型完全相同 B、BF3、CCl4中每个原子都满足8电子稳定结构 C、HCl比H2S稳定是因为分子间作用力前者强于后者 D、干冰气化时克服了共价键和分子间作用力6. 下列物质间转化均能实现的是( )A、FeS2(s)SO3(g)H2SO4(aq) B、NaCl(aq)Na(s)Na2O2(s) C、Al3+(aq)Al(OH)3AlO(aq) D、NaBr(aq)Br2(aq)I2(aq)7. 如图是配制一定物质的量浓度溶液的过程示意图。下列说法中错误的是( )
4. 下列分散系中能出现丁达尔效应的是( )A、硫酸钡是浊液 B、蔗糖溶液 C、Al(OH)3胶体 D、石灰水5. 下列说法正确的是( )A、CaCl2和Na2O中的化学键类型完全相同 B、BF3、CCl4中每个原子都满足8电子稳定结构 C、HCl比H2S稳定是因为分子间作用力前者强于后者 D、干冰气化时克服了共价键和分子间作用力6. 下列物质间转化均能实现的是( )A、FeS2(s)SO3(g)H2SO4(aq) B、NaCl(aq)Na(s)Na2O2(s) C、Al3+(aq)Al(OH)3AlO(aq) D、NaBr(aq)Br2(aq)I2(aq)7. 如图是配制一定物质的量浓度溶液的过程示意图。下列说法中错误的是( ) A、配制100 mL1.0 mol/L的Na2CO3溶液,操作1需要称量10.6 g Na2CO3固体 B、操作2是将恢复至常温的Na2CO3溶液转移到容量瓶中 C、操作4是滴加水至溶液凹液面的最低点与刻度线平齐 D、操作5中,定容摇匀后发现液面低于刻度线,要继续加水至液面与刻度线平齐8. 下列有关性质的比较中,错误的是( )A、气态氢化物的热稳定性:NH3>CH4 B、酸性:HClO>H2SO4 C、碱性:NaOH<KOH D、原子半径:S<P9. 利用图中实验装置进行的相应实验,能达到实验目的的是( )
A、配制100 mL1.0 mol/L的Na2CO3溶液,操作1需要称量10.6 g Na2CO3固体 B、操作2是将恢复至常温的Na2CO3溶液转移到容量瓶中 C、操作4是滴加水至溶液凹液面的最低点与刻度线平齐 D、操作5中,定容摇匀后发现液面低于刻度线,要继续加水至液面与刻度线平齐8. 下列有关性质的比较中,错误的是( )A、气态氢化物的热稳定性:NH3>CH4 B、酸性:HClO>H2SO4 C、碱性:NaOH<KOH D、原子半径:S<P9. 利用图中实验装置进行的相应实验,能达到实验目的的是( ) A、利用图1和图4所示装置进行粗盐提纯 B、利用图2所示装置除去中混有的HCl C、利用图3所示装置进行乙醇萃取碘水中的碘 D、利用图4所示装置提纯胶体10. 下面关于同温同压下的两种气体一氧化碳和氮气的判断错误的是( )A、体积相等时密度不相等 B、体积相等时分子数相等 C、体积相等时具有的电子数相等 D、质量相等时具有的原子数相等11. 下列各组离子能在溶液中大量共存的是( )A、Na+、Mg2+、Cl-、OH- B、H+、Ca2+、CO、NO C、Cu2+、K+、SO、NO D、Na+、HCO、OH-、Ca2+12. 下列离子方程式书写错误的是( )A、向碳酸钙中滴加稀盐酸:CaCO3+2H+=Ca2++CO2↑+H2O B、将氯气通入水中:Cl2+H2OCl-+ClO-+2H+ C、过量二氧化碳气体通入氢氧化钠溶液中:CO2+OH-=HCO D、氢氧化钡溶液与稀硫酸反应:Ba2++SO+2H++2OH-=BaSO4↓+2H2O13. 今年是门捷列夫发现元表周期律153周年。表格为元素周期表的一部分,针对表中用字母标出的元素,下列说法错误的是( )
A、利用图1和图4所示装置进行粗盐提纯 B、利用图2所示装置除去中混有的HCl C、利用图3所示装置进行乙醇萃取碘水中的碘 D、利用图4所示装置提纯胶体10. 下面关于同温同压下的两种气体一氧化碳和氮气的判断错误的是( )A、体积相等时密度不相等 B、体积相等时分子数相等 C、体积相等时具有的电子数相等 D、质量相等时具有的原子数相等11. 下列各组离子能在溶液中大量共存的是( )A、Na+、Mg2+、Cl-、OH- B、H+、Ca2+、CO、NO C、Cu2+、K+、SO、NO D、Na+、HCO、OH-、Ca2+12. 下列离子方程式书写错误的是( )A、向碳酸钙中滴加稀盐酸:CaCO3+2H+=Ca2++CO2↑+H2O B、将氯气通入水中:Cl2+H2OCl-+ClO-+2H+ C、过量二氧化碳气体通入氢氧化钠溶液中:CO2+OH-=HCO D、氢氧化钡溶液与稀硫酸反应:Ba2++SO+2H++2OH-=BaSO4↓+2H2O13. 今年是门捷列夫发现元表周期律153周年。表格为元素周期表的一部分,针对表中用字母标出的元素,下列说法错误的是( )a
b
c
d
e
A、a、b元素组成的化合物可能存在同分异构现象 B、c元素形成的单质存在同素异形体 C、c、d元素组成的化合物晶体中存在分子 D、e元素存在同位素14. 某溶液中所含离子的浓度如表,则X可能为( )离子
H+
K+
X
MnO
SO
浓度(mol•L-1)
0.4
0.2
0.1
0.4
0.2
A、Fe2+ B、NH C、Ba2+ D、Cu2+15. 将MgSO4、CuSO4的混合溶液平均分成两等份。一份加入足量BaCl2 , 产生沉淀2.33g;另一份加入100mLNaOH溶液,金属离子给好沉淀完全,则该NaOH溶液的浓度为( )A、0.2mol•L-1 B、0.4mol•L-1 C、0.5mol•L-1 D、1mol•L-1二、多选题
-
16. 价—类二维图是学习元素化合物知识的重要方法,某同学绘制某常见元素的价—类二维图如图。下列推断合理的是
 A、Ba(OH)2溶液与h的稀溶液、i的可溶性正盐反应的离子方程式相同 B、由d生成g在工业上是在接触室内完成的 C、f为弱电解质 D、常温下,Fe在h的浓溶液中钝化17. 把碎纸片b、c、d、e补充到a中,可得到一个完整的离子方程式(未配平)。下列说法正确的是( )
A、Ba(OH)2溶液与h的稀溶液、i的可溶性正盐反应的离子方程式相同 B、由d生成g在工业上是在接触室内完成的 C、f为弱电解质 D、常温下,Fe在h的浓溶液中钝化17. 把碎纸片b、c、d、e补充到a中,可得到一个完整的离子方程式(未配平)。下列说法正确的是( )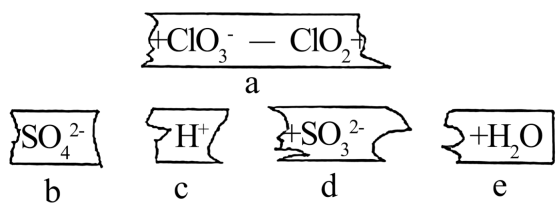 A、纸条排列的顺序可能是:c、d、a、b、e B、通过该反应可知还原性:ClO>SO C、氧化剂与还原剂的物质的量比为2:1 D、每生成1molClO2 , 反应转移的电子数为2NA18. 下列实验现象与结论均正确的是( )
A、纸条排列的顺序可能是:c、d、a、b、e B、通过该反应可知还原性:ClO>SO C、氧化剂与还原剂的物质的量比为2:1 D、每生成1molClO2 , 反应转移的电子数为2NA18. 下列实验现象与结论均正确的是( )选项
实验操作
实验现象
实验结论
A
用蘸有浓硫酸的玻璃棒在白纸上写字
一段时间后字变黑
浓H2SO4有吸水性
B
将SO2通入到H2S溶液中
产生淡黄色沉淀
SO2有氧化性
C
将银白色的金属钠放置在空气中
钠表面很快变暗
金属钠具有强还原性
D
将Cl2通入到放有鲜花的试剂瓶中
鲜花褪色
Cl2有漂白性
A、A B、B C、C D、D三、综合题
-
19. 如图为铜丝与浓硫酸反应并验证其产物性质的实验装置:
 (1)、试管A中反应的化学方程式是。(2)、加热一段时间后,试管B中溶液褪色,说明SO2具有性。若要立即终止得与浓硫酸的反应,恰当的方法是。
(1)、试管A中反应的化学方程式是。(2)、加热一段时间后,试管B中溶液褪色,说明SO2具有性。若要立即终止得与浓硫酸的反应,恰当的方法是。A.撤去酒精灯 B.上移铜丝,使其脱离浓硫酸 C.拔掉橡胶塞倒出浓硫酸
(3)、试管C可以探究SO2与品红作用的可逆性,请写出实验操作及现象。(4)、反应停止后,试管D中溶液依然澄清,待装置冷却,把D取下后将其中溶液分成两份做如下实验:加入试剂
现象
结论
第一份
加入NaOH溶液
有白色沉淀生成
沉淀为(写化学式)
第二份
加入H2O2溶液
有白色沉淀生成
沉淀为(写化学式)
20. 海洋植物海带中含有丰富的碘元素,某化学学习小组为了验证海带中含有碘,在实验室从海带中提取碘的流程如图: (1)、第②步的操作名称是 , 用到的玻璃仪器有烧杯、玻璃棒和 , 检验溶液中含I-的方法是 , 海带中碘元素主要以NaI或KI的形式存在,设计实验证明含碘离了溶液中K+的存在。(2)、第③步:氧化。向含的溶液中加入过量的H2O2和稀H2SO4。配平其离子反应方程式。
(1)、第②步的操作名称是 , 用到的玻璃仪器有烧杯、玻璃棒和 , 检验溶液中含I-的方法是 , 海带中碘元素主要以NaI或KI的形式存在,设计实验证明含碘离了溶液中K+的存在。(2)、第③步:氧化。向含的溶液中加入过量的H2O2和稀H2SO4。配平其离子反应方程式。I-+H++H2O2=I2+H2O
(3)、第④步:萃取与分液。分液时若打开玻璃活塞后发现液体流不出,原因可能是。分液后上层液体中是否还有碘单质可以取少许溶液加入试剂来进行检验。(4)、第⑤步:通过蒸馏从碘的CCl4溶液中提取碘并回收CCl4。蒸馏操作前蒸馏烧瓶内需放几片碎瓷片的目的是 , 温度计水银球的位置是 , 冷凝管水流方向是。四、综合题
-
21. 大海中蕴藏着丰富的资源,部分化学资源获取途径如图:
 (1)、下列有关说法正确的是____。A、步骤Ⅰ中除去粗盐中的杂质离子Ca2+、Mg2+、SO , 加入试剂的先后顺序可以是BaCl2、Na2CO3、NaOH B、用澄清的石灰水可鉴别NaHCO3溶液和Na2CO3溶液 C、在第Ⅱ、Ⅲ、Ⅳ步骤中,溴元素均被氧化(2)、步骤Ⅳ蒸馏过程中不可能用到的仪器有____。A、温度计 B、容量瓶 C、直形冷凝管 D、酒精灯(3)、步骤Ⅲ用SO2水溶液吸收Br2 , 吸收率可达95%,有关反应的化学方程式为。(4)、经过步骤Ⅱ已获得Br2 , 不直接用含Br2的稀溶液进行蒸馏,而要经过“空气吹出、SO2吸收、通入氯气”后再蒸馏,其目的是。(5)、根据流程中的反应可判断SO2、Cl2、Br2三种物质的氧化性由强到弱的顺序为。22. 以电解饱和食盐水为基础制取氯气、烧碱等产品的工业称为氯碱工业,它是目前化学工业的重要支柱之一。(1)、写出电解饱和食盐水的离子反应方程式。(2)、电解饱和食盐水消耗117gNaCl时,转移电子的物质的量为mol,理论上可得到氯气的体积是L(标准状况)。(3)、若将1molCl2通入石灰乳中,理论上可得到Ca(ClO)2的质量是g。23. A、B、C、D、E、F为短周期主族元素,且原子序数依次增大,A为原子半径最小的元素,A、C常温下能形成两种液态化合物A2C和A2C2 , A、D同主族,C、F同主族,B元素质子数为A、D质子数之和的一半,E元素M层与K层电子数相同。
(1)、下列有关说法正确的是____。A、步骤Ⅰ中除去粗盐中的杂质离子Ca2+、Mg2+、SO , 加入试剂的先后顺序可以是BaCl2、Na2CO3、NaOH B、用澄清的石灰水可鉴别NaHCO3溶液和Na2CO3溶液 C、在第Ⅱ、Ⅲ、Ⅳ步骤中,溴元素均被氧化(2)、步骤Ⅳ蒸馏过程中不可能用到的仪器有____。A、温度计 B、容量瓶 C、直形冷凝管 D、酒精灯(3)、步骤Ⅲ用SO2水溶液吸收Br2 , 吸收率可达95%,有关反应的化学方程式为。(4)、经过步骤Ⅱ已获得Br2 , 不直接用含Br2的稀溶液进行蒸馏,而要经过“空气吹出、SO2吸收、通入氯气”后再蒸馏,其目的是。(5)、根据流程中的反应可判断SO2、Cl2、Br2三种物质的氧化性由强到弱的顺序为。22. 以电解饱和食盐水为基础制取氯气、烧碱等产品的工业称为氯碱工业,它是目前化学工业的重要支柱之一。(1)、写出电解饱和食盐水的离子反应方程式。(2)、电解饱和食盐水消耗117gNaCl时,转移电子的物质的量为mol,理论上可得到氯气的体积是L(标准状况)。(3)、若将1molCl2通入石灰乳中,理论上可得到Ca(ClO)2的质量是g。23. A、B、C、D、E、F为短周期主族元素,且原子序数依次增大,A为原子半径最小的元素,A、C常温下能形成两种液态化合物A2C和A2C2 , A、D同主族,C、F同主族,B元素质子数为A、D质子数之和的一半,E元素M层与K层电子数相同。请用化学用语回答下列问题:
(1)、E元素在周期表中的位置为;化合物D2F中含有的化学键为;化合物D2C2的电子式为。(2)、热稳定性:A2CA2F(填“>”或“<”):D、E的最高价氧化物对应水化物的碱性强弱:>。(填化学式)(3)、E在BC2中燃烧的化学方程式为。(4)、D单质与水反应的离子反应方程式。(5)、C,D,F三种元素形成的简单离子,其半径由大到小的顺序是。(用离子符号表示)五、计算题
-
24. 将130gZn投入100mL18mol•L-1浓硫酸中充分反应,最终剩余Zn32.5g,同时生成标准状况下的气体体积为aL。已知:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O。(1)、a=L。(2)、生成气体的物质的量分别为。(3)、将反应后的溶液稀释至1L,所得溶液中SO浓度为。