北京市顺义区2021-2022学年高一上学期期末考试化学试题
试卷更新日期:2022-11-01 类型:期末考试
一、单选题
-
1. 我国“蛟龙”号载人潜水器已成功下潜至海中7062.68米处。“蛟龙”号载人潜水器的外壳是耐超高压的钛合金,有关钛合金的说法正确的是( )A、钛合金是纯净物 B、钛合金是混合物 C、钛合金的硬度与钛单质相同 D、钛合金熔点比钛单质高2. 下列元素的原子半径最大的是( )A、F B、Cl C、Br D、I3. 下列物质属于电解质的是( )A、Fe B、NaCl溶液 C、KOH D、蔗糖溶液4. 当光束通过下列分散系时,能观察到丁达尔效应的是( )A、氢氧化铁胶体 B、HCl溶液 C、NaOH溶液 D、K2SO4溶液5. 下列关于氯气性质的描述错误的是( )A、Fe在氯气中燃烧生成 B、能溶于水 C、有刺激性气味、有毒 D、能与氢气反应6. 下列物质含离子键的是( )A、HF B、NaCl C、CO2 D、CH47. 某粒子的结构示意图为
 , 关于该粒子的说法错误的是( ) A、核外电子数为18 B、核外有3个电子层 C、属于带负电荷的粒子 D、在化学反应中易得电子8. 单宁是一种天然防腐剂,可有效避免葡萄酒因氧化而变酸,下列判断正确的是( )A、单宁做还原剂 B、单宁做氧化剂 C、单宁被还原 D、单宁中某元素化合价降低9. 下列关于钠的说法错误的是( )A、钠的密度比水小,比煤油大 B、钠失火时,应该用沙土盖灭 C、钠与水反应的离子方程式为: D、钠在空气中燃烧,发出黄色火焰,生成淡黄色的10. 下列各组互为同位素的是( )A、O2和O3 B、CO和CO2 C、H2O和H2O2 D、和11. 对于反应Cl2+H2O=HCl+HClO叙述正确的是( )A、氯气既是氧化剂又是还原剂 B、水作还原剂 C、反应消耗1 mol Cl2 , 转移2 mol电子 D、反应产物都是强酸12. 下列电离方程式书写错误的是( )A、 B、 C、 D、13. “玉兔”号月球车用作为热源材料。下列关于的说法正确的是( )A、与互为同位素 B、与中子数相同 C、与化学性质相同 D、与电子数相同14. 下列有关反应的离子方程式错误的是( )A、氧化铁与稀盐酸混合: B、溶解Cu: C、碳酸氢钠溶液与稀反应: D、氯气与碘化钾溶液:15. 下列说法正确的是( )A、Na的摩尔质量是 B、22 g CO2物质的量为2.2 mol C、1 mol Cl2中含有的氯原子数约为 D、常温常压下,1 mol N2的体积是22.4 L16. 在无色溶液中能大量共存的一组离子是( )A、Cu2+、、K+、Cl- B、Ag+、Cl-、OH-、Na+ C、、Cl-、Na+、Ca2+ D、、OH-、Ba2+、Na+17. 反应NH4Cl+NaNO2=NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是( )A、中子数为18的氯原子: B、N2的结构式:N=N C、Na+的结构示意图:
, 关于该粒子的说法错误的是( ) A、核外电子数为18 B、核外有3个电子层 C、属于带负电荷的粒子 D、在化学反应中易得电子8. 单宁是一种天然防腐剂,可有效避免葡萄酒因氧化而变酸,下列判断正确的是( )A、单宁做还原剂 B、单宁做氧化剂 C、单宁被还原 D、单宁中某元素化合价降低9. 下列关于钠的说法错误的是( )A、钠的密度比水小,比煤油大 B、钠失火时,应该用沙土盖灭 C、钠与水反应的离子方程式为: D、钠在空气中燃烧,发出黄色火焰,生成淡黄色的10. 下列各组互为同位素的是( )A、O2和O3 B、CO和CO2 C、H2O和H2O2 D、和11. 对于反应Cl2+H2O=HCl+HClO叙述正确的是( )A、氯气既是氧化剂又是还原剂 B、水作还原剂 C、反应消耗1 mol Cl2 , 转移2 mol电子 D、反应产物都是强酸12. 下列电离方程式书写错误的是( )A、 B、 C、 D、13. “玉兔”号月球车用作为热源材料。下列关于的说法正确的是( )A、与互为同位素 B、与中子数相同 C、与化学性质相同 D、与电子数相同14. 下列有关反应的离子方程式错误的是( )A、氧化铁与稀盐酸混合: B、溶解Cu: C、碳酸氢钠溶液与稀反应: D、氯气与碘化钾溶液:15. 下列说法正确的是( )A、Na的摩尔质量是 B、22 g CO2物质的量为2.2 mol C、1 mol Cl2中含有的氯原子数约为 D、常温常压下,1 mol N2的体积是22.4 L16. 在无色溶液中能大量共存的一组离子是( )A、Cu2+、、K+、Cl- B、Ag+、Cl-、OH-、Na+ C、、Cl-、Na+、Ca2+ D、、OH-、Ba2+、Na+17. 反应NH4Cl+NaNO2=NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是( )A、中子数为18的氯原子: B、N2的结构式:N=N C、Na+的结构示意图: D、H2O的电子式:
D、H2O的电子式: 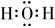 18. 已知两支试管中分别装有等浓度的Na2CO3和NaHCO3溶液,下列操作或判断正确的是( )
18. 已知两支试管中分别装有等浓度的Na2CO3和NaHCO3溶液,下列操作或判断正确的是( )选项
操作
判断
A
分别加入澄清石灰水
产生沉淀者为Na2CO3溶液
B
分别加入等浓度的稀盐酸
反应较剧烈者为Na2CO3溶液
C
分别滴加几滴酚酞
Na2CO3溶液红色更深
D
逐滴加入等浓度的盐酸
立即产生气泡者为Na2CO3溶液
A、A B、B C、C D、D19. 用表示阿伏加德罗常数,下列叙述正确的是( )。A、含有个氦原子的氦气,体积约为11.2L B、和的混合气体所含原子数为 C、标准状况下,含有的原子数为 D、常温常压下,含有的原子数为20. 下列关于实验Ⅰ~Ⅳ说法错误的是( ) A、用实验Ⅰ制备Fe(OH)3胶体时,当液体出现红褐色时,应立即停止加热 B、用实验Ⅱ制备Fe(OH)2沉淀,刚开始出现白色沉淀,很快变成灰绿色 C、若实验Ⅲ观察到火焰呈紫色,证明被检验的物质含有钾元素 D、实验Ⅳ观察到的现象是:开始生成白色沉淀,当氨水过量,沉淀消失21. 用如图所示装置进行Fe与水蒸气反应的实验(部分夹持装置已略去),下列有关说法错误的是( )
A、用实验Ⅰ制备Fe(OH)3胶体时,当液体出现红褐色时,应立即停止加热 B、用实验Ⅱ制备Fe(OH)2沉淀,刚开始出现白色沉淀,很快变成灰绿色 C、若实验Ⅲ观察到火焰呈紫色,证明被检验的物质含有钾元素 D、实验Ⅳ观察到的现象是:开始生成白色沉淀,当氨水过量,沉淀消失21. 用如图所示装置进行Fe与水蒸气反应的实验(部分夹持装置已略去),下列有关说法错误的是( ) A、装置A的作用是为实验提供持续不断的水蒸气 B、装置B中发生反应的化学方程式是 C、装置C中加入的固体干燥剂可能是碱石灰 D、点燃装置D处的气体前必须检验气体的纯度22. 短周期元素X、Y、Z、W在元素周期表中的位置如下表所示,已知Y、W的原子序数之和是Z的3倍,下列说法正确的是( )
A、装置A的作用是为实验提供持续不断的水蒸气 B、装置B中发生反应的化学方程式是 C、装置C中加入的固体干燥剂可能是碱石灰 D、点燃装置D处的气体前必须检验气体的纯度22. 短周期元素X、Y、Z、W在元素周期表中的位置如下表所示,已知Y、W的原子序数之和是Z的3倍,下列说法正确的是( ) A、原子半径:X<Y<Z B、气态氢化物的热稳定性:X>Z C、元素W与Mg形成的化合物含离子键 D、X的最高价氧化物为两性氧化物23. 将CO2注入无开采价值的深层煤层替换其中的CH4可以实现CO2的永久储存,储存CO2的过程如图所示:
A、原子半径:X<Y<Z B、气态氢化物的热稳定性:X>Z C、元素W与Mg形成的化合物含离子键 D、X的最高价氧化物为两性氧化物23. 将CO2注入无开采价值的深层煤层替换其中的CH4可以实现CO2的永久储存,储存CO2的过程如图所示:
下列有关说法错误的是( )
A、CH4是天然气的主要成分 B、CO2对环境的危害是形成酸雨 C、煤燃烧时发生了化学变化 D、图中“注入”的气体为混合物24. 下列“实验结论”与“实验操作及现象”相符的一组是( )选项
实验操作及现象
实验结论
A
向某溶液中加入AgNO3溶液,有白色沉淀生成
该溶液中一定含有Cl-
B
向某溶液中加入稀盐酸,有无色气体产生
该溶液中一定含有
C
向某溶液中加入氯水,再加KSCN溶液,溶液变为红色
该溶液中一定含有
D
将银白色的金属钠放置在空气中,钠表面很快变暗
金属钠具有还原性
A、A B、B C、C D、D25. 氨硼烷()是一种高效储氢材料,在催化剂作用下,能够与水反应放出氢气,反应历程如图所示:
下列说法正确的是( )
A、反应①中做还原剂 B、反应③中水被氧化 C、与水反应最多可产生 D、反应①②③④均为氧化还原反应二、填空题
-
26. 现有下列4种与生产生活相关的物质①氯化铁 ②过氧化钠 ③氧化铁 ④次氯酸钠。用序号填空:(1)、常用作油漆、涂料的红色颜料的是。(2)、常用于印刷电路板的“腐蚀液”的是。(3)、84消毒液的有效成分是。(4)、用作供氧气剂的是。27. 高铁的快速发展方便了人们的出行,工业上利用铝热反应焊接钢轨间的缝隙,反应的化学方程式如下: , 其中,Al(填“被氧化”或“被还原”),Fe2O3作(填“氧化剂”或“还原剂”)。在该反应中,若消耗了2 mol Al,则生成mol Fe。
三、综合题
-
28. 用如图装置(气密性好)研究Na与的反应。

实验步骤:
①将一定量浓盐酸滴在粉末上,立即产生黄绿色气体。
②待黄绿色气体均匀充满集气瓶时,关闭止水夹。
③再向钠粒上滴2滴水,片刻后钠燃烧,产生白烟,白色固体附着在集气瓶内壁上。
回答下列问题:
(1)、步骤①,黄绿色气体是 , 则的作用是(填“氧化剂”或“还原剂”)。(2)、步骤③引起钠燃烧的原因是。(3)、写出生成白色固体的电子式。(4)、右侧烧杯中发生反应的离子方程式为。29. 配制的NaOH溶液,试回答下列问题:(1)、选择仪器:完成本实验所必需的仪器有托盘天平(精确到0.1g)、药匙、量筒、烧杯、玻璃棒、、。(2)、计算、称量:需称量NaOH固体的质量为g。(3)、溶解、冷却:该步实验中需要使用玻璃棒,作用是。(4)、下图是该同学转移溶液的示意图:
图中有两处不正确,请指出图中不正确:①;②。
(5)、不规范的实验操作会导致实验结果出现误差,下列使所配制溶液的物质的量浓度偏低的是(填序号)。①在溶解过程中有少量液体溅出烧杯外
②定容时俯视刻度线
③定容后,将容量瓶振荡摇匀后,静置发现液面低于刻度线,于是又加入少量水至刻度线
30. 某化学兴趣小组检验实验室放置的溶液变质的情况:(1)、设计实验检验溶液变质的情况:实验方案
实验现象
实验结论
步骤1

溶液部分变质
步骤2
①将上述方案补充完整。
②若要除去变质的溶液中的杂质,方法是(写离子反应方程式)。
(2)、利用部分变质的溶液制备。①用流程图的形式表示用部分变质的溶液制备的过程;(如)。流程图为(用箭头表示转化关系,箭头上注明试剂、反应条件及操作)。
②若100mL该变质的溶液制得 , 则变质前溶液的浓度为(变质前后溶液的体积变化忽略不计)。
(3)、可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将转化为 , 以利于人体吸收,该同学通过实验证明了他猜想的正确性,他的实验方案为。31. 高铁酸钾是一种新型、高效、无毒的多功能水处理剂。资料:为紫色固体,微溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生 , 在碱性溶液中较稳定。
(1)、制备(夹持、加热仪器已略去)
①A为氯气发生装置,A中反应的离子方程式为。
②C为制备装置,写出次氯酸钾与氢氧化铁在碱性环境中反应的离子方程式。
(2)、探究的性质。取C中浅紫红色溶液,加入稀硫酸,产生黄绿色气体,经检验气体中含有。为证明是否是氧化而产生 , 某同学设计了如下方案:取少量反应后溶液,滴加KSCN溶液至过量,溶液呈红色。该同学由此认为是氧化而产生,请分析他的判断是否准确,说明理由。(3)、测定高铁酸钾的纯度。已知:(式量为198)与硫酸溶液的反应如下:取C中洗涤并干燥后样品的质量10.0g,加入稀硫酸,收集到0.672L气体(标准状况)。则样品中高铁酸钾的质量分数为。(计算结果保留到0.1%)
32. A、B、C、D四种化合物均由短周期元素组成,其中A含有四种元素,A、B、C的焰色反应均为黄色,D为无色无味气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去)。
请回答:
(1)、物质A的主要用途为。(2)、反应①的化学方程式为。(3)、反应②的离子方程式为。(4)、向B溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有A生成,该反应的化学方程式为。(5)、A含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用下图装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色沉淀,装置Ⅴ中可收集到一种无色气体,该气体能使带余烬的木条复燃。
反应Ⅱ中发生反应的化学方程式为。
33. 元素周期表体现了元素位置、结构和性质的关系,揭示了元素的内在联系。下表列出了①到⑧八种元素在周期表中的位置。周期
族
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
2
①
3
②
③
④
⑤
⑥
4
⑦
⑧
回答下列问题:
(1)、元素①形成单质的电子式为。(2)、元素②的单质与水反应的离子方程式为。(3)、元素④⑤⑥的简单离子半径最大的是(用离子符号表示)。(4)、用电子式表示元素③和元素⑥组成化合物的形成过程。(5)、元素④的单质与元素②最高价氧化物的水化物反应可以用于管道疏通,其原理为(用离子方程式表示)。(6)、下列对元素⑦的说法正确的是(填序号)。a.原子最外层有6个电子
b.元素的非金属性:⑧>⑦
c.能形成价的氧化物,该氧化物既有氧化性又有还原性
(7)、从原子结构的角度解释元素⑥的非金属性强于元素⑤的原因。