北京市怀柔区2021-2022学年高一上学期期末考试化学试题
试卷更新日期:2022-11-01 类型:期末考试
一、单选题
-
1. 二十四节是中国独有的传统文化,农谚“雷雨肥田”“雨生百谷”描述的都是谷雨节气。下列元素在自然界中的转化与“雷雨肥田”有关的是( )A、K B、P C、N D、O2. 下列仪器为容量瓶的是( )A、
 B、
B、 C、
C、 D、
D、 3. 当光束通过下列分散系时,能观察到丁达尔效应的是( )A、KCl溶液 B、NaNO3溶液 C、Fe(OH)3 胶体 D、Na2CO3 溶液4. 下列关于物质分类的叙述中,错误的是( )A、HClO属于酸 B、纯碱属于碱 C、SO3属于氧化物 D、Na2SO3属于盐5. 下列实验操作或事故处理方法正确的是( )A、金属钠着火,立即用水扑灭 B、实验结束后,用嘴吹灭酒精灯 C、皮肤上不慎沾上NaOH溶液,立即用盐酸冲洗 D、稀释浓硫酸时,将浓硫酸沿器壁慢慢注入水中,并不断搅拌6. 下列叙述中正确的是( )A、铁与浓硝酸反应产生对应的盐和氢气 B、常温下,浓硫酸可以用铝制容器盛放 C、金属与水反应均生成对应的氢氧化物和氢气 D、铁与硫反应的产物为硫化铁7. 下列物质属于常见还原剂的是( )A、活泼金属 B、KMnO4 C、HNO3 D、O28. 下列反应既是离子反应又是氧化还原反应的是( )A、铁片放入CuSO4溶液中 B、盐酸和氧化镁 C、BaCl2溶液中滴入稀硫酸 D、氢气还原氧化铜9. 在给定条件下,下列选项所示的物质间转化能实现的是( )A、SSO3 B、NaNa2O C、FeFeCl2 D、NaHCO3Na2CO310. 物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液中Cl-的物质的量浓度之比为( )A、1:1:1 B、1:2:3 C、3:2:1 D、3:4:311. 下列关于钠的化合物的叙述正确的是( )A、同温同浓度溶液的碱性:Na2CO3>NaHCO3 B、Na2O与Na2O2与水反应的产物完全相同 C、碳酸钠受热分解成Na2O和CO2 D、氯化钠固体不导电的原因是没有离子12. 在海洋碳循环中,通过下图所示的途径固碳。下列说法错误的是( )
3. 当光束通过下列分散系时,能观察到丁达尔效应的是( )A、KCl溶液 B、NaNO3溶液 C、Fe(OH)3 胶体 D、Na2CO3 溶液4. 下列关于物质分类的叙述中,错误的是( )A、HClO属于酸 B、纯碱属于碱 C、SO3属于氧化物 D、Na2SO3属于盐5. 下列实验操作或事故处理方法正确的是( )A、金属钠着火,立即用水扑灭 B、实验结束后,用嘴吹灭酒精灯 C、皮肤上不慎沾上NaOH溶液,立即用盐酸冲洗 D、稀释浓硫酸时,将浓硫酸沿器壁慢慢注入水中,并不断搅拌6. 下列叙述中正确的是( )A、铁与浓硝酸反应产生对应的盐和氢气 B、常温下,浓硫酸可以用铝制容器盛放 C、金属与水反应均生成对应的氢氧化物和氢气 D、铁与硫反应的产物为硫化铁7. 下列物质属于常见还原剂的是( )A、活泼金属 B、KMnO4 C、HNO3 D、O28. 下列反应既是离子反应又是氧化还原反应的是( )A、铁片放入CuSO4溶液中 B、盐酸和氧化镁 C、BaCl2溶液中滴入稀硫酸 D、氢气还原氧化铜9. 在给定条件下,下列选项所示的物质间转化能实现的是( )A、SSO3 B、NaNa2O C、FeFeCl2 D、NaHCO3Na2CO310. 物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液中Cl-的物质的量浓度之比为( )A、1:1:1 B、1:2:3 C、3:2:1 D、3:4:311. 下列关于钠的化合物的叙述正确的是( )A、同温同浓度溶液的碱性:Na2CO3>NaHCO3 B、Na2O与Na2O2与水反应的产物完全相同 C、碳酸钠受热分解成Na2O和CO2 D、氯化钠固体不导电的原因是没有离子12. 在海洋碳循环中,通过下图所示的途径固碳。下列说法错误的是( ) A、该循环过程中未涉及氧化还原反应 B、碳酸钠的电离方程式为Na2CO3=2Na++ C、该循环减少了碳的排放,有利于实现“碳达峰、碳中和” D、钙化作用的离子方程式之一为Ca2++=CaCO3↓13. 下列反应的离子方程式书写正确的是( )A、氢氧化钡溶液与硫酸溶液反应:Ba2++=BaSO4↓ B、钠与水反应:2Na+2H2O=2Na++2OH-+H2↑ C、碳酸钙与稀盐酸反应:+2H+=CO2↑+H2O D、碳酸钠溶液与过量盐酸反应:+H+=14. 喷泉实验装置如图所示,应用下列各组气体和溶液不会出现喷泉现象的是( )
A、该循环过程中未涉及氧化还原反应 B、碳酸钠的电离方程式为Na2CO3=2Na++ C、该循环减少了碳的排放,有利于实现“碳达峰、碳中和” D、钙化作用的离子方程式之一为Ca2++=CaCO3↓13. 下列反应的离子方程式书写正确的是( )A、氢氧化钡溶液与硫酸溶液反应:Ba2++=BaSO4↓ B、钠与水反应:2Na+2H2O=2Na++2OH-+H2↑ C、碳酸钙与稀盐酸反应:+2H+=CO2↑+H2O D、碳酸钠溶液与过量盐酸反应:+H+=14. 喷泉实验装置如图所示,应用下列各组气体和溶液不会出现喷泉现象的是( ) A、SO2和氨水 B、Cl2和饱和食盐水 C、NH3和水 D、HCl气体和水15. 某学生将一小块钠投入滴有酚酞的水中,此实验能证明钠下面4点性质中的①钠的密度比水的小②钠的熔点较低③钠与水反应时放出热量④钠与水反应后的溶液呈碱性( )A、①④ B、①②④ C、①③④ D、①②③④16. 下列溶液中的离子能够大量共存的一组是( )A、强碱性溶液中:Fe3+、、、Cl- B、透明的酸性溶液中:Cu2+、K+、Cl-、 C、含有0.1 mol/L的H+的溶液中:、I-、、K+ D、使酚酞溶液呈红色的溶液中:Na+、Mg2+、、17. 用NA代表阿伏加德罗常数的数值,下列说法错误的是( )A、100 mL0.1 mol·L-1的NaOH溶液中含有钠离子数为0.01NA B、0.1 mol CO2中含有的氧原子数为0.2NA C、标准状况下,2.24 LCO和NO混合气体中含有的氧原子数为0.1NA D、6.4 g Cu与足量热浓H2SO4充分反应,转移电子数为0.1NA18. 用下列实验装置进行相应实验,能达到实验目的的是( )
A、SO2和氨水 B、Cl2和饱和食盐水 C、NH3和水 D、HCl气体和水15. 某学生将一小块钠投入滴有酚酞的水中,此实验能证明钠下面4点性质中的①钠的密度比水的小②钠的熔点较低③钠与水反应时放出热量④钠与水反应后的溶液呈碱性( )A、①④ B、①②④ C、①③④ D、①②③④16. 下列溶液中的离子能够大量共存的一组是( )A、强碱性溶液中:Fe3+、、、Cl- B、透明的酸性溶液中:Cu2+、K+、Cl-、 C、含有0.1 mol/L的H+的溶液中:、I-、、K+ D、使酚酞溶液呈红色的溶液中:Na+、Mg2+、、17. 用NA代表阿伏加德罗常数的数值,下列说法错误的是( )A、100 mL0.1 mol·L-1的NaOH溶液中含有钠离子数为0.01NA B、0.1 mol CO2中含有的氧原子数为0.2NA C、标准状况下,2.24 LCO和NO混合气体中含有的氧原子数为0.1NA D、6.4 g Cu与足量热浓H2SO4充分反应,转移电子数为0.1NA18. 用下列实验装置进行相应实验,能达到实验目的的是( ) A、用图1所示装置除去Cl2中含有的少量HCl B、用图2所示装置利用NaCl溶液制备NaCl晶体 C、用图3所示装置除去Fe(OH)3胶体中的FeCl3 D、用图4所示装置验证碳酸钠比碳酸氢钠热稳定性好19. 某实验小组通过下图所示实验,探究Na2O2与水的反应:
A、用图1所示装置除去Cl2中含有的少量HCl B、用图2所示装置利用NaCl溶液制备NaCl晶体 C、用图3所示装置除去Fe(OH)3胶体中的FeCl3 D、用图4所示装置验证碳酸钠比碳酸氢钠热稳定性好19. 某实验小组通过下图所示实验,探究Na2O2与水的反应: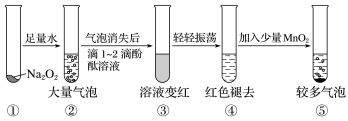
下列说法中正确的是( )
A、②中的大量气泡的主要成分是氢气 B、③中溶液变红,说明有酸性物质生成 C、④中现象可能是由于溶液中含有强氧化性物质造成的 D、⑤中MnO2的主要作用是降低了水中氧气的溶解度20. SO2在生产生活中用途广泛,关于SO2的下列说法错误的是( )A、SO2不属于电解质 B、SO2作氧化剂时,理论上可被还原为S C、SO2只具有还原性 D、SO2的水溶液在空气中放置,易被氧化21. 下列有关气体的制备和收集正确的是( )

A.制取氯气
B.制取氨气


C.制取二氧化硫
D.制取二氧化氮
A、A B、B C、C D、D22. 下列叙述错误的是( )选项
被提纯物质
杂质
除杂试剂或方法
A
FeCl3溶液
FeCl2
通入适量Cl2
B
Cl2
H2O (蒸气)
通入浓硫酸中
C
铜粉
铁粉
加入过量盐酸并过滤
D
CO2
HCl
通入饱和的碳酸钠溶液中
A、A B、B C、C D、D23. 将气体a通入溶液b中,始终无明显变化的是( )
选项
气体a
溶液b
A
Cl2
KI
B
CO2
CaCl2
C
SO2
Ba(NO3)2
D
NO2
FeSO4
A、A B、B C、C D、D24. 下列实验现象与结论均正确的是( )选项
实验操作
实验现象
实验结论
A
向未知液中滴加氯水,再滴加KSCN溶液
溶液呈红色
未知液中一定含有Fe2+
B
向无色溶液中滴加氯水,再加淀粉溶液
溶液变蓝
无色溶液中含有I-
C
浓硫酸滴入蔗糖中
蔗糖变黑、体积膨胀
浓硫酸具有吸水性
D
铜粉加入稀硫酸中,再加入少量硝酸钾固体
开始无明显现象,加入硝酸钾固体后溶液变蓝
硝酸钾起催化作用
A、A B、B C、C D、D25. 硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的混合气体通入FeCl3、FeCl2和CuCl2的混合溶液中回收S,其转化如图所示(CuS不溶于水)。下列说法中,错误的是( ) A、过程①中,生成CuS的反应为H2S+Cu2+=CuS↓+2H+ B、过程②中,Fe3+作氧化剂 C、转化图中化合价不变的元素只有铜和氯 D、回收S的总反应为2H2S+O2=2H2O+2S↓
A、过程①中,生成CuS的反应为H2S+Cu2+=CuS↓+2H+ B、过程②中,Fe3+作氧化剂 C、转化图中化合价不变的元素只有铜和氯 D、回收S的总反应为2H2S+O2=2H2O+2S↓二、填空题
-
26. 完成下列问题。(1)、有下列反应:
①SO3+H2O=H2SO4
②Cl2+H2O=HCl+HClO
③2F2+2H2O=4HF+O2
④CO2+2NaOH=Na2CO3+H2O
上述反应中不属于氧化还原反应的是(填序号,下同);H2O只作还原剂的是;属于氧化还原反应,但其中的H2O既不被氧化,又不被还原的是。
(2)、为治理汽车尾气中的NO和CO对环境的污染,可在汽车排气管上安装催化转化器,发生如下反应:2NO+2CON2+2CO2。①用双线桥标出电子转移的方向和数目。
②若消耗标况22.4 L的NO得到还原产物的质量为g,转移电子的物质的量为mol。
27. 从元素化合价和物质类别两个角度研究物质的性质是一种行之有效的方法。如图是由铁元素组成的物质的部分信息。 (1)、写出X的化学式:。(2)、①FeO与稀硫酸反应的离子方程式:。
(1)、写出X的化学式:。(2)、①FeO与稀硫酸反应的离子方程式:。②Y物质在空气中变化的化学方程式该变化的现象是。
(3)、一定量的铁粉在氯气中充分燃烧后,将所得固体完全溶于稀盐酸,制得溶液A。①推测溶液A中可能含有的金属阳离子:a.只有Fe3+; b.只有Fe2+;c.。
②甲同学为探究溶液的组成,实验如下:取少量溶液A置于试管中,加入KSCN溶液,溶液 , 说明假设b不成立,假设a或c成立;
(4)、乙同学继续探究溶液A的组成。查阅资料:16HCl+2KMnO4=2KCl+2MnCl2+5Cl2↑+8H2O
实验过程:另取少量溶液A置于试管中,逐滴加入酸性KMnO4溶液,充分振荡,KMnO4溶液紫色褪去。实验结论:(填写字母序号)。
A.可能有Fe2+ B.可能无Fe2+ C.一定有Fe2+
根据你选择的实验结论,简述理由:。
三、综合题
-
28. 下图为实验室某盐酸试剂瓶的标签,试根据标签上的有关数据回答下列问题:
盐酸
分子式:HCl
相对分子质量:36.5
密度:1.19g·cm-3
物质的量浓度:11.9mol·L-1
(1)、取用任意体积的该盐酸时,下列物理量中随所取体积的多少而变化的是____(填字母)。A、溶液中HCl的物质的量 B、相对分子质量 C、溶液的密度 D、溶液的物质的量浓度(2)、某学生欲用上述浓盐酸和蒸馏水配制500mL 0.50mol/L的稀盐酸。该学生需要量取mL上述浓盐酸进行配制。(3)、假设该同学成功配制了0.50mol/L的盐酸,他又用该盐酸中和含0.01mol溶质的NaOH溶液,则需要mL盐酸。(4)、在实际中和过程中发现消耗的盐酸体积比(3)中所求体积偏大,则可能的原因是____(填字母)。A、浓盐酸挥发,浓度不足 B、配制溶液时,未洗涤烧杯 C、定容时,俯视容量瓶刻度线 D、定容后经振荡、摇匀、静置,发现液面下降,未采取措施29. 实验小组设计了下图所示的实验装置模拟工业生产制备少量硝酸。 (1)、实验时先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达到700℃以上,由此可知该反应是反应(填“吸热”或“放热”),反应的化学方程式是。(2)、装置A的作用时。(3)、B中可以得到少量硝酸,B中试剂为 , 可能发生的反应为。(4)、NaOH溶液的作用是。(5)、控制氨气和氧气的比例是制备硝酸的关键。当比例不合适时,A中不仅有红棕色气体产生,还伴有白烟。推测红棕色气体的化学式是 , 白烟的化学式是。30. 1774年,舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为Chlorine(中文命名“氯气”)。(1)、实验室沿用舍勒的方法制取Cl2的化学方程式为。(2)、将氯气通入氢氧化钠溶液可制得漂白液,该过程的离子方程式。(3)、用Cl2可制备HClO溶液,该溶液不能长期存放,用化学方程式解释原因。验证久置次氯酸溶液中存在的阴离子的试验方案是。(4)、将HClO溶液加入到滴有酚酞的NaOH溶液中,观察到溶液红色褪去,探究红色褪去的原因。取褪色后溶液加入NaOH溶液,观察到溶液依然无色,说明。另取褪色后溶液加入酚酞,观察到溶液变红色,说明。31. 国家实施“青山绿水”工程,故加大力度研究脱硫以及“三废”处理技术意义重大。某工厂拟综合处理工业废气(主要含、、、NO、CO,不考虑其他成分)和含的废水,设计了如下流程:
(1)、实验时先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达到700℃以上,由此可知该反应是反应(填“吸热”或“放热”),反应的化学方程式是。(2)、装置A的作用时。(3)、B中可以得到少量硝酸,B中试剂为 , 可能发生的反应为。(4)、NaOH溶液的作用是。(5)、控制氨气和氧气的比例是制备硝酸的关键。当比例不合适时,A中不仅有红棕色气体产生,还伴有白烟。推测红棕色气体的化学式是 , 白烟的化学式是。30. 1774年,舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为Chlorine(中文命名“氯气”)。(1)、实验室沿用舍勒的方法制取Cl2的化学方程式为。(2)、将氯气通入氢氧化钠溶液可制得漂白液,该过程的离子方程式。(3)、用Cl2可制备HClO溶液,该溶液不能长期存放,用化学方程式解释原因。验证久置次氯酸溶液中存在的阴离子的试验方案是。(4)、将HClO溶液加入到滴有酚酞的NaOH溶液中,观察到溶液红色褪去,探究红色褪去的原因。取褪色后溶液加入NaOH溶液,观察到溶液依然无色,说明。另取褪色后溶液加入酚酞,观察到溶液变红色,说明。31. 国家实施“青山绿水”工程,故加大力度研究脱硫以及“三废”处理技术意义重大。某工厂拟综合处理工业废气(主要含、、、NO、CO,不考虑其他成分)和含的废水,设计了如下流程: (1)、在、、CO、NaOH中,属于电解质的是(填化学式,下同),属于酸性氧化物的是。(2)、固体1中除含有外,还含有、。(3)、生成的反应可表示为: , 该反应中还原剂是;捕获剂所捕获的气体主要是。(4)、处理含的废水时,若参加反应时,需要的NaNO2的物质的量为mol。
(1)、在、、CO、NaOH中,属于电解质的是(填化学式,下同),属于酸性氧化物的是。(2)、固体1中除含有外,还含有、。(3)、生成的反应可表示为: , 该反应中还原剂是;捕获剂所捕获的气体主要是。(4)、处理含的废水时,若参加反应时,需要的NaNO2的物质的量为mol。