北京市东城区2021-2022学年高一上学期期末考试化学试题
试卷更新日期:2022-11-01 类型:期末考试
一、单选题
-
1. 下列所用材料不属于合金的是( )




A.出土文物青铜器
B.不锈钢手术器械
C.青花瓷将军罐
D.火箭外壳镁铝合金
A、A B、B C、C D、D2. 下列属于电解质的是( )A、氯化钠溶液 B、氢氧化钠 C、二氧化碳 D、金属锌3. 下列属于两性氧化物的是( )A、H2O B、SO3 C、FeO D、Al2O34. 下列物质含有非极性共价键的是( )A、NaOH B、H2 C、H2S D、MgCl25. 当光束通过下列分散系时,能观察到丁达尔效应的是( )A、KCl溶液 B、Fe(OH)3胶体 C、KOH溶液 D、Na2SO4溶液6. 下列物质进行焰色试验,其火焰为黄色的是( )A、Na2SO4 B、Mg(OH)2 C、KCl D、HNO37. 下列物质互为同素异形体的是( )A、H2O和H2O2 B、和 C、NO和NO2 D、O2和O38. 下列做法存在安全隐患的是( )A、点燃可燃性气体前,需对气体进行验纯 B、大量氯气泄漏时,应尽量顺风迅速离开现场 C、熄灭少量燃着的金属钠,需用干燥沙土覆盖 D、闻气体时用手轻轻扇动,使少量气体飘进鼻孔9. 配置一定物质的量浓度的溶液不需要用到的仪器是( )A、玻璃棒 B、容量瓶 C、圆底烧瓶 D、胶头滴管10. 下列物质中酸性最强的是( )A、H2CO3 B、H2SiO3 C、H2SO4 D、HClO411. 下列有关物质的用途错误的是( )A、碳酸氢钠可用作焙制糕点 B、氧化铁用作油漆、涂料的红色颜料 C、臭氧、二氧化氯是用作自来水消毒剂 D、氯化亚铁溶液用作印刷电路板的腐蚀液12. 下列物质能与水反应,且不属于氧化还原反应的是( )A、金属钠 B、氧化钠 C、过氧化钠 D、氢氧化钠13. 下列化学用语或图示表达错误的是( )A、H2O的结构式: B、CO2的分子结构模型:
B、CO2的分子结构模型: C、NaCl的电子式:
C、NaCl的电子式: D、中子数为8的氮原子:
14. 下列反应的离子方程式正确的是( )A、铁粉与氯化铁溶液反应:Fe+Fe3+=2Fe2+ B、用稀盐酸除去铁表面的铁锈:Fe2O3+6H+=2Fe3++3H2O C、用大理石与稀盐酸反应制备二氧化碳:+2H+=H2O+CO2↑ D、稀硫酸与氢氧化钡溶液反应:H+++Ba2++OH-=BaSO4↓+H2O15. 下列说法错误的是( )A、H2O的摩尔质量为18g/mol B、标准状况下,1molN2的体积是22.4L C、44gCO2中含有的氧原子数约为6.02×1023 D、0.5mol·L-1Na2CO3溶液中c(Na+)是1mol·L-116. 某同学探究铁与水蒸气的反应,进行了如下实验:
D、中子数为8的氮原子:
14. 下列反应的离子方程式正确的是( )A、铁粉与氯化铁溶液反应:Fe+Fe3+=2Fe2+ B、用稀盐酸除去铁表面的铁锈:Fe2O3+6H+=2Fe3++3H2O C、用大理石与稀盐酸反应制备二氧化碳:+2H+=H2O+CO2↑ D、稀硫酸与氢氧化钡溶液反应:H+++Ba2++OH-=BaSO4↓+H2O15. 下列说法错误的是( )A、H2O的摩尔质量为18g/mol B、标准状况下,1molN2的体积是22.4L C、44gCO2中含有的氧原子数约为6.02×1023 D、0.5mol·L-1Na2CO3溶液中c(Na+)是1mol·L-116. 某同学探究铁与水蒸气的反应,进行了如下实验:
下列说法中错误的是( )
A、点燃酒精灯的顺序是先a后b B、湿棉花的作用是提供水蒸气 C、由肥皂液冒气泡证明铁与水蒸气发生了反应 D、不能用磁铁将铁粉从反应后的固体中分离出来17. M与N反应时,不能实现图示电子转移的是( )选项
M
N
电子转移
A
H2
Cl2

B
Fe
FeCl3
C
Al
H2SO4(稀)
D
Cl2
H2O
A、A B、B C、C D、D18. 高铁酸钾(K2FeO4)是一种环保、高效、多功能饮用水处理剂,在水处理过程中,高铁酸钾转化为Fe(OH)3胶体,制备高铁酸钾流程如图所示。
下列叙述错误的是( )
A、反应I的化学方程式是2Fe+3Cl22FeCl3 B、用FeCl2溶液吸收反应I中尾气所得产物可再利用 C、反应II中氧化剂与还原剂的物质的量之比为2∶3 D、用K2FeO4对饮用水杀菌消毒的同时,Fe(OH)3胶体吸附杂质净化水19. 用砂纸仔细打磨铝片后,称取质量均为2.7g的两块铝片,将其中一铝片迅速放入120mL2mol/LNaOH溶液中,另一铝片在空气中放置一段时间后,再放入等浓度等体积的NaOH溶液中。下列说法错误的是( ) A、均有氧化还原反应发生 B、消耗NaOH的物质的量相同 C、均有气体生成,且体积相同 D、均有NaAlO2生成,且质量相同20. 相同温度和压强下,研究在不同溶液中,溶解Cl2的量[c(Cl2)]随溶液浓度的变化,见下图。
A、均有氧化还原反应发生 B、消耗NaOH的物质的量相同 C、均有气体生成,且体积相同 D、均有NaAlO2生成,且质量相同20. 相同温度和压强下,研究在不同溶液中,溶解Cl2的量[c(Cl2)]随溶液浓度的变化,见下图。
注:c(Cl2)表示溶解Cl2的量,即单位体积内溶解Cl2的物质的量
下列说法错误的是( )
A、由图1可知,Cl2与Cl-结合生成 B、由图1可知,增大c(NaCl),c(Cl2)减小 C、由图2可知,增大c (H+),c(Cl2)减小 D、若将Cl2通入盐酸中,增大c(HCl),c(Cl2)一定减小二、综合题
-
21. 下表是元素周期表的一部分,表中所列序号分别代表周期中的一种元素。
族
周期
IA
IIA
IIIA
IVA
VA
VIA
VIIA
0
2
①
③
④
3
②
⑤
⑥
4
⑦
(1)、⑤的原子结构示意图是。(2)、①、②分别形成最高价氧化物对应水化物中,碱性大于(填化学式)。(3)、⑥、⑦形成氢化物中,稳定性:大于(填化学式)。(4)、②③④离子半径由大到小的顺序是(填离子符号)。(5)、从原子结构的角度解释非金属性⑥大于⑤的原因是。22. 化学小组同学为研究氯气制备和氯水的成分及性质进行了如下实验。(1)、【实验1】制备氯气。下图是实验室制取纯净、干燥氯气装置图。
M的名称是 , ①中反应的反应的化学方程式是。
(2)、③中存放的试剂是。(3)、⑤中反应的离子方程式是。(4)、【实验2】研究氯水性质。实验操作及现象如下表。资料:淀粉的特征反应——遇I2变蓝色
实验2-1
实验2-2
实验操作(氯水均为新制)


实验现象
溶液变蓝
石蕊溶液先变红,后褪色
实验2-1结论是。
(5)、实验2-2中溶液变红是由于溶液中含有;使溶液褪色的粒子是。(6)、证明氯水中含有氯离子的方案是。(7)、同学们发现久置的氯水会失去漂白性,溶液由黄绿色变为无色。为探究氯水失效的原因,进行实验:用强光照射盛有氯水的密闭广口瓶,并用传感器测定广口瓶中数据,得到如下曲线。
上两图中曲线变化的原因是。若在上述整个实验过程中测定溶液的pH, pH的变化是。
23. 铁是人体必需的微量元素,铁摄入不足可能引起缺铁性贫血。(1)、I.黑木耳中含有比较丰富的铁元素,某研学小组测定其含量。【铁元素的分离】在坩埚中高温灼烧黑木耳,使之完全灰化。用足量的酸充分溶解,过滤,滤液中铁元素的存在形式是Fe2+、。
(2)、【铁元素含量测定】 研学小组提出如下测量方案。i.沉淀法:向(1)滤液中加入足量NaOH溶液,过滤、洗涤沉淀、加热烘干、称量。请评价该测量方案是否可行 , 理由是。
ii.比色法:流程如下。

① 用离子方程式解释加入H2O2的目的是。
② 溶液a的颜色是。
③ 溶液颜色越深,光的透过能力越差,即透光率越小,含铁量越(填“高”或“低”)。
④若不加H2O2 , 测出黑木耳中铁元素的含量(填“偏大”或“偏小”)。
(3)、II.在肺部,血红蛋白中的亚铁血红素与O2结合,把O2送到各个组织器官。已知葡萄糖的分子式是C6H12O6。铁元素参与人体内的呼吸作用示意图如下图(部分中间产物已略去)。

①呼吸作用过程中, Fe2+的作用是。
②具有还原性的酶是。
③该过程总反应的化学方程式是。
24. 关注物质的宏观组成和微观构成,是研究物质性质及其转化的基本出发点。(1)、从物质分类看,Na2CO3和NaHCO3均属于(选填序号),因此具有某些相似的化学性质。a.氧化物 b. 酸 c. 碱 d. 盐
(2)、探究Na2CO3和NaHCO3的相互转化。【实验1】 加热碳酸氢钠固体,装置如下图所示。

①利用上述装置可实现NaHCO3向 Na2CO3发生转化,试管中发生反应的化学方程式为。
【实验2】 分别向滴有2滴酚酞的NaHCO3和Na2CO3溶液中滴加稀盐酸,实验记录如下:
实验内容
实验现象

实验2-1
溶液浅红色褪去,立即产生大量气泡。
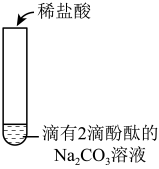
实验2-2
开始时,溶液的红色没有明显变化,也没有明显的气泡产生。继续滴加盐酸,当溶液的红色明显变浅时,气泡的数量也逐渐增多。当溶液的颜色变为浅红色,继续滴加盐酸,溶液的浅红色褪去,有大量气泡出现。
②实验2-1中,反应的离子方程式是
③实验2-2中,实现碳酸钠向碳酸氢钠转化的现象是。
④通过上述实验,从物质组成上分析Na2CO3转化为NaHCO3 , 加入盐酸的作用是;碳酸也可实现上述转化,写出将CO2通入Na2CO3溶液中发生反应的化学方程式:。
(3)、探究NaCl转化为NaHCO3。资料i:
物质
NaCl
NaHCO3
NH4HCO3
NH4Cl
20℃时的溶解度(g/100gH 2O)
36.0
9.6
21.7
37.2
资料ii:氨气(NH3)可与水发生反应,生成一水合氨(NH3∙H2O),一水合氨属于一种碱。
①向饱和NaCl溶液中通入足量CO2 , 无NaHCO3生成,原因是。
②向饱和NaCl溶液中先通入NH3 , 再通入CO2 , 在溶液中可析出NaHCO3晶体,该反应的化学方程式 , 通入NH3的作用是。
25. 磷元素形成的单质、化合物用途广泛。请回答下列问题。(1)、磷元素在周期表中的位置是。(2)、磷元素形成的单质白磷,在军事上可用作燃烧弹,该反应的化学方程式是。(3)、磷元素可以形成多种含氧酸。①过多饮用含磷酸(H3PO4)的饮料,会导致人体的骨密度降低。磷酸的结构式为
 , 其结构中画圈部分可电离出H+ , 故称为三元酸。磷酸与氢氧化钠完全中和时,反应的化学方程式是。
, 其结构中画圈部分可电离出H+ , 故称为三元酸。磷酸与氢氧化钠完全中和时,反应的化学方程式是。②次磷酸(H3PO2)的结构式为
 , 在工业上可做还原剂,请从化合价的角度解释原因是;100mL 1mol/L次磷酸与2mol/LNaOH溶液恰好反应,消耗NaOH溶液的体积是mL。
, 在工业上可做还原剂,请从化合价的角度解释原因是;100mL 1mol/L次磷酸与2mol/LNaOH溶液恰好反应,消耗NaOH溶液的体积是mL。