天津市南开区2021-2022学年高二上学期期末考试化学试题
试卷更新日期:2022-11-01 类型:期末考试
一、单选题
-
1. 向水中加入下列溶质,能促进水电离的是( )A、 B、NaOH C、NaCl D、2. 下列溶液一定显酸性的是( )A、含有 B、pH<7 C、 D、滴加酚酞溶液不变红3. 下列各组离子,能在溶液中大量共存的是( )A、、、、 B、、、、 C、、、、 D、、、、4. 科学家通过观察金星的酸性云层,分析出金星存在磷化氢气体,从而推测金星可能存在生命的迹象。下列关于P元素的说法中,错误的是( )A、第一电离能:P<S B、原子半径:S<P C、非金属性:P<S D、电负性:P<S5. 某基态原子的价层电子的轨道表示式为
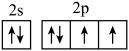 ,下列说法正确的是( ) A、最外层有4个电子 B、有2种能量不同的电子 C、s电子的电子云轮廓图是圆形 D、有5种空间运动状态不同的电子6. 下列事实与盐类水解无关的是( )A、用制备 B、铝盐、铁盐作净水剂 C、实验室配制溶液时,加少量铁粉 D、向沸水中滴入饱和溶液制胶体7. 下列关于冰融化为水的过程判断正确的是( )A、 B、 C、 D、8. 合成氨工业中采用循环操作,主要原因是( )A、降低氨的沸点 B、提高氮气和氢气的利用率 C、增大化学反应速率 D、提高平衡混合物中氨的含量9. 碘在不同状态下与氢气反应的热化学方程式如下所示。
,下列说法正确的是( ) A、最外层有4个电子 B、有2种能量不同的电子 C、s电子的电子云轮廓图是圆形 D、有5种空间运动状态不同的电子6. 下列事实与盐类水解无关的是( )A、用制备 B、铝盐、铁盐作净水剂 C、实验室配制溶液时,加少量铁粉 D、向沸水中滴入饱和溶液制胶体7. 下列关于冰融化为水的过程判断正确的是( )A、 B、 C、 D、8. 合成氨工业中采用循环操作,主要原因是( )A、降低氨的沸点 B、提高氮气和氢气的利用率 C、增大化学反应速率 D、提高平衡混合物中氨的含量9. 碘在不同状态下与氢气反应的热化学方程式如下所示。①
②
下列说法正确的是( )
A、 B、比热稳定性更好 C、1mol固态碘升华时 D、①的反应物总能量比②的反应物总能量低10. 已知:。若断裂、需要吸收的能量分别为436kJ、945.6kJ,则断裂需要吸收的能量为( )A、391kJ B、737kJ C、1173kJ D、1474kJ11. 在容积不变的密闭容器中,A与B反应生成C,其化学反应速率分别用、、表示。已知:、 , 则该反应可表示为( )A、 B、 C、 D、12. 将等浓度、等体积的盐酸与醋酸分别与足量的镁条反应,测得密闭容器中压强随时间的变化曲线如下图所示。
下列说法错误的是( )
A、反应过程中盐酸中下降更快 B、反应开始前:盐酸>醋酸 C、反应结束时两容器内相等 D、曲线②表示盐酸与镁条反应13. 常温下 , 。下列说法正确的是( )A、一定浓度的溶液加水稀释,所有离子的浓度均减小 B、的溶液和的氨水等体积混合后 C、等浓度的和溶液中阴离子浓度之和,前者小于后者 D、等浓度、等体积的溶液和氨水分别与固体反应,消耗的量多14. 工业上利用CO和H2合成二甲醚:3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g) ΔH。其它条件不变时,相同时间内CO的转化率随温度T的变化情况如图所示。下列说法错误的是( ) A、ΔH<0 B、状态X时,v消耗(CO)=v生成(CO) C、相同温度时,增大压强,可以提高CO的转化率 D、状态X时,选择合适催化剂,可以提高相同时间内CO的转化率15. 如图为氯碱工业的简易装置示意图,其中两电极均为惰性电极。 下列说法正确的是( )
A、ΔH<0 B、状态X时,v消耗(CO)=v生成(CO) C、相同温度时,增大压强,可以提高CO的转化率 D、状态X时,选择合适催化剂,可以提高相同时间内CO的转化率15. 如图为氯碱工业的简易装置示意图,其中两电极均为惰性电极。 下列说法正确的是( ) A、a 处得到的是浓 NaOH 溶液 B、适当降低阳极电解液的 pH 有利于 Cl2 逸出 C、粗盐水中含有的少量 Ca2+和 Mg2+可用 NaOH 除去 D、若电路中通过 0.2mol 电子,理论上可在 b 处得到标准状况下 1.12L 气体
A、a 处得到的是浓 NaOH 溶液 B、适当降低阳极电解液的 pH 有利于 Cl2 逸出 C、粗盐水中含有的少量 Ca2+和 Mg2+可用 NaOH 除去 D、若电路中通过 0.2mol 电子,理论上可在 b 处得到标准状况下 1.12L 气体二、综合题
-
16. 铜单质及其化合物应用十分广泛。回答下列问题:(1)、Cu位于元素周期表中第四周期第族,属于(填“d”或“ds”)区。(2)、基态Cu原子的电子排布式为。(3)、若要在铁制品表面镀铜,电镀液用硫酸铜溶液,则铜应与电源的(填“正”或“负”)极相连。(4)、利用电解法可将含有Fe、Zn、Ag、Pt等杂质的粗铜提纯,电解时阴极反应式为 , 电解后电解槽底部会形成含有少量等金属的阳极泥。(5)、写出以石墨棒为电极,电解足量溶液的总反应方程式:。(6)、在某温度下,向含有固体的饱和溶液中加入少量硫酸铜,则的溶解度(填“增大”、“减小”或“不变”,下同), , 。17. 氢能是一种极具发展潜力的清洁能源,以下反应是目前大规模制取氢气的重要方法之一:。回答下列问题:(1)、欲提高CO的平衡转化率,理论上可以采取的措施为。
a.通入过量CO b.升高温度 c.加入催化剂 d.通入过量水蒸气
(2)、800℃时,该反应的平衡常数 , 在容积为1L的密闭容器中进行反应,测得某一时刻混合物中CO、、、的物质的量分别为1mol、3mol、1mol、1mol。①写出该反应的平衡常数表达式。
②该时刻反应的进行方向为(填“正向进行”、“逆向进行”或“已达平衡”)。
(3)、830℃时,该反应的平衡常数 , 在容积为1L的密闭容器中,将2molCO与混合加热到830℃。反应达平衡时CO的转化率为。(4)、下图表示不同温度条件下,CO平衡转化率随着的变化趋势。判断、的大小关系: , 判断理由为。 (5)、以氢气为燃料的氢氧燃料电池,碱性电解质溶液时,负极反应式为。18. 化学是一门以实验为基础的学科。回答下列问题:(1)、Ⅰ.中和反应反应热的测定。
(5)、以氢气为燃料的氢氧燃料电池,碱性电解质溶液时,负极反应式为。18. 化学是一门以实验为基础的学科。回答下列问题:(1)、Ⅰ.中和反应反应热的测定。测定50mL 0.50mol/L盐酸和50mL 0.55mol/L NaOH溶液中和反应时放出的热量。
采用稍过量的NaOH溶液的原因是。
(2)、若两种溶液的密度均为 , 反应后生成溶液的比热容 , 反应过程中测得体系温度升高3℃,则该反应放出kJ热量。(3)、Ⅱ.温度对化学平衡的影响。在生成的反应中,存在如下平衡:。取两个封装有和混合气体的圆底烧瓶,将它们分别浸在盛有热水、冷水的大烧杯中。片刻后,比较两个烧瓶里气体的颜色,浸在(填“热水”或“冷水”)中的颜色更深,产生这一现象的原因是。
(4)、ⅢI.简易原电池反应。培养皿内装有含NaCl饱和溶液的琼脂,再滴入5~6滴酚酞溶液和溶液,混合均匀,铁钉用砂纸磨光,缠上铜丝放入培养皿中。一段时间后,可观察到没有缠铜丝的铁钉附近产生色的(填化学式)沉淀;铜丝周围的现象是 , 发生的电极反应式为。
 19. 在25℃时对氨水进行如下操作。回答下列问题:(1)、向氨水中加入少量水,则溶液中将(填“增大”、“减小”或“不变”)。(2)、向0.1mol/L20mL氨水中逐滴加入0.1mol/L VmL盐酸。
19. 在25℃时对氨水进行如下操作。回答下列问题:(1)、向氨水中加入少量水,则溶液中将(填“增大”、“减小”或“不变”)。(2)、向0.1mol/L20mL氨水中逐滴加入0.1mol/L VmL盐酸。①若使氨水恰好被中和,则所得溶液的pH7(填“>”、“<”或“=”),用离子方程式表示其原因:。
②若所得溶液 , 则此时加入盐酸的体积V20mL(填“>”、“<”或“=”),溶液中、、、的大小关系为。
③若加入盐酸的体积 , 则此时溶液中mol/L。
(3)、向溶液中加入1mL 0.1mol/L氨水,有白色沉淀产生,继续加入4滴溶液,观察到白色沉淀变为红褐色。试用离子方程式解释白色沉淀变为红褐色的原因:。(4)、向溶液中滴加氨水产生蓝色沉淀,若所得溶液 , 已知 , 则溶液中mol/L。