河北省唐山市2021-2022学年高二上学期期末考试化学试题
试卷更新日期:2022-11-01 类型:期末考试
一、单选题
-
1. 为了实现“碳达峰”和“碳中和”,太阳能的利用逐渐得到重视。下列说法错误的是( )A、煤、石油和天然气都属于碳素燃料 B、发展太阳能经济有助于减缓温室效应 C、太阳能电池可将太阳能直接转化为电能 D、太阳能的直接利用只有“光—电转换”和“光—生物质能转换”两种形式2. 下列变化过程中,△S<0的是( )A、氨气与氯化氢反应产生白烟 B、蔗糖溶于水 C、浓硝酸见光分解 D、锌粒投入盐酸中3. 下列物质在水溶液中,溶质存在电离平衡的是( )A、NaHSO4 B、CH3COOH C、BaSO4 D、CH3COONa4. 等物质的量浓度的下列各溶液中NH浓度最大的( )A、NH4Cl溶液 B、NH4HSO4溶液 C、(NH4)2CO3溶液 D、氨水5. 下列水解的离子方程式正确的是( )A、NH+2H2ONH3·H2O+H3O+ B、I-+H2OHI+OH- C、CO+2H2OH2CO3+2OH- D、Al3++3H2O=Al(OH)3+3H+6. 下列选项中出现的情况不能用勒夏特列原理解释的是( )A、使用含有氟化钠的牙膏可以防止龋齿 B、硫酸亚铁溶液在空气中久置产生红褐色沉淀 C、保存过久的古书籍易腐烂,因为古代的纸张中含有硫酸铝 D、在净水过程中,除了加入明矾外,往往再加入少量碳酸氢钠,以增强净水能力7. 下列说法错误的是( )A、活化能越小,化学反应速率越大 B、有催化剂参与的化学反应至少含有两个或多个基元反应 C、增大压强、升高温度均可提高反应物中活化分子百分数 D、在化学反应中,能量较高,有可能发生有效碰撞的分子称为活化分子8. 下列有关化学实验说法正确的是( )
 A、铁片上电镀锌时,通常把铁片做阳极 B、如图验证热效应的氢氧化钡晶体与氯化铵晶体反应操作中,通常小木板上要洒少量水 C、反应热测量时,量筒中的氢氧化钠溶液要缓慢倒入盛有盐酸的简易量热计中 D、为了证明HClO是弱酸,可用广泛pH试纸测常温下NaClO溶液的pH9. 已知各共价键的键能如下表所示,下列说法正确的是( )
A、铁片上电镀锌时,通常把铁片做阳极 B、如图验证热效应的氢氧化钡晶体与氯化铵晶体反应操作中,通常小木板上要洒少量水 C、反应热测量时,量筒中的氢氧化钠溶液要缓慢倒入盛有盐酸的简易量热计中 D、为了证明HClO是弱酸,可用广泛pH试纸测常温下NaClO溶液的pH9. 已知各共价键的键能如下表所示,下列说法正确的是( )共价键
H-H
F-F
H-F
H-Cl
H-I
键能E(kJ/mol)
436
157
568
432
298
A、稳定性:H-I>H-Cl>H-F B、表中看出F2能量最低 C、432k/mol>E(H-Br)>298kJ/mol D、H2(g)+F2(g)=2HF(g)△H=+25 kJ/mol10. 电化学腐蚀及防护的研究装置如图所示。下列有关说法正确的是( ) A、若a为镁条,装置中铁片腐蚀加快 B、若a为石墨,装置中铁片为正极 C、若a为锌块,装置中a表面发生还原反应 D、若a为铜片,装置中a上电极反应为O2+2H2O+4e-=4OH-11. 反应2NO2(g,红棕色)N2O4(g,无色)是ΔV≠0的可逆反应。反应体系颜色的深浅与体系中的浓度成正比。色度传感器能感受被分辨物体的色度,并转换成可输出信号由计算机自动记录透射率的变化,颜色越深,透射率越小。按图1连接好实验装置,在注射器中收集一定量的NO2 , 经过一系列校对准备,点击“开始”,推拉注射器活塞,系统自动记录透射率的变化曲线如图2所示,下列叙述中错误的是( )
A、若a为镁条,装置中铁片腐蚀加快 B、若a为石墨,装置中铁片为正极 C、若a为锌块,装置中a表面发生还原反应 D、若a为铜片,装置中a上电极反应为O2+2H2O+4e-=4OH-11. 反应2NO2(g,红棕色)N2O4(g,无色)是ΔV≠0的可逆反应。反应体系颜色的深浅与体系中的浓度成正比。色度传感器能感受被分辨物体的色度,并转换成可输出信号由计算机自动记录透射率的变化,颜色越深,透射率越小。按图1连接好实验装置,在注射器中收集一定量的NO2 , 经过一系列校对准备,点击“开始”,推拉注射器活塞,系统自动记录透射率的变化曲线如图2所示,下列叙述中错误的是( ) A、A→B段的操作是将活塞迅速下推 B、B→C段的透射率增大,说明平衡正向发生了移动 C、D→E段的透射率增大,说明平衡正向发生了移动 D、G→H段表示体系在该实验条件下达到了一个新的平衡状态12. 25℃,下列各组离子在指定条件下,一定能大量共存的是( )A、c(H+)=0.1mol·L-1的溶液中:Cu2+、Al3+、SO、Cl- B、中性溶液中:Na+、Fe3+、CO、ClO- C、能使甲基红试液变红色的溶液中:K+、NH、HCO、NO D、能使淀粉碘化钾试纸变蓝的溶液中:Na+、NH、SO、Br-13. 已知25℃时,BaSO4在水中的沉淀溶解平衡曲线如图所示。恒温条件下向100mLBaSO4饱和溶液中加入400mL0.01mol·L-1Na2SO4溶液,下列叙述正确的是( )
A、A→B段的操作是将活塞迅速下推 B、B→C段的透射率增大,说明平衡正向发生了移动 C、D→E段的透射率增大,说明平衡正向发生了移动 D、G→H段表示体系在该实验条件下达到了一个新的平衡状态12. 25℃,下列各组离子在指定条件下,一定能大量共存的是( )A、c(H+)=0.1mol·L-1的溶液中:Cu2+、Al3+、SO、Cl- B、中性溶液中:Na+、Fe3+、CO、ClO- C、能使甲基红试液变红色的溶液中:K+、NH、HCO、NO D、能使淀粉碘化钾试纸变蓝的溶液中:Na+、NH、SO、Br-13. 已知25℃时,BaSO4在水中的沉淀溶解平衡曲线如图所示。恒温条件下向100mLBaSO4饱和溶液中加入400mL0.01mol·L-1Na2SO4溶液,下列叙述正确的是( ) A、溶液中析出沉淀,溶液中c(Ba2+)、c(SO)都变小 B、溶液中析出沉淀,最终溶液中c(SO)比原来的大 C、溶液中无沉淀析出,溶液中c(Ba2+)、c(SO)都变小 D、溶液中无沉淀析出,但最终溶液中c(SO)比原来的大14. 下列有关电解质溶液的说法正确的是( )A、向0.1 mol·L-1CH3COOH溶液中加入少量水,溶液中减小 B、将CH3COONa溶液从25℃升温至30℃,溶液中增大 C、向盐酸中加入氨水至中性,溶液中=1 D、向AgCl的饱和溶液中加入少量AgBr固体,溶液中不变15. 生产碳酸饮料时常添加的苯甲酸钠(C6H5COONa,缩写为NaA)可用作饮料的防腐剂。研究表明苯甲酸(HA)的抑菌能力显著高于A-。已知25℃时,HA的Ka=6.25×10-5 , H2CO3的Ka1=4.17×10-7 , Ka2=4.90×10-11。下列说法错误的是(温度为25℃,不考虑饮料中其他成分影响)( )A、当pH为6.0时,饮料中:=0.16 B、饮料中添加苯甲酸钠,促进了水的电离 C、提高CO2充气压力,饮料的抑菌能力提高 D、苯甲酸溶液中滴加Na2CO3溶液,有气泡产生
A、溶液中析出沉淀,溶液中c(Ba2+)、c(SO)都变小 B、溶液中析出沉淀,最终溶液中c(SO)比原来的大 C、溶液中无沉淀析出,溶液中c(Ba2+)、c(SO)都变小 D、溶液中无沉淀析出,但最终溶液中c(SO)比原来的大14. 下列有关电解质溶液的说法正确的是( )A、向0.1 mol·L-1CH3COOH溶液中加入少量水,溶液中减小 B、将CH3COONa溶液从25℃升温至30℃,溶液中增大 C、向盐酸中加入氨水至中性,溶液中=1 D、向AgCl的饱和溶液中加入少量AgBr固体,溶液中不变15. 生产碳酸饮料时常添加的苯甲酸钠(C6H5COONa,缩写为NaA)可用作饮料的防腐剂。研究表明苯甲酸(HA)的抑菌能力显著高于A-。已知25℃时,HA的Ka=6.25×10-5 , H2CO3的Ka1=4.17×10-7 , Ka2=4.90×10-11。下列说法错误的是(温度为25℃,不考虑饮料中其他成分影响)( )A、当pH为6.0时,饮料中:=0.16 B、饮料中添加苯甲酸钠,促进了水的电离 C、提高CO2充气压力,饮料的抑菌能力提高 D、苯甲酸溶液中滴加Na2CO3溶液,有气泡产生二、多选题
-
16. 下列有关电池的说法中错误的是( )A、原电池放电过程中,负极发生氧化反应 B、原电池工作时电子从负极出发,经外电路流向正极,再从正极经电解液回到负极构成闭合回路 C、某燃料电池用熔融碳酸盐作电解质,两极分别通入CO和O2 , 则通入CO的一极为负极,电极反应式为CO+2e-+CO=2CO2 D、根据自发氧化还原反应2Al+2NaOH+2H2O=2NaAlO2+3H2↑设计的原电池,可以是常温下用铁和铝作电极,用氢氧化钠溶液作电解质溶液17. 对于浓度均为0.1mol·L-1的①醋酸溶液;②氢氧化钠溶液;③醋酸钠溶液,下列说法中错误的是( )A、c(CH3COO-):③>① B、水电离出的c(OH-):②>③ C、①和②等体积混合后的溶液:c(OH-)=c(H+)+c(CH3COOH) D、①和③等体积混合后的溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)18. 按下图装置进行电解(氯化钠足量),若乙中横坐标x表示电路中通过电子的物质的量,纵坐标y表示反应物或生成物的物质的量,下列叙述错误的是( )
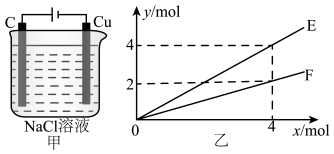 A、E表示生成金属钠的物质的量 B、E表示消耗水的物质的量 C、F表示溶解铜的物质的量 D、F表示生成氯气的物质的量
A、E表示生成金属钠的物质的量 B、E表示消耗水的物质的量 C、F表示溶解铜的物质的量 D、F表示生成氯气的物质的量三、综合题
-
19. 滴定是分析化学中重要的测定方法之一,关于已知浓度的盐酸滴定未知浓度的氢氧化钠溶液的实验,回答下列问题:(1)、洁净的锥形瓶中取20.00mL未知浓度的氢氧化钠溶液:向洗净的25.00mL碱式滴定管中装入未知浓度氢氧化钠溶液之前的一步操作为。装入氢氧化钠溶液溶液后,读数为5.00mL,将滴定管中的液体全部放出,放出的溶液的体积(填“大于”“小于”或“等于”)20.00mL。(2)、向盛有20.00mL未知浓度氢氧化钠溶液的锥形瓶中滴加2滴指示剂,可选用的指示剂是。
a.石蕊 b.甲基橙 c.淀粉溶液 d.KMnO4溶液
(3)、向锥形瓶内缓慢滴加已知浓度盐酸,边滴边振荡,眼睛注视。当加入最后滴已知浓度盐酸, , 则达到滴定终点,记录滴定读数。(4)、利用pH传感器技术,可以及时采集酸碱滴定过程中溶液pH的数据,并借助计算机以图像形式直接显示出来,得到反应过程中pH随加入标准溶液体积而发生变化的曲线图,可以更为准确的测定反应终点。
与使用指示剂所做的结果相比,使用(2)中所选指示剂测定未知浓度的氢氧化钠溶液浓度(填“偏大”“偏小”或“无影响”)。
20. 实验室中,学生利用下图装置制作一个简单燃料电池。步骤如下:
①检验装置气密性后向U形管中注入适量的6 mol·L-1稀H2SO4溶液,至接近橡胶塞底部。
②接通学生电源K1 , 观察实验现象,当一端玻璃导管内的液柱接近溢出时,切断学生电源K1。
③将石英钟内的干电池取出,用导线与石英钟的正负极相连,接入装置中。接通学生电源K2 , 观察石英钟指针。
回答下列问题:
(1)、接通学生电源K1 , 在右侧石墨棒表面观察到。(2)、观察到左侧的玻璃导管内的液柱先接近溢出,说明左侧石墨棒所连的是学生电源的(填“正极”或“负极”),该石墨表面的电极方程式是。(3)、用导线与石英钟的正负极相连接入装置时,石英钟的正极应与(填“左”或“右”)侧的石墨棒连接的导线相连。(4)、出现的现象,证明该燃料电池制作成功。燃料电池正极的电极方程式是。21. 运用化学反应原理研究氮及其化合物的反应有重要意义。(1)、铵态氮肥不能与含碳酸钾的草木灰混合使用,原因是。(2)、合成氨反应N2(g)+3H2(g)2NH3(g)ΔH=-92.4 kJ·mol-1 , 在工业生产中温度常控制在480℃,而非常温。请从化学反应速率和催化剂的角度加以解释。(3)、合成氨过程中发生的反应机理如下:I.2xFe+N22FexN (慢);
II.2FexN+3H22xFe+2NH3 (快)
回答下列问题:
①合成氨反应的速率快慢主要取决于(填“I”或“II”);
②合成氨反应的催化剂是(填化学式):
③反应I的活化能反应II的活化能(填“>”“=”或“<”)。
④使用催化剂前后,合成氨反应的ΔH(填“增大”“减小”或“不变”)。
22. 常温下,某水溶液X中存在的离子有Na+、A2-、HA-、H+、OH- , 只存在一种分子。根据题意回答下列问题:(1)、常温下,若X为20 mL1 mol·L-1Na2A溶液,则溶液X的pH(填“>”“=”或“<”)7,溶液中离子浓度由大到小的顺序为;向该溶液中加入10 mL1 mol·L-1BaCl2溶液,混合后溶液中的Ba2+浓度为mol·L-1[已知Ksp(BaA)=1.8×10-10]。(2)、若有三种溶液:①0.01 mol·L-1 H2A溶液、②0.01 mol·L-1 NaHA溶液、③0.02 mol·L-1盐酸与0.04 mol·L-1 Na2A溶液等体积混合,则三种溶液中c(A2-)最大的是(填序号,下同);pH由小到大的顺序为。23. t℃时,纯水中c(H+)=2.0×10-7mol·L-1 , 向其中加入少量Ba(OH)2溶液,保持温度不变,测得溶液中pH=12。回答下列问题:(1)、该溶液中由水电离出来的c(OH-)=。(2)、溶液中c(OH-)-c(H+)=(用离子符号表示)。(3)、若将该溶液温度升高,pH(填“变大”、“变小”或“不变”)。(4)、t℃时,将0.03 mol·L-1的稀硫酸与该溶液等体积混合,保持温度不变,混合后溶液的pH为。(5)、t℃时,将VA 0.04mol·L-1的醋酸和VBL的Ba(OH)2溶液混合后,得到中性澄清溶液,则其体积关系VAVB(填“>”“<”或“=”,下同)。混合溶液中必定有一种离子能发生水解,其水解反应的离子方程式为。24. 甲醇是重要的化工原料、燃料。工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:①CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH=-58 kJ/mol
②CO2(g)+H2(g)CO(g)+H2O(g) ΔH=41 kJ/mol
回答下列问题:
(1)、CO与H2在该条件下也能化合生成甲醇蒸汽。请写出该反应的热化学方程式:。(2)、若300℃时,将8 mol CO2和20 mol H2充入2 L体积不变的密闭容器中发生反应①,测得CH3OH的物质的量随时间变化情况如下表所示。时间/min
0
1
2
3
4
5
6
n(CH3OH)/mol
0
2.2
3.7
5
5.7
6
6
①恒温下,能判断该反应达到化学平衡状态依据的是。
a.容器中压强不变
b.甲醇和水蒸气的体积比保持不变
c.v正(H2)=3v逆(CH3OH)
d.2个C=O断裂的同时有3个H-H生成
②1~3min内H2的平均反应速率v= , 平衡常数K=;
③反应达平衡时再向容器中充入2 mol H2、6 mol CH3OH,则v(正)v(逆)(填“>”“<”或“=”);
(3)、若将CO2和H2按不同比例投入一密闭恒温容器中发生反应②,反应达到平衡时,CO的体积分数随的变化曲线如下图所示。
①a、b、c三点CO2的转化率从大到小的顺序为。
②a、b两点的平衡常数大小关系为ab(填“>”“<”或“=”)。