河北省邯郸市2021~2022学年高二上学期期末考试化学试题
试卷更新日期:2022-11-01 类型:期末考试
一、单选题
-
1. 2021年10月16日0时23分,神舟十三号载人飞船发射取得圆满成功,我国太空计划再次迈出重要一步。下列与这次载人飞行任务有关化学知识的描述中错误的是( )A、研究和改变合金中原子排布可以为航天工业寻找性能优越的材料 B、太空中观测恒星的光谱来自于原子中电子在轨道上的跃迁 C、宇航员所呼吸的氧气可通过电解水反应制备 D、太空舱中的太阳能电池翼工作时是将化学能转化为电能2. 反应速率的加快可以缩短工业生产中的时间成本。改变下列条件,不能提高反应的反应速率的是( )A、扩大容器体积 B、增大催化剂的表面积 C、适当升高温度 D、增大分压3. 下列物质所含化学键与其晶体结构对应错误的是( )
选项
物质
化学键
晶体结构
A
NaCl
离子键
离子晶体
B
(s,冰)
共价键
共价晶体
C
共价键
共价晶体
D
Na
金属键
金属晶体
A、A B、B C、C D、D4. 化学语言是化学必备知识之一、下列溶液中存在盐类水解且水解方程式表示正确的是( )A、硝酸钠溶液中: B、碳酸钠溶液中: C、碳酸氢钠溶液中: D、醋酸钠溶液中:5. 下列金属防护的措施不合理的是( )A、将车漆喷在汽车外壳上 B、将水库铁闸门连接在直流电源的正极 C、在船身上装锌块来避免船体遭受腐蚀 D、向金属器材上涂抹油脂6. 下列描述与推断均正确且存在因果关系的是( )选项
描述
推断
A
碳的燃烧为放热反应,反应焓变为 , 碳与水蒸气制备水煤气的反应为吸热反应,反应焓变为
B
常温下,将铜、铁用导线连接后插入浓硝酸中,铜片上产生大量气泡
铁的金属性强于铜
C
工业上使用催化剂可提高的产量
催化剂可改变平衡转化率
D
泡沫灭火器使用时,将硫酸铝和碳酸氢钠溶液两种溶液混合,生成氢氧化铝和二氧化碳的泡沫混合液起灭火作
硫酸铝和碳酸氢钠可互相促进水解反应
A、A B、B C、C D、D7. 短周期x、y、z、m、n五种主族元素,原子序数依次增大,x元素的某种原子可以在考古时用来测定文物年代。常温时,测得0.1mol/L y、m、n简单氢化物的水溶液pH分别为11、4、1。且z、m还可以与Na形成如图所以结构的化合物。以下有关说法错误的是( ) A、原子半径:z<m<n B、简单氢化物的沸点:x<y<z C、电负性:z>y>x D、x的最高价氧化物中各原子均满足8e-稳定结构8. 氰化氢(HCN可应用于电镀业(镀铜、镀金、镀银) 、采矿业等。常温下,某等物质的量浓度的HCN和NaCN混合溶液的。下列说法错误的是( )A、常温下, B、该混合溶液中水的电离程度大于纯水中水的电离程度 C、该混合溶液中存在: D、该混合溶液中存在:9. 苯磺酸为一元强酸,其制备机理如下图所示(TS表示过渡态)。下列说法正确的是( )
A、原子半径:z<m<n B、简单氢化物的沸点:x<y<z C、电负性:z>y>x D、x的最高价氧化物中各原子均满足8e-稳定结构8. 氰化氢(HCN可应用于电镀业(镀铜、镀金、镀银) 、采矿业等。常温下,某等物质的量浓度的HCN和NaCN混合溶液的。下列说法错误的是( )A、常温下, B、该混合溶液中水的电离程度大于纯水中水的电离程度 C、该混合溶液中存在: D、该混合溶液中存在:9. 苯磺酸为一元强酸,其制备机理如下图所示(TS表示过渡态)。下列说法正确的是( ) A、升高温度有利于增大苯的平衡转化率 B、其决速步骤反应为
A、升高温度有利于增大苯的平衡转化率 B、其决速步骤反应为 +H2SO4→
+H2SO4→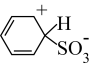 +H2O
C、两步反应活化能的差值为总反应的焓变
D、反应过程中存在一个碳原子连接两个氢原子的中间状态
10. NA为阿伏加德罗常数的值。下列说法正确的是( )A、溶液中所含数目为0.1NA B、含的水溶液中所含氢原子数目为0.4NA C、5.6g铁与完全反应,转移电子数目为0.3NA D、28gN60 (分子结构为
+H2O
C、两步反应活化能的差值为总反应的焓变
D、反应过程中存在一个碳原子连接两个氢原子的中间状态
10. NA为阿伏加德罗常数的值。下列说法正确的是( )A、溶液中所含数目为0.1NA B、含的水溶液中所含氢原子数目为0.4NA C、5.6g铁与完全反应,转移电子数目为0.3NA D、28gN60 (分子结构为 )中含有的σ键数目为3NA
11. 微生物电池具有高效、清洁、环保等优点。某微生物电池工作原理如图所示,下列说法错误的是( )
)中含有的σ键数目为3NA
11. 微生物电池具有高效、清洁、环保等优点。某微生物电池工作原理如图所示,下列说法错误的是( ) A、a极为该电池的负极 B、b极的电极反应式为 C、放电过程中a极附近pH降低 D、当外电路通过时,理论上溶液中会有通过质子交换膜移向b极
A、a极为该电池的负极 B、b极的电极反应式为 C、放电过程中a极附近pH降低 D、当外电路通过时,理论上溶液中会有通过质子交换膜移向b极二、多选题
-
12. T K温度下,控制体积不变,向某密闭容器中充入等物质的量的和 , 发生下列反应:
i.
ii.
和的分压随时间变化如下图所示,其中第3min时只改变了影响反应的一个条件。
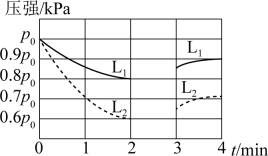
已知:可以用分压表示反应速率及化学平衡。
下列说法错误的是( )
A、图中代表变化的曲线为 B、0~2min内的平均反应速率 C、T K温度下,反应i的平衡常数 D、3min时改变的条件为增大压强13. 常温下,向20mL溶液中通入HCl气体(溶液体积变化忽略不计),溶液中含碳元素的各种微粒(气体因逸出不考虑)物质的量分数(δ)随溶液pH变化的部分情况如图所示。下列说法错误的是( )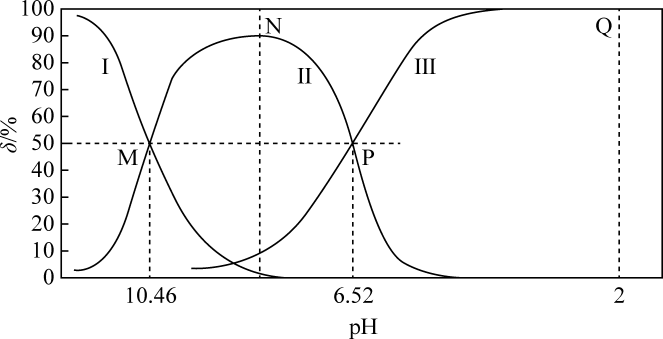 A、曲线Ⅰ表示物质的量分数 B、水解的平衡常数为 C、水的电离程度:M>N>P>Q D、Q点存在:
A、曲线Ⅰ表示物质的量分数 B、水解的平衡常数为 C、水的电离程度:M>N>P>Q D、Q点存在:三、综合题
-
14. 我国科学家在铁基高温超导体的研究上取得重大突破,发现了该超导体是由Fe、Ba、As三种元素组成,这为进一步理解超导配对机理及其与电荷密度波的关系提供了重要实验证据。
回答下列问题:
(1)、Ba元素属于元素周期表的区元素。(2)、基态Fe原子核外电子排布式为 , 同周期中基态原子未成对电子数比Fe多的有种元素。(3)、As为第四周期第ⅤA族元素,与其同周期且相邻的元素分别为32Ge、34Se,三种元素的基态原子第一电离能由大到小的顺序为 , 原因为。(4)、的晶胞结构如图1所示。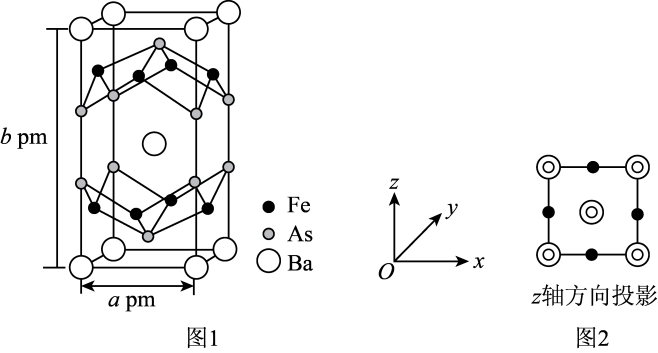
该晶体的化学式为 , 设NA表示阿伏加德罗常数的值,该晶体的密度是(用含a、b、NA的代数式表示)。
15. 道过电渗所法电解制备硫酸和NaOH溶液的原理如下图所示。电极M和电极N均为惰性电极。ab、cd均为离子交换膜。
回答下列问题:
(1)、电极电势:M(填“>”“=”或“<”,下同)N;物质的量浓度:溶液Ⅰ溶液Ⅱ。(2)、ab、cd分别为(填“阴”或“阳”,下同)离子交换膜和离子交换膜。(3)、电解时,可将(填“M”或“N”)电极换成不锈钢。(4)、M电极上发生反应的电极反应式为。(5)、当电路中通过1mol电子的电量时,理论上N极上产生气体的体积为(标准状况下测量)。16. 维生素C(C6H8O6)又称L-抗坏血酸,其还原性很强,在空气中极易被氧化,尤其在碱性介质中氧化速度更快,具有促进骨胶原的生物合成、利于组织创伤口更快愈合等生理功能。实验室检验测定药片中维生素C含量的实验步骤如下。(1)、Ⅰ.配制溶液:准确称量碾碎后的药品0.4000g,溶解于新煮沸冷却的蒸馏水中,加入适量醋酸,后配制成250mL溶液。Ⅱ.滴定实验:取配制好的溶液50.00mL于锥形瓶,并加入0.5%淀粉指示剂2mL,立即用的标准溶液滴定至终点。平行滴定3次,平均消耗标准溶液的体积为20.00mL。已知:。
配制溶液步骤中用到的玻璃仪器有烧杯、玻璃棒、量筒、和。
(2)、溶解药片时加入适量醋酸的目的为。(3)、将标准溶液装入酸式滴定管的具体操作顺序为(填字母),再夹在滴定管夹上备用。a.装入:标准溶液至0刻度以上; b.检查滴定管是否漏液;
c.排尽尖嘴部分气泡; d.用标准溶液润洗滴定管2~3次;
e.用蒸馏水清洗2~3次; f.将液面调节至“0”或“0”刻度以下。
(4)、滴定至终点时的实验现象为。(5)、该药片中维生素C的百分含量为%。(6)、若配制过程中采用了来煮沸过的蒸馏水,可能导致测定结果(填“偏高”“偏低”或“无影响”,下同);若读取标准溶液体积时滴定前仰视,滴定后俯视,可能导致测定结果。17. 2030年前实现碳达峰的承诺,体现了中国的大国风范。甲烷和二氧化碳重整制合成气的研究是实现碳达峰的手段之一、甲烧和二氧化碳重整制合成气的反应为 。已知:i.部分化学键键能数据如下表。
化学键
C-H
C=O
H-H
键能/(kJ/mol)
413
745
436
1011
ii.副反应Ⅰ:
副反应Ⅱ:
(1)、① , 。②副反应Ⅱ属于(选填“熵增”或“熵减”)反应。
(2)、已知甲烷和二氧化碳重整制合成气反应的正反应速率 , k为速率常数。900℃时,其他反应条件不变,只改变或时,正反应速率v的变化如图1所示。
①若和的分压均为p1时,a= , b=。
②若和的分压相等,分别为p2和p3两种情况下的正反应速率之比为。
(3)、在一定条件下,向某密闭容器中充入一定量的甲烷和二氧化碳,同时发生上述三个反应。反应过程中的平衡转化率(α)与温度和压强的关系如图2所示。
值随压强升高而减小的原因为;图2中的温度由大到小为 , 其判断理由为。