北京市西城区2021-2022学年高二上学期期末化学试题
试卷更新日期:2022-11-01 类型:期末考试
一、单选题
-
1. 下列装置或过程能实现化学能转化为电能的是( )
A
B
C
D




风力发电
水果电池
燃料燃烧
手机充电
A、A B、B C、C D、D2. 下列属于弱电解质的物质是( )A、NaCl B、NaOH C、H2SO4 D、NH3•H2O3. 下列操作可以使水的离子积常数Kw增大的是( )A、加热 B、通入少量氯化氢气体 C、通入少量氨气 D、加入少量醋酸钠固体4. 下列化学用语正确的是( )A、Cl-的结构示意图: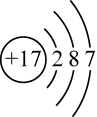 B、水的电子式:
B、水的电子式: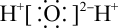 C、基态铬原子(24Cr)的价层电子排布式:3d54s1
D、基态氧原子的轨道表示式:
C、基态铬原子(24Cr)的价层电子排布式:3d54s1
D、基态氧原子的轨道表示式: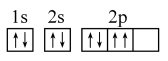 5. 下列用于解释事实的方程式书写错误的是( )A、钢铁制品在潮湿空气中的电化学腐蚀:Fe-3e-=Fe3+ B、电解精炼铜的阴极反应:Cu2++2e-=Cu C、CuSO4溶液与闪锌矿(ZnS)反应生成铜蓝(CuS):Cu2+(aq)+ZnS(s)Zn2+(aq)+CuS(s) D、加热Na2CO3溶液除去油污:H2O+COHCO+OH-6. 下列说法正确的是( )A、s区元素全部是金属元素 B、p能级电子能量不一定高于s能级电子能量 C、同一原子中,电子的能量逐渐减小 D、第ⅦA族元素从上到下,非金属性依次增强7. 用0.1000mol•L-1HCl溶液滴定未知浓度的NaOH溶液。有关该实验说法中,错误的是( )A、本实验可选用酚酞作指示剂 B、用酸式滴定管盛装0.1000mol•L-1HCl溶液 C、用未知浓度的NaOH溶液润洗锥形瓶2~3次 D、滴定结束时俯视酸式滴定管读数,测量结果偏低8. 下列事实能用勒夏特列原理解释的是( )A、用牺牲阳极法保护船舶的外壳 B、把食品存放在冰箱里可延长保质期 C、合成氨工业中使用铁触媒作催化剂 D、配制溶液,常将晶体溶于较浓的盐酸中9. 工厂的氨氮废水可用电化学催化氧化法加以处理,其中NH3在电极表面的氧化过程的微观示意图如图:
5. 下列用于解释事实的方程式书写错误的是( )A、钢铁制品在潮湿空气中的电化学腐蚀:Fe-3e-=Fe3+ B、电解精炼铜的阴极反应:Cu2++2e-=Cu C、CuSO4溶液与闪锌矿(ZnS)反应生成铜蓝(CuS):Cu2+(aq)+ZnS(s)Zn2+(aq)+CuS(s) D、加热Na2CO3溶液除去油污:H2O+COHCO+OH-6. 下列说法正确的是( )A、s区元素全部是金属元素 B、p能级电子能量不一定高于s能级电子能量 C、同一原子中,电子的能量逐渐减小 D、第ⅦA族元素从上到下,非金属性依次增强7. 用0.1000mol•L-1HCl溶液滴定未知浓度的NaOH溶液。有关该实验说法中,错误的是( )A、本实验可选用酚酞作指示剂 B、用酸式滴定管盛装0.1000mol•L-1HCl溶液 C、用未知浓度的NaOH溶液润洗锥形瓶2~3次 D、滴定结束时俯视酸式滴定管读数,测量结果偏低8. 下列事实能用勒夏特列原理解释的是( )A、用牺牲阳极法保护船舶的外壳 B、把食品存放在冰箱里可延长保质期 C、合成氨工业中使用铁触媒作催化剂 D、配制溶液,常将晶体溶于较浓的盐酸中9. 工厂的氨氮废水可用电化学催化氧化法加以处理,其中NH3在电极表面的氧化过程的微观示意图如图:
下列说法中,错误的是( )
A、过程①②均有N-H键断裂 B、过程③的电极反应式为:NH-e-+OH-=N+H2O C、过程④中有非极性键形成 D、催化剂可以降低该反应的焓变10. 下列图示与化学用语表述内容不相符的是( )A
B
C
D

NaCl溶于水

电解溶液

温度对化学平衡移动的影响

与反应过程中焓的变化
A、A B、B C、C D、D11. 北京冬奥会赛区内将使用氢燃料清洁能源车辆,某氢氧燃料电池工作示意图如图。下列说法中,错误的是( ) A、电极a为电池的负极 B、电极b表面反应为:O2+4e-+2H2O=4OH- C、电池工作过程中OH-向正极迁移 D、氢氧燃料电池将化学能转化为电能的转化率高于火力发电,提高了能源利用率12. 下列实验装置(部分夹持装置已略去)可以达到对应实验目的是( )
A、电极a为电池的负极 B、电极b表面反应为:O2+4e-+2H2O=4OH- C、电池工作过程中OH-向正极迁移 D、氢氧燃料电池将化学能转化为电能的转化率高于火力发电,提高了能源利用率12. 下列实验装置(部分夹持装置已略去)可以达到对应实验目的是( )A
B
C
D
实验目的
测定锌与稀硫酸反应速率
测定中和反应的反应热
比较AgCl和Ag2S溶解度大小
探究铁的析氢腐蚀
实验装置



 A、A B、B C、C D、D13. 已知反应:X(g)+Y(g)2Z(g) ∆H<0,400℃时该反应的化学平衡常数K=1。一定条件下,分别在甲、乙、丙3个恒容密闭容器中加入X和Y,反应体系中各物质的物质的量浓度的相关数据如表:
A、A B、B C、C D、D13. 已知反应:X(g)+Y(g)2Z(g) ∆H<0,400℃时该反应的化学平衡常数K=1。一定条件下,分别在甲、乙、丙3个恒容密闭容器中加入X和Y,反应体系中各物质的物质的量浓度的相关数据如表:容器
温度/℃
起始时物质的浓度/(mol•L-1)
10分钟时物质的浓/(mol•L-1)
c(X)
c(Y)
c(Z)
甲
400
1
1
0.5
乙
T1
1
1
0.4
丙
400
1
2
a
下列说法中,错误的是( )
A、甲中,10分钟内X的化学反应速率:v(X)=0.025mol•L-1•min-1 B、甲中,10分钟时反应已达到化学平衡状态 C、乙中,可能T1<400℃ D、丙中,a>0.514. 用下图所示装置进行实验,在相同电压、相同时间内,记录现象如下(温度变化均不明显):
实验序号
X电极材料
现象
Ⅰ
铂(Pt)
两极均有气泡产生,澄清石灰水不变浑浊
Ⅱ
石墨
两极均有气泡产生,澄清石灰水变浑浊
下列说法中,错误的是( )
A、X电极为阳极 B、阴极的电极反应式为: C、Ⅰ中Pt电极附近发生了反应: D、Ⅱ中石灰水变浑浊的原因是X区产生的与反应生成了二、填空题
-
15. 以氮化镓(GaN)、碳化硅等为代表的第三代半导体材料具有优异性能,对新兴产业有巨大推动作用。回答下列问题:(1)、写出基态硅原子的电子排布式 , 其中具有最高能量的电子所处能级符号为 , 该能级轨道电子云轮廓图的形状为(填字母)。
a.球形 b.哑铃形
(2)、氮、硅和碳3种元素第一电离能由小到的顺序为(填元素符号)。(3)、镓为元素周期表中第31号元素,镓原子具有个能层,最高能层容纳了个电子。16. 电解质在水溶液中的行为影响了电解质溶液的性质(以下讨论均在常温时)。(1)、0.1mol•L-1CH3COOH溶液的pH=3①CH3COOH的电离方程式是。
②该溶液中由水电离出的H+浓度是mol•L-1。
③计算CH3COOH的电离平衡常数Ka=。
(2)、H2CO3和HClO的电离平衡常数如表:化学式
H2CO3
HClO
电离平衡常数(Ka)
Ka1=4.5×10–7
Ka2=4.7×10–11
4.0×10–8
①相同物质的量浓度的Na2CO3、NaHCO3、NaClO溶液,pH由小到大的顺序是。
②0.01mol•L-1NaHCO3的溶液中c(H2CO3)>c(CO),结合化学用语解释其原因:。
③NaClO溶液的漂白性与溶液中c(HClO)有关。向NaClO溶液中加入下列物质,能增大c(HClO)的是(填字母)。
a.CH3COOH b.CO2 c.Na2CO3
17. 电解是海水资源综合利用的重要手段。(1)、电解饱和食盐水的原理如图所示。
①电解饱和食盐水的化学方程式是。
②电极a接电源的(填“正”或“负”)极。
③离子交换膜主要允许(填离子符号)通过。
(2)、我国科学家通过电解,从海水中提取到锂单质,其工作原理如图所示。
①生成锂单质的电极反应式是。
②理论分析,阳极电解产物可能有O2、Cl2。
i.生成O2的电极反应式是。
ii.实验室模拟上述过程,气体中未检测到Cl2 , 推测可能是Cl2溶于水。写出Cl2与水反应的化学方程式。
iii.取实验后阳极区溶液进行检验,证实了阳极Cl-放电。实验所用的试剂及现象是。
可选试剂:AgNO3溶液、KI溶液、淀粉溶液、品红溶液
三、综合题
-
18. 回收利用CO2是目前解决长期载人航天舱内(如空间站)供氧问题的有效途径,其物质转化如图:
 (1)、反应A为CO2(g)+4H2(g)CH4(g)+2H2O(g),是回收利用CO2的关键步骤。
(1)、反应A为CO2(g)+4H2(g)CH4(g)+2H2O(g),是回收利用CO2的关键步骤。已知:2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ•mol-1
CH4(g)+2O2(g)=2H2O(g)+CO2(g) ΔH=-802.3kJ•mol-1
反应A的ΔH=kJ•mol-1。
(2)、将原料气按n(CO2):n(H2)=1:4置于恒容密闭容器中发生反应A,在相同时间内测得H2O的物质的量分数与温度的变化曲线如图所示(虚线为平衡时的曲线)。
①理论上,能提高CO2平衡转化率的措施有(写出一条即可)。
②空间站的反应器内,通常采用反应器前段加热,后段冷却的方法来提高CO2的转化效率,原因是。
(3)、下列关于空间站内物质和能量变化的说法中,错误的是(填字母)。a.反应B的能量变化是电能→化学能或光能→化学能
b.物质转化中O、H原子的利用率均为100%
c.不用Na2O2作供氧剂的原因可能是Na2O2不易实现循环利用
(4)、用CO2(g)+2H2(g)C(s)+2H2O(g)代替反应A,可实现氢、氧元素完全循环利用,缺点是使用一段时间后催化剂的催化效果会明显下降,其原因是。19. 某化学小组研究草酸(H2C2O4)及其盐的性质。(1)、已知:H2C2O4H++HC2O , HC2OH++C2O①将等物质的量浓度、等体积的H2C2O4溶液与KOH溶液混合,反应的离子方程式是。
②向①中继续加入KOH溶液至恰好完全反应,得到K2C2O4溶液。下列关系正确的是(填字母)。
a.c(K+)>c(C2O)>c(OH-)>c(H+)
b.c(H+)+c(K+)=c(OH-)+c(HC2O)+c(C2O)
c.c(K+)=2[c(C2O)+c(HC2O)+c(H2C2O4)]
(2)、C2O中碳元素的化合价是+3价,推测其有还原性。文献表明:相同条件下,C2O的还原性强于Fe2+的。为验证此结论,小组同学完成了如下实验:向10mL0.5mol•L-1FeCl3溶液中缓慢加入0.5mol•L-1K2C2O4溶液至过量,充分反应后得到翠绿色溶液和翠绿色晶体。资料:三水三草酸合铁酸钾[K3Fe(C2O4)3•3H2O]为翠绿色晶体
Fe3++3C2O[Fe(C2O4)3]3- K=1.6×1020
①取少量晶体洗净,配成溶液,滴加KSCN溶液,不变红,继续加入硫酸,溶液变红。用平衡移动原理解释溶液变红的原因是。
②经检验反应后的溶液中无Fe2+ , 从反应原理的角度解释C2O和Fe3+未发生氧化还原反应的可能原因是。
③某同学利用如图所示装置比较Fe2+和C2O的还原性强弱。

i.闭合K,电流计指针偏转,一段时间后,取左侧溶液,(填操作和现象),证实C2O的还原性强于Fe2+。
ii.该装置的优点是。
20. 氯化钴(CoCl2)在工业催化、涂料工业、干湿指示剂等领域具有广泛应用。(1)、某钴矿石的主要成分包括CoO、MnO、Fe2O3和SiO2。由该矿石制CoCl2•6H2O固体的方法如图(部分分离操作省略):
资料:Mn2+生成Mn(OH)2 , 开始沉淀时pH=8.2,完全沉淀时pH=10.2
①上述矿石溶解过程中,能够加快化学反应速率的措施有(写出一条即可)。
②CoO溶于浓硫酸是非氧化还原反应,溶液1中阳离子包括H+、Mn2+和。
③已知pH=2.8时溶液中Fe3+完全沉淀。沉淀2是。
④溶液2中含有Co2+和Mn2+。
i.已知:25℃时Ksp[Co(OH)2]≈1×10-15 , 当c(Co2+)<1×10-5mol•L-1时可认为Co2+完全沉淀。若向溶液2中加入碱溶液,常温下,当pH=时Co2+完全沉淀。由此可知,通过调节pH无法将Mn2+和Co2+完全分离。
ii.溶液2中加入氨水和H2O2溶液的目的是。
(2)、可用如下方法测定产品中CoCl2•6H2O的质量分数(其他杂质不干扰测定):资料:i.M(CoCl2•6H2O)=238g•mol-1
ii.Co2+与SCN-反应生成蓝色的Co(SCN);Co2+与EDTA以物质的量比1:1反应,得到红色溶液;后者的反应程度大于前者取mg产品溶于水,向其中滴加几滴KSCN溶液作指示剂。再用cmol•L-1EDTA溶液滴定,消耗EDTA溶液的体积为vmL。滴定终点时的现象是 , 产品中CoCl2•6H2O的质量分数为(结果用m、v、c表示)。