北京市朝阳区2021-2022学年高二上学期期末考试化学试题
试卷更新日期:2022-11-01 类型:期末考试
一、单选题
-
1. 下列装置或过程能实现电能转化为化学能的是( )




A.普通锌锰电池
B.冶炼金属钠
C.太阳能电池
D.天然气燃烧
A、A B、B C、C D、D2. 下列物质属于弱电解质的是( )A、NH3·H2O B、H2SO4 C、NaCl D、Cu3. 锌铜原电池装置如图,下列说法错误的是( ) A、锌电极上发生氧化反应 B、盐桥中的K+移向ZnSO4溶液 C、电子从锌片经电流计流向铜片 D、铜电极上发生反应:Cu2++2e−=Cu4. 2SO2(g)+O2(g)⇌2SO3(g) △H<0是工业制硫酸的重要反应,下列说法错误的是( )A、其他条件不变,使用催化剂能同时提高反应速率和SO2的平衡转化率 B、其他条件不变,升高温度能加快反应速率,但SO2的平衡转化率降低 C、其他条件不变,通入过量空气能提高SO2的平衡转化率,但化学平衡常数不变 D、其他条件不变,增大压强能同时提高反应速率和SO2的平衡转化率,但生产成本增加5. 下列关于能级的说法正确的是( )A、所有能层都包含p能级 B、p能级的能量一定比s能级的高 C、3p2表示3p能级有两个轨道 D、2p、3p、4p能级的轨道数相同6. 反应2HI(g)⇌H2(g)+I2(g) ΔH>0经过以下两步基元反应完成:
A、锌电极上发生氧化反应 B、盐桥中的K+移向ZnSO4溶液 C、电子从锌片经电流计流向铜片 D、铜电极上发生反应:Cu2++2e−=Cu4. 2SO2(g)+O2(g)⇌2SO3(g) △H<0是工业制硫酸的重要反应,下列说法错误的是( )A、其他条件不变,使用催化剂能同时提高反应速率和SO2的平衡转化率 B、其他条件不变,升高温度能加快反应速率,但SO2的平衡转化率降低 C、其他条件不变,通入过量空气能提高SO2的平衡转化率,但化学平衡常数不变 D、其他条件不变,增大压强能同时提高反应速率和SO2的平衡转化率,但生产成本增加5. 下列关于能级的说法正确的是( )A、所有能层都包含p能级 B、p能级的能量一定比s能级的高 C、3p2表示3p能级有两个轨道 D、2p、3p、4p能级的轨道数相同6. 反应2HI(g)⇌H2(g)+I2(g) ΔH>0经过以下两步基元反应完成:ⅰ.2HI(g)=H2(g)+2I(g) ∆H1
ⅱ.2I(g)=I2(g) ∆H2
下列说法错误的是( )
A、ΔH=ΔH1+ΔH2 B、因为ⅰ中断裂化学键吸收能量,所以∆H1>0 C、因为ⅱ中形成化学键释放能量,所以∆H2<0 D、断裂2molHI(g)中的化学键吸收的能量大于断裂1molH2(g)和1molI2(g)中的化学键吸收的总能量7. 下列关于元素或物质性质的比较中,错误的是( )A、稳定性:HF>HCl>HBr>HI B、键的极性:HF>HCl>HBr>HI C、第一电离能:C>N>O>F D、电负性:C<N<O<F8. 下列关于水的电离H2O⇌H++OH− ΔH>0的说法错误的是( )A、将水加热至50℃,水的电离平衡正向移动,水依然呈中性 B、向水中加入少量NaOH,水的电离平衡逆向移动,溶液呈碱性 C、向水中加入少量NH4Cl,水的电离平衡正向移动,溶液呈酸性 D、常温下,pH=2的盐酸中,水电离的c(H+)=1.0×10−2mol·L−19. 下列用于解释事实的方程式书写正确的是( )A、葡萄糖提供人体所需的能量:C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l)ΔH>0 B、用饱和Na2CO3溶液处理锅炉水垢中的CaSO4:Ca2++CO=CaCO3↓ C、缠有铜丝的铁钉放入滴有酚酞的NaCl溶液,铜丝附近溶液变红:O2+4e−+2H2O=4OH− D、惰性电极电解NaCl溶液,两极均产生气体:2Cl−+2H+H2↑+Cl2↑10. 下列铁制品防护的装置或方法中,错误的是( )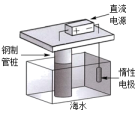


A.外加电流
B.牺牲阳极
C.表面镀铜
D.制成不锈钢
A、A B、B C、C D、D11. 一定温度下,100mLN2O5的CCl4溶液发生分解反应:2N2O5⇌4NO2+O2。不同时刻测得生成O2的体积,换算成对应时刻N2O5的浓度如下表。t/min
0
10
20
30
…
80
90
c(N2O5)/(mol·L−1)
1.40
0.96
0.66
0.45
…
0.11
0.11
下列说法错误的是( )
A、0~10min的平均反应速率:v(N2O5)=0.044mol·L−1·min−1 B、10~20min的平均反应速率:v(N2O5)<0.044mol·L−1·min−1 C、10~20min放出的O2体积为0.336L(标准状况) D、80min后反应达到平衡,2v正(N2O5)=v逆(O2)12. 以[Cu(H2O)4]2+(蓝)+4Cl−[CuCl4]2−(黄)+4H2O ΔH>0为例,探究影响平衡移动的因素。取相同浓度的CuCl2溶液,分别进行下列实验,对实验现象的分析错误的是( )操作和现象
分析
A
观察溶液为绿色
[Cu(H2O)4]2+和[CuCl4]2−同时存在
B
升高温度,溶液变为黄绿色
平衡正移,[CuCl4]2−的浓度增大
C
加几滴AgNO3溶液,静置,上层清液为蓝色
平衡逆移,[CuCl4]2−的浓度减小
D
加少量Zn片,静置,上层清液为浅黄绿色
平衡正移,[CuCl4]2−的浓度增大
A、A B、B C、C D、D13. 实验小组用以下两种方法测定某盐酸的浓度。分别取20.00mL待测盐酸进行实验。方法一:以酚酞为指示剂,用0.1000mol·L−1NaOH标准溶液滴定H+。
方法二:以K2CrO4为指示剂,用0.1000mol·L−1AgNO3标准溶液滴定Cl−。
已知:Ag2CrO4为砖红色沉淀,25℃时Ksp(Ag2CrO4)=2.0×10−12、Ksp(AgCl)=1.8×10−10。下列说法错误的是( )
A、两种方法滴定原理分别是H++OH−=H2O、Ag++Cl−=AgCl↓ B、两种方法滴定终点的现象分别是溶液变红、产生砖红色沉淀,且半分钟内都不再变化 C、理论上两种方法消耗标准液的体积不同 D、两种方法均用到锥形瓶、滴定管14. 小组进行如下实验。
下列说法错误的是( )
A、①中存在沉淀溶解平衡:Mg(OH)2(s)⇌Mg2+(aq)+2OH−(aq) B、③中溶液又变红的原因:沉淀溶解平衡正向移动 C、c(OH−):③=① D、③中存在:2c(Mg2+)>c(Cl−)二、综合题
-
15. 氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:(1)、基态N原子中电子占据最高能级的电子云轮廓图为形,基态N原子的轨道表示式为。(2)、B的第一电离能I1(B)=800kJ·mol−1 , 判断I1(Al)800kJ·mol−1(填“>”或“<”),从电子排布的角度说明判断理由。(3)、NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-)。在H、B、N三种元素中:
①电负性由大到小的顺序是。
②原子半径由大到小的顺序是。
③在元素周期表中的分区与其他两种不同的是。
(4)、26Fe、27Co、28Ni、29Cu是目前氨硼烷水解产氢催化剂研究的热点。不同催化剂催化氨硼烷水解产氢的性能如图所示。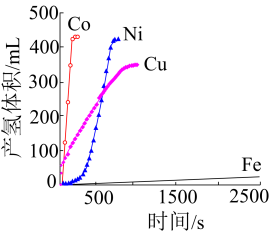
这四种催化剂中:
①催化效果最好的金属基态原子中未成对的电子数为。
②催化效果最差的金属基态原子的价层电子排布式为。
16. 氢能是一种清洁能源,按照生产过程中的碳排放情况分为灰氢、蓝氢和绿氢。(1)、煤的气化制得灰氢:C(s)+H2O(g) CO(g)+H2(g)。该反应的平衡常数表达式K=。该方法生产过程有CO2排放。(2)、甲烷水蒸气催化重整制得蓝氢 , 步骤如下。I.H2的制取:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH>0
①为提高CH4的平衡转化率,可采取的措施有(写出两条即可)。
II.H2的富集:CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0
②已知830℃时,该反应的平衡常数K=1。在容积不变的的密闭容器中,将2molCO与8molH2O混合加热到830℃,反应达平衡时CO的转化率为。
III.用吸收实现低碳排放。消耗率随时间变化关系如图所示。

③比较温度高低:T1T2(填“>”或“<”)。
(3)、热化学硫碘循环分解水制得绿氢 , 全程零碳排放。反应如下:反应i:SO2(g)+I2(g)+2H2O(g)=H2SO4(l)+2HI(g) ∆H1=-82kJ·mol−1
反应ii:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) ∆H2=+544kJ·mol−1
反应iii:……
反应ⅰ~iii循环实现分解水:2H2O(g)=2H2(g)+O2(g) ∆H=+484kJ·mol−1。写出反应iii的热化学方程式。
17. 盐酸和醋酸是生活中常用的酸。某实验小组进行了以下实验。(1)、对比盐酸和醋酸与NaOH的反应。常温下,用0.1000mol·L−1NaOH溶液分别滴定20mL0.1000mol·L−1的盐酸和醋酸,滴定过程中溶液pH的变化曲线如下图所示。
①表示滴定盐酸的曲线是(填“I”或“II”)。
②a点溶液中,离子浓度由大到小的顺序为。
③V[NaOH(aq)]=20mL时,c(Cl−)c(CH3COO−)(填“>”“<”或“=”)。
(2)、对比盐酸和醋酸与NaClO的反应。资料:25℃时CH3COOH和HClO的电离平衡常数Ka分别为1.75×10−5和4.0×10−8。
①NaClO溶液中加入石蕊溶液变蓝,用化学用语解释原因。
②实验II的目的是。
③结合资料和化学用语解释I的实验现象。
④III中溶液变为浅黄绿色,用离子方程式解释原因。
18. 实验小组用石墨电极电解25%的CuCl2溶液,实验现象如下表。实验装置
实验现象

通电前:溶液呈绿色,显酸性;
通电后:a极析出红色固体,电极附近的液体变为棕黑色;b极产生有刺激性气味的气体,电极附近的溶液酸性增强。
已知:Cu+Cu2++2Cl-=2CuCl↓(白色);Cu(NH3)为无色,Cu(NH3)为蓝色。
(1)、a极析出红色固体的反应式。(2)、分析电解后b极附近溶液酸性增强的原因。①甲同学认为是H2O在阳极放电造成的。通过检验电解产物不存在(填化学式),证实甲同学观点不成立。
②乙同学认为是Cl−在阳极放电造成的,产生Cl2后发生反应: , 导致溶液显酸性。实验证实乙同学的观点正确,所选试剂及现象是。可选试剂:AgNO3溶液、品红溶液、Mg条。
(3)、探究棕黑色物质的成分。查阅资料后提出假设:I.电解析出铜的速率快,形成黑色的纳米铜
II.发生反应:Cu2++Cu++4Cl−+H2O⇌[Cu(II)Cu(I)Cl4(H2O)]−(棕黑色)
取棕黑色液体进行以下实验:

①无色溶液放置一段时间后变蓝的原因是(用离子方程式表示)。
②实验证实了棕黑色物质中含有[Cu(II)Cu(I)Cl4(H2O)]−。分析棕黑色液体加水产生白色沉淀的可能原因(写出两点):。
③丙同学根据“浅红棕色气体”的现象,判断棕黑色物质中含有纳米铜。丙同学的分析是否合理,请说明理由。
19. 电化学原理被广泛应用于生产、生活的许多方面,利用电解法脱除煤中的含硫物质(主要是FeS2)的原理如图所示。 (1)、阴极石墨棒上有无色气体产生,该气体是。(2)、阳极的电极反应式为。(3)、补全脱硫反应方程式:。
(1)、阴极石墨棒上有无色气体产生,该气体是。(2)、阳极的电极反应式为。(3)、补全脱硫反应方程式:。FeS2+_+_=SO+_+_
(4)、相同反应时间,FeCl3对脱硫率的影响如图所示。
①电解脱硫过程中,FeCl3的作用是催化剂,结合简单碰撞理论说明使用FeCl3能加快反应速率的原因。
②FeCl3的质量分数大于1.5%时,脱硫率随FeCl3浓度的增大而下降,解释原因。
(5)、研究发现,电解时若电压过高,阳极有副反应发生,造成电解效率降低。电解效率η的定义:。某电压下电解100mL煤浆-FeCl3-H2SO4混合液,煤浆中除FeS2外不含其它含硫物质,混合液中H2SO4浓度为0.01mol·L−1 , FeCl3的质量分数为1.5%。当阴极收集到224mL(标准状况)气体时(阴极无副反应发生),测得溶液中c(SO)=0.02mol·L−1 , η(SO)=(忽略电解前后溶液的体积变化)。(6)、综上,电解法脱硫的优点有(写出两点)。