江苏省南京镇江八校2023届高三上学期第一次联考化学试题
试卷更新日期:2022-10-28 类型:月考试卷
一、单选题
-
1. 2022年北京冬奥会火炬“飞扬”(如图)以耐高温碳纤维材料为外壳,铝合金为点火段材料,氢气为燃料,辅以可调节火焰颜色的“配方”。下列说法正确的是( )
 A、碳纤维属于天然高分子材料 B、氢气作燃料对环境友好无污染 C、铝合金密度小、硬度小、耐腐蚀、熔点高 D、含钾元素的“配方”可使火焰呈黄色2. 下列表示相关微粒的化学用语正确的是( )A、S2-的结构示意图:
A、碳纤维属于天然高分子材料 B、氢气作燃料对环境友好无污染 C、铝合金密度小、硬度小、耐腐蚀、熔点高 D、含钾元素的“配方”可使火焰呈黄色2. 下列表示相关微粒的化学用语正确的是( )A、S2-的结构示意图: B、K2S的电子式:
B、K2S的电子式: C、KNO3和K2S均属于离子化合物,都只存在离子键
D、CO2分子中只有极性共价键,N2分子中只有非极性共价键
3. 下列说法正确的是( )A、中氮原子采取杂化 B、简单离子半径: C、第一电离能: D、电负性: C < N < O4. 侯氏制碱法制取的原理为。实验室用如题图所示的装置模拟侯氏制碱法制取少量固体。下列有关说法正确的是( )
C、KNO3和K2S均属于离子化合物,都只存在离子键
D、CO2分子中只有极性共价键,N2分子中只有非极性共价键
3. 下列说法正确的是( )A、中氮原子采取杂化 B、简单离子半径: C、第一电离能: D、电负性: C < N < O4. 侯氏制碱法制取的原理为。实验室用如题图所示的装置模拟侯氏制碱法制取少量固体。下列有关说法正确的是( )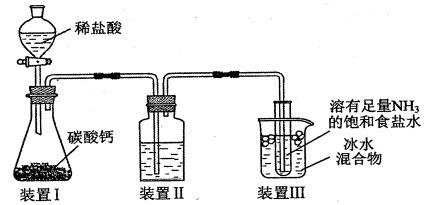 A、装置Ⅰ中反应的离子方程式为 B、向装置Ⅱ洗气瓶中加入饱和溶液以除去中的少量 C、装置Ⅲ中用冰水浴冷却试管内溶液有利于析出固体 D、析出固体的上层清液中不存在5. 下列说法正确的是( )A、基态Mn原子的价电子排布图为
A、装置Ⅰ中反应的离子方程式为 B、向装置Ⅱ洗气瓶中加入饱和溶液以除去中的少量 C、装置Ⅲ中用冰水浴冷却试管内溶液有利于析出固体 D、析出固体的上层清液中不存在5. 下列说法正确的是( )A、基态Mn原子的价电子排布图为 B、沸点:CO<N2
C、键角:NH3<H2O
D、S8中S原子的杂化方式为sp3
6. 下列表述和方程式书写都正确的是( )A、表示乙醇燃烧热的热化学方程式:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) △H= -1367.0 kJ/mol B、KAl(SO4)2溶液中加入Ba(OH)2溶液使沉淀物质的量达到最大:Al3++2SO42-+2Ba2++4OH-= AlO2-+2BaSO4↓+2H2O C、用稀硫酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2 =2Mn2++5O2↑+8H2O D、用石墨作电极电解NaCl溶液:2Cl-+2H+Cl2↑+H2↑7. 下列有关物质的性质与用途具有对应关系的是( )A、硬度大,可用作光导纤维 B、Li质量轻、比能量大,可用作电池正极材料 C、有漂白性,可用作葡萄酒的添加剂 D、有弱碱性,可用于中和胃酸8. 硫和氮及其化合物对人类生存和社会发展意义重大,但硫氧化物和氮氧化物造成的环境问题也日益受到关注,下列说法正确的是( )A、汽车尾气中NO,主要来源于汽油、柴油的燃烧 B、二氧化硫不仅可以漂白纸浆,还能杀菌消毒 C、植物直接吸收利用空气中的NO和NO2作为肥料,实现氮的固定 D、工业废气中的SO2和CO2均可采用石灰法进行脱除9. 有机化合物Z可用于治疗阿尔茨海默症,其合成路线如下:
B、沸点:CO<N2
C、键角:NH3<H2O
D、S8中S原子的杂化方式为sp3
6. 下列表述和方程式书写都正确的是( )A、表示乙醇燃烧热的热化学方程式:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) △H= -1367.0 kJ/mol B、KAl(SO4)2溶液中加入Ba(OH)2溶液使沉淀物质的量达到最大:Al3++2SO42-+2Ba2++4OH-= AlO2-+2BaSO4↓+2H2O C、用稀硫酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2 =2Mn2++5O2↑+8H2O D、用石墨作电极电解NaCl溶液:2Cl-+2H+Cl2↑+H2↑7. 下列有关物质的性质与用途具有对应关系的是( )A、硬度大,可用作光导纤维 B、Li质量轻、比能量大,可用作电池正极材料 C、有漂白性,可用作葡萄酒的添加剂 D、有弱碱性,可用于中和胃酸8. 硫和氮及其化合物对人类生存和社会发展意义重大,但硫氧化物和氮氧化物造成的环境问题也日益受到关注,下列说法正确的是( )A、汽车尾气中NO,主要来源于汽油、柴油的燃烧 B、二氧化硫不仅可以漂白纸浆,还能杀菌消毒 C、植物直接吸收利用空气中的NO和NO2作为肥料,实现氮的固定 D、工业废气中的SO2和CO2均可采用石灰法进行脱除9. 有机化合物Z可用于治疗阿尔茨海默症,其合成路线如下:
下列说法错误的是( )
A、该反应为加成反应。 B、X、Y分子中含有的手性碳原子个数不同 C、Z的消去反应产物具有顺反异构体 D、Z的同分异构体不可能含两个苯环10. 氯元素具有多种化合价,可形成、、、和等离子,在一定条件下能发生相互转化。在新型催化剂作用下,氧化HCl可获得: 。对于反应 , 下列说法正确的是( )A、该反应 B、4mol HCl与1mol反应转移电子数约为 C、的使用能降低该反应的焓变 D、反应的平衡常数为11. 下列实验方案中,能达到实验目的的是( )选项
实验方案
实验目的
A
将SO2和CO2分别通入水中达到饱和,用pH计立即测定溶液的pH,比较pH大小
确定亚硫酸和碳酸的酸性强弱
B
验证Cu和浓硫酸反应生成CuSO4
向反应后溶液中加入水观察溶液变蓝色
C
将SO2通入NaHCO3溶液后,将混合气体依次通入酸性KMnO4溶液、品红溶液、澄清石灰水
验证非金属性:S>C
D
验证:Ksp(AgI)<Ksp(AgCl)
向盛有1mL 0.1 mol•L-1 AgNO3溶液的试管中滴加10滴0.1mol•L-1NaCl溶液,有白色沉淀生成,向其中继续滴加0.1mol•L-1KI溶液,有黄色沉淀产生
A、A B、B C、C D、D12. 已知室温下Ka1(H2S)=10-7 , Ka2(H2S)=10-12.9。通过下列实验探究含硫化合物的性质。实验1:测得0.1mol·L-1H2S溶液pH=4.1
实验2:向10mL0.1mol·L-1NaHS溶液中加入5mL水,测得溶液的pH不断减小
实验3:向实验2所得溶液中滴加10mL0.1mol·L-1NaOH溶液,测得反应后溶液pH=12
实验4:向实验3所得溶液中滴加几滴0.1mol·L-1MnSO4溶液,产生粉色沉淀,再加几滴0.1mol·L-1CuSO4溶液,产生黑色沉淀
下列说法正确的是( )
A、由实验1可知:0.1mol·L-1H2S溶液中c(S2-)<c(OH-) B、由实验2可知:加水过程中,逐渐变小 C、实验3所得溶液中存在:c(H2S)+c(HS-)+c(H+)=c(OH-) D、由实验4可知:Ksp(MnS)>Ksp(CuS)二、多选题
-
13. CO2催化加氢合成二甲醚是一种CO2资源化利用的方法,其过程中主要发生如下两个反应:
反应I:CO2(g)+H2(g)CO(g)+H2O(g) ΔH1
反应II:2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g) ΔH2=﹣122.5kJ·mol-1
在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图所示。

已知:CH3OCH3的选择性=×100%
下列说法错误的是( )
A、反应2CO(g)+4H2(g)CH3OCH3(g)+H2O(g)的焓变为ΔH2-2ΔH1 B、根据图像推测ΔH1<0 C、其他条件不变时,温度越高,CO2主要还原产物中碳元素的价态越低 D、其他条件不变时,增大体系压强可以提升A点CH3OCH3的选择性三、综合题
-
14. 氧钒(IV)碱式碳酸铵为紫色晶体,难溶于水,是制备热敏材料的原料,其化学式为。实验室以为原料合成用于制备的氧钒(Ⅳ)碱式碳酸铵晶体,过程如下:

已知:+4价钒在弱酸性条件下具有还原性,能被氧化。
(1)、为离子化合物,中含有的σ键数目为。(2)、步骤1中生成的同时生成一种无色无污染的气体,该反应的化学方程式为。(3)、步骤2可在下图装置(气密性良好)中进行。
制备过程中,需向锥形瓶中通入 , 作用是 ,所得紫色晶体残留的杂质离子主要为。
(4)、步骤3洗涤晶体时需用饱和溶液洗涤3次,再用无水乙醇洗涤2次,选择无水乙醇的原因是。(5)、已知:①去除溶液中可依次加入尿素溶液(还原)、亚硝酸钠溶液(氧化尿素)。②滴定反应:。
测定氧钒(Ⅳ)碱式碳酸按晶体中钒的含量的实验方案如下:称量5.1000g样品于锥形瓶中,用溶液溶解后,加入溶液至稍过量,充分反应后继续滴加亚硝酸钠溶液至稍过量,再用尿素除去过量亚硝酸钠溶液,最后用0.0800mol/L的标准溶液滴定至终点。请补充完整配制100mL0.0800mol/L的标准溶液的实验步骤:用精度为千分之一的电子天平准确称取固体g, 将固体转移至100mL烧杯中,加入少量溶液和适量蒸馏水溶解,。轻轻震荡容量瓶,使溶液混合均匀。 , 将容量瓶塞盖好,反复上下颠倒,摇匀。再将所配溶液装入试剂瓶中,贴上标签。
15. 纳米TiO2被广泛应用于光催化、精细陶瓷等领域。以钛铁矿(主要成分为FeTiO3)为原料制备纳米TiO2的步骤如下:25 ℃时,Ksp[TiO(OH)2] =1×10−29;Ksp[Fe(OH)3] = 4×10−38;Ksp[Fe(OH)2] = 8×10−16(1)、酸浸:向磨细的钛铁矿中加入浓硫酸,充分反应后,所得溶液中主要含有TiO2+、Fe2+、Fe3+、H+和SO 。Ti基态核外电子排布式为。(2)、除铁、沉钛:向溶液中加入铁粉,充分反应,趁热过滤。所得滤液冷却后过滤得到富含TiO2+的溶液;调节除铁后溶液的pH,使TiO2+水解生成TiO(OH)2 , 过滤。①若沉钛后c(TiO2+)<1×10−5 mol·L−1 , 则需要调节溶液的pH略大于。
②TiO2+水解生成TiO(OH)2的离子方程式为。
③加入铁粉的作用是。
(3)、煅烧:在550℃时煅烧TiO(OH)2 , 可得到纳米TiO2。
①TiO2的一种晶胞结构如图-1所示,每个O周围距离最近的Ti数目是。
②纳米TiO2在室温下可有效催化降解空气中的甲醛。H2O和甲醛都可在催化剂表面吸附,光照时,吸附的H2O与O2产生HO,从而降解甲醛。空气的湿度与甲醛降解率的关系如图-2所示,甲醛降解率随空气湿度变化的原因为。
(4)、纯度测定:取纳米TiO2样品2.000 g,在酸性条件下充分溶解,加入适量铝粉将TiO2+还原为Ti3+ , 过滤并洗涤,将所得滤液和洗涤液合并配成250 mL溶液。取合并液25.00 mL于锥形瓶中,加几滴KSCN溶液作指示剂,用0.1000 mol·L−1 NH4Fe(SO4)2标准溶液滴定,将Ti3+氧化为TiO2+ , 消耗0.1000 mol·L−1 NH4Fe(SO4)2标准溶液23.00 mL。该样品中TiO2的质量分数为。(写出计算过程)。16. 天然产物F具有抗肿瘤、镇痉等生物活性,可通过以下路线合成: (1)、1mol有机物B中sp2杂化的碳原子数目为mol。(2)、E→F的反应类型为。(3)、D→E中有一种副产品(分子式C14H14O3)生成,该副产品的结构简式为。(4)、C的一种同分异构体同时满足以下条件,写出该同分异构体的结构简式:。
(1)、1mol有机物B中sp2杂化的碳原子数目为mol。(2)、E→F的反应类型为。(3)、D→E中有一种副产品(分子式C14H14O3)生成,该副产品的结构简式为。(4)、C的一种同分异构体同时满足以下条件,写出该同分异构体的结构简式:。a.能与FeCl3溶液发生显色反应;
b.碱性条件下水解生成两种产物,酸化后分子中均只有2种不同化学环境的氢。
(5)、写出以 和
和 为原料制备
为原料制备 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。 17. 有效去除大气中的NOx和水体中的氮是环境保护的重要课题。(1)、已知:①2CO(g)+O2(g)=2CO2(g);ΔH1=-566.0kJ·mol-1
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。 17. 有效去除大气中的NOx和水体中的氮是环境保护的重要课题。(1)、已知:①2CO(g)+O2(g)=2CO2(g);ΔH1=-566.0kJ·mol-1②N2(g)+2O2(g)=2NO2(g);ΔH2=+64kJ·mol-1
反应2NO2(g)+4CO(g)=N2(g)+4CO2(g);ΔH3=。
(2)、磷酸铵镁(MgNH4PO4)沉淀法可去除水体中的氨氮(NH和NH3)。实验室中模拟氨氮处理:1L的模拟氨氮废水(主要含NH),置于搅拌器上,设定反应温度为25℃。先后加入MgCl2和Na2HPO4溶液,用NaOH调节反应pH,投加絮凝剂;开始搅拌,反应30min后,取液面下2cm处清液测定氨氮质量浓度。
①生成磷酸铵镁沉淀的离子反应方程式为。
②测得反应pH对氨氮去除率的影响如图1所示,当pH从7.5增至9.0的过程中,水中氨氮的去除率明显增加,原因是。
③当反应pH为9.0时,该沉淀法对氨氮的去除率达到最高,当pH继续增至10.0时,氨氮的去除率下降,原因是。
(3)、纳米零价铁(NZVI)/BC与(CuPd)/BC联合作用可去除水体中的硝态氮。
在NZVI/BC和(CuPd)/BC复合材料联合作用的体系中,生物炭(BC)作为NZVI、Cu、Pb的载体且减少了纳米零价铁的团聚,纳米零价铁作为主要还原剂,Cu和Pd作为催化剂且参与吸附活性H。
①NZVI/BC和(CuPd)/BC复合材料还原硝酸盐的反应机理如图2所示,NO转化为N2或NH的过程可描述为。
②实验测得体系初始pH对NO去除率的影响如图3,前200min内,pH=9.88时的去除率远低于pH=4.05时,其可能的原因是。
-