江苏省昆山六校2022~2023学年高三上学期10月联合教学质量调研化学试题
试卷更新日期:2022-10-28 类型:月考试卷
一、单选题
-
1. 湿法炼铜用稀硫酸溶解孔雀石(主要成分为Cu2(OH)2CO3],再向其中加入铁屑可得铜。下列有关说法错误的是( )A、Cu2(OH)2CO3属于盐类物质 B、FeSO4溶液呈酸性 C、Cu2(OH)2CO3和稀硫酸发生氧化还原反应 D、CuSO4溶液可使蛋白质变性2. 制取H2O2的反应为Na2O2+H2SO4+10H2O=Na2SO4•10H2O+H2O2 , 下列说法正确的是( )A、Na+的结构示意图为
 B、Na2O2含离子键和共价键
C、H2O2的电子式为
B、Na2O2含离子键和共价键
C、H2O2的电子式为 D、H2O是非极性分子
3. 《神农本草经》中记载的白矾主要成分为KAl(SO4)2•12H2O。下列说法正确的是( )A、离子半径:r(Al3+)>r(O2-) B、碱性:KOH>Al(OH)3 C、热稳定性:H2S>H2O D、第一电离能:I1(S)>I1(O)4. 下列有关氮及其化合物的性质和用途具有对应关系的是( )A、氮气难溶于水,可用于合成氨 B、硝酸见光易分解,可用于制氮肥 C、二氧化氮密度比空气大,可用于制硝酸 D、液氨汽化时吸收大量的热,可用作制冷剂5. 汽车尾气中的CO、NOx、硫氧化物、乙烯、丙烯等碳氢化合物会引起光化学烟雾、酸雨等污染;汽油抗震添加剂四乙基铅(熔点—136℃,极易挥发)的排放严重危害人体中枢神经系统。汽车尾气净化装置可将污染物中的CO和NO转化为无害气体,发生反应为2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-746.5kJ·mol-1。下列有关说法正确的是( )A、SO2和SO3中的键角相等 B、丙烯能形成分子间氢键 C、N2中σ键和π键数目之比为1:2 D、固态四乙基铅为离子晶体6. 汽车尾气中的CO、NOx、硫氧化物、乙烯、丙烯等碳氢化合物会引起光化学烟雾、酸雨等污染;汽油抗震添加剂四乙基铅(熔点-136℃,极易挥发)的排放严重危害人体中枢神经系统。汽车尾气净化装置可将污染物中的CO和NO转化为无害气体,发生反应为2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-746.5kJ·mol-1。在指定条件下,下列有关汽车尾气无害化处理或资源化利用的物质转化能实现的是( )A、CO(g)H2CO3(aq) B、CH2=CH2(g)
D、H2O是非极性分子
3. 《神农本草经》中记载的白矾主要成分为KAl(SO4)2•12H2O。下列说法正确的是( )A、离子半径:r(Al3+)>r(O2-) B、碱性:KOH>Al(OH)3 C、热稳定性:H2S>H2O D、第一电离能:I1(S)>I1(O)4. 下列有关氮及其化合物的性质和用途具有对应关系的是( )A、氮气难溶于水,可用于合成氨 B、硝酸见光易分解,可用于制氮肥 C、二氧化氮密度比空气大,可用于制硝酸 D、液氨汽化时吸收大量的热,可用作制冷剂5. 汽车尾气中的CO、NOx、硫氧化物、乙烯、丙烯等碳氢化合物会引起光化学烟雾、酸雨等污染;汽油抗震添加剂四乙基铅(熔点—136℃,极易挥发)的排放严重危害人体中枢神经系统。汽车尾气净化装置可将污染物中的CO和NO转化为无害气体,发生反应为2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-746.5kJ·mol-1。下列有关说法正确的是( )A、SO2和SO3中的键角相等 B、丙烯能形成分子间氢键 C、N2中σ键和π键数目之比为1:2 D、固态四乙基铅为离子晶体6. 汽车尾气中的CO、NOx、硫氧化物、乙烯、丙烯等碳氢化合物会引起光化学烟雾、酸雨等污染;汽油抗震添加剂四乙基铅(熔点-136℃,极易挥发)的排放严重危害人体中枢神经系统。汽车尾气净化装置可将污染物中的CO和NO转化为无害气体,发生反应为2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-746.5kJ·mol-1。在指定条件下,下列有关汽车尾气无害化处理或资源化利用的物质转化能实现的是( )A、CO(g)H2CO3(aq) B、CH2=CH2(g) C、NO(g)NaNO3(aq)
D、SO2(g)CaSO4(S)
7. 汽车尾气中的CO、NOx、硫氧化物、乙烯、丙烯等碳氢化合物会引起光化学烟雾、酸雨等污染;汽油抗震添加剂四乙基铅(熔点-136℃,极易挥发)的排放严重危害人体中枢神经系统。汽车尾气净化装置可将污染物中的CO和NO转化为无害气体,发生反应为2CO(g)+2NO(g)⇌N2(g)+2CO2(g) △H=-746.5kJ·mol-1。对于反应2CO(g)+2NO(g)⇌N2(g)+2CO2(g),下列说法正确的是( )A、反应的平衡常数可表示为K= B、使用催化剂可降低反应的活化能,减小反应的焓变 C、增大压强能加快反应速率,提高反应物的平衡转化率 D、用E总表示键能之和,该反应ΔH=E总(生成物)-E总(反应物)8. 氯的含氧酸盐广泛应用于杀菌、消毒及化工领域。实验室中利用如图装置(部分装置省略)制备和NaClO。下列说法正确的是( )
C、NO(g)NaNO3(aq)
D、SO2(g)CaSO4(S)
7. 汽车尾气中的CO、NOx、硫氧化物、乙烯、丙烯等碳氢化合物会引起光化学烟雾、酸雨等污染;汽油抗震添加剂四乙基铅(熔点-136℃,极易挥发)的排放严重危害人体中枢神经系统。汽车尾气净化装置可将污染物中的CO和NO转化为无害气体,发生反应为2CO(g)+2NO(g)⇌N2(g)+2CO2(g) △H=-746.5kJ·mol-1。对于反应2CO(g)+2NO(g)⇌N2(g)+2CO2(g),下列说法正确的是( )A、反应的平衡常数可表示为K= B、使用催化剂可降低反应的活化能,减小反应的焓变 C、增大压强能加快反应速率,提高反应物的平衡转化率 D、用E总表示键能之和,该反应ΔH=E总(生成物)-E总(反应物)8. 氯的含氧酸盐广泛应用于杀菌、消毒及化工领域。实验室中利用如图装置(部分装置省略)制备和NaClO。下列说法正确的是( ) A、装置Ⅰ中可将换成 B、装置Ⅱ洗气瓶中用饱和溶液除去中的少量HCl C、装置Ⅲ中反应的离子方程式为 D、装置Ⅴ锥形瓶中用澄清石灰水来吸收尾气9. 实验室通过下列流程从净化除氯后的含碘海水中提取I2。
A、装置Ⅰ中可将换成 B、装置Ⅱ洗气瓶中用饱和溶液除去中的少量HCl C、装置Ⅲ中反应的离子方程式为 D、装置Ⅴ锥形瓶中用澄清石灰水来吸收尾气9. 实验室通过下列流程从净化除氯后的含碘海水中提取I2。
下列有关说法错误的是( )
 A、富集得到含碘化合物的晶胞如图,其中距离每个I-最近的Ag+有4个 B、转化后的溶液中主要含有Fe2+和I- C、用稀HNO3溶解滤渣Y得到的溶液可循环利用 D、氧化时,理论上通入氯气的量至少控制为溶液中溶质物质的量的1.5倍10. 异黄酮类化合物是药用植物的有效成分。一种异黄酮Z的部分合成路线如下:
A、富集得到含碘化合物的晶胞如图,其中距离每个I-最近的Ag+有4个 B、转化后的溶液中主要含有Fe2+和I- C、用稀HNO3溶解滤渣Y得到的溶液可循环利用 D、氧化时,理论上通入氯气的量至少控制为溶液中溶质物质的量的1.5倍10. 异黄酮类化合物是药用植物的有效成分。一种异黄酮Z的部分合成路线如下:
下列有关化合物X、Y和Z的说法错误的是( )
A、1molX中含有3mol碳氧σ键 B、Y与足量的H2加成所得的有机物中含2个手性碳原子 C、Z在水中的溶解度比Y大 D、X、Y、Z遇FeCl3溶液均显色11. 已知H2C2O4是一种二元弱酸。室温下,通过下列实验探究NaHC2O4溶液的性质。实验
实验操作和现象
1
测得10mL0.1mol·L-1NaHC2O4溶液的pH约为5.5
2
向酸性KMnO4溶液中滴加过量0.1mol·L-1NaHC2O4溶液,溶液紫红色褪色
3
向0.1mol·L-1NaHC2O4溶液中加入等体积0.1mol·L-1Ba(OH)2溶液,溶液变浑浊
4
向10mL0.1mol·L-1NaHC2O4溶液中滴加少量0.1mol·L-1NaOH溶液,无明显现象
下列说法正确的是( )
A、依据实验1推测:Kw<Ka1(H2C2O4)×Ka2(H2C2O4) B、实验2说明:NaHC2O4溶液具有漂白性 C、依据实验3推测:Ksp(BaC2O4)>2.5×10-3 D、实验4反应后的溶液中存在:c(Na+)=c(H2C2O4)+c(HC2O)+(C2O)12. 草酸二甲酯[(COOCH3)2]催化加氢制乙二醇的反应体系中,发生的主要反应为反应I:(COOCH3)2(g)+2H2(g)CH3OOCCH2OH(g)+CH3OH(g) ΔH1<0
反应II:(COOCH3)2(g)+4H2(g)HOCH2CH2OH(g)+2CH3OH(g) ΔH2<0
压强一定的条件下,将(COOCH3)2、H2按一定比例、流速通过装有催化剂的反应管,测得(COOCH3)2的转化率及CH3OOCCH2OH、HOCH2CH2OH的选择性[×100%]与温度的关系如图所示。下列说法正确的是( )
 A、曲线B表示HOCH2CH2OH的选择性随温度变化 B、190~198℃范围内,温度升高,(COOCH3)2的平衡转化率增大 C、190~198℃范围内,温度升高,逐渐减小 D、192℃时,其他条件一定,加快气体的流速可以提高(COOCH3)2转化率
A、曲线B表示HOCH2CH2OH的选择性随温度变化 B、190~198℃范围内,温度升高,(COOCH3)2的平衡转化率增大 C、190~198℃范围内,温度升高,逐渐减小 D、192℃时,其他条件一定,加快气体的流速可以提高(COOCH3)2转化率二、多选题
-
13. 室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )
选项
实验操作和现象
结论
A
向苯酚浊液中滴入Na2S溶液,浊液变清
C6H5O-结合H+的能力比S2-的弱
B
将X溶液滴在KI淀粉试纸上,试纸变蓝色
X溶液中一定含有I2
C
向FeCl2和KSCN的混合溶液中滴入酸化的AgNO3溶液,溶液变红
Ag+的氧化性一定比Fe3+的强
D
向2支均盛有2 mL相同浓度Na3[Ag(S2O3)2]溶液的试管中,分别滴入2滴相同浓度的KCl、KI溶液,前者无明显现象,后者有黄色沉淀
Ksp(AgI)<Ksp(AgCl)
A、A B、B C、C D、D三、综合题
-
14. 用油脂氢化后废弃的镍催化剂(主要成分Ni、Al,少量其他不溶性物质)制备NiCO3·2Ni(OH)2·2H2O并研究其分解反应的过程如下:(1)、制NiSO4溶液。向废镍催化剂中加入足量NaOH溶液,充分反应后过滤。向洗涤后的滤渣中加入稀硫酸至Ni恰好完全溶解,过滤。加入NaOH溶液的作用是。(2)、制NiCO3·2Ni(OH)2·2H2O控制温度为55℃,向NiSO4溶液中加入适量Na2CO3溶液,有NiCO3·2Ni(OH)2·2H2O沉淀生成和CO2气体放出,过滤。
①为确定所加Na2CO3的添加量,需测定NiSO4溶液的浓度。准确量取5.00mL溶液于100mL容量瓶中,加水稀释至刻度;准确量取20.00mL稀释后的溶液于锥形瓶中,用0.04000mol·L-1EDTA(Na2H2Y)标准溶液滴定至终点(滴定反应为Ni2++H2Y2-=NiY2-+2H+),平行滴定3次,平均消耗EDTA标准溶液31.25mL。计算NiSO4溶液的物质的量浓度(写出计算过程)。
②生成NiCO3·2Ni(OH)2·2H2O时所发生反应的离子方程式为。
③若将NiSO4溶液加入到Na2CO3溶液中,会使沉淀中镍元素含量偏高,原因是。
(3)、NiCO3·2Ni(OH)2·2H2O热分解。在氧气气氛中加热NiCO3·2Ni(OH)2·2H2O,固体质量随温度变化的曲线如图所示。
①500-700K之间分解产生的气体为。
②800K后剩余固体质量略有增加的原因是。
15. F是一种治疗心脑血管疾病药物的中间体,其合成路线如下(表示苯基): (1)、C分子中采取杂化的碳原子数目是。(2)、D的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:。
(1)、C分子中采取杂化的碳原子数目是。(2)、D的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:。①能发生银镜反应和水解反应。
②分子中有5种不同化学环境的氢原子。
③每个苯环上只含1种官能团。
(3)、的反应需经历的过程,中间体X的分子式为。X→F的反应类型为。(4)、E—F的反应中有一种分子式为的副产物生成,该副产物的结构简式为。(5)、已知: , 写出以 和
和 为原料制备
为原料制备 的合成路线(无机溶剂和有机溶剂任用,合成路线流程图示例见本题题干)。 16. 由铁铬合金(主要成分Cr、Fe,含少量Co、Ni等)可以制取Cr2O3、FeC2O4·2H2O和LiFePO4。实验流程如下:
的合成路线(无机溶剂和有机溶剂任用,合成路线流程图示例见本题题干)。 16. 由铁铬合金(主要成分Cr、Fe,含少量Co、Ni等)可以制取Cr2O3、FeC2O4·2H2O和LiFePO4。实验流程如下: (1)、“酸溶”时应先向反应器中加入硫酸,再分批加入铬铁合金粉末,同时需保持强制通风。
(1)、“酸溶”时应先向反应器中加入硫酸,再分批加入铬铁合金粉末,同时需保持强制通风。①分批加入铬铁合金粉末并保持强制通风的原因是。
②其他条件相同,实验测得相同时间内铬铁转化率[×100%]、析出硫酸盐晶体的质量随硫酸浓度变化情况如图所示。当硫酸的浓度为9~11mol·L-1 , 铬铁转化率下降的原因:。(已知硫酸浓度大于12mol·L-1时铁才会钝化)
 (2)、向酸溶所得溶液中加入0.5mol·L-1Na2S溶液,使Co2+和Ni2+转化为CoS和NiS沉淀。当上层清液中c(Ni2+)=1.0×10-5mol·L-1时,c(Co2+)=。[已知:Ksp(CoS)=1.8×10-22 , Ksp(NiS)=3.0×10-21](3)、在N2的氛围中将FeC2O4·2H2O与LiH2PO4按物质的量之比1:1混合,360℃条件下反应可获得LiFePO4 , 同时有CO和CO2生成。写出该反应的化学方程式:。(4)、设计由沉铁后的滤液(含Cr3+和少量Fe2+)制备Cr2O3的实验方案: , 过滤、洗涤、干燥、500℃煅烧。已知:①P507萃取剂密度小于水,萃取Fe3+时萃取率与溶液pH的关系如图所示。②该实验中Cr3+在pH6.0时开始沉淀,pH=8.0时沉淀完全。pH=12时Cr(OH)3开始溶解。实验中须选用试剂:P507萃取剂、H2O2、NaOH溶液]
(2)、向酸溶所得溶液中加入0.5mol·L-1Na2S溶液,使Co2+和Ni2+转化为CoS和NiS沉淀。当上层清液中c(Ni2+)=1.0×10-5mol·L-1时,c(Co2+)=。[已知:Ksp(CoS)=1.8×10-22 , Ksp(NiS)=3.0×10-21](3)、在N2的氛围中将FeC2O4·2H2O与LiH2PO4按物质的量之比1:1混合,360℃条件下反应可获得LiFePO4 , 同时有CO和CO2生成。写出该反应的化学方程式:。(4)、设计由沉铁后的滤液(含Cr3+和少量Fe2+)制备Cr2O3的实验方案: , 过滤、洗涤、干燥、500℃煅烧。已知:①P507萃取剂密度小于水,萃取Fe3+时萃取率与溶液pH的关系如图所示。②该实验中Cr3+在pH6.0时开始沉淀,pH=8.0时沉淀完全。pH=12时Cr(OH)3开始溶解。实验中须选用试剂:P507萃取剂、H2O2、NaOH溶液] 17. 工厂烟气(主要污染物SO2、NO)直接排放会造成空气污染,需处理后才能排放。(1)、O3氧化。O3氧化过程中部分反应的能量变化如图所示。
17. 工厂烟气(主要污染物SO2、NO)直接排放会造成空气污染,需处理后才能排放。(1)、O3氧化。O3氧化过程中部分反应的能量变化如图所示。
①已知2SO2(g)+O2(g) =2SO3(g) ΔH =−198 kJ·mol−1。则反应2O3(g)=3O2(g)的 ΔH=kJ·mol−1。
②其他条件不变时,增加n(O3),O3氧化SO2的反应几乎不受影响,其可能原因是。
(2)、NaClO2氧化。40 ℃时向一定量NaClO2溶液中按一定流速持续通入工厂烟气,溶液的pH与ORP值(氧化还原电位)随时间变化如图所示。
①写出NO与ClO反应的离子方程式:。
②烟气中含有少量SO2 , 能提高NO的脱除率,可能原因是。
(3)、TiO2光催化。主要是利用TiO2光催化剂在紫外线作用下产生的高活性自由基(·OH、·O)和h+(h+代表空位,空位有很强的得电子能力),将烟气中的SO2、NO等氧化除去。TiO2光催化剂粒子表面产生·OH的机理如图所示(图中部分产物略去)。已知TiO2中电子跃迁的能量hv=3.2eV。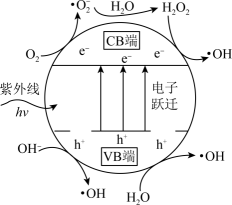
①TiO2光催化剂在紫外线作用下产生·OH的过程可描述为。
②在TiO2中掺杂一定量的金属离子可提高光催化活性。对所掺杂金属离子的要求是。
-