四川省遂宁市射洪市2022-2023学年高一上学期10月月考化学试题
试卷更新日期:2022-10-28 类型:月考试卷
一、选择题(本大题包含14小题,每小题3分,每题只有一个选项符合要求。)
-
1. 下列各组物质不属于同素异形体的是( )A、H2O和H2O2 B、O2和O3 C、金刚石和石墨 D、红磷和白磷2. 下列电离方程式的书写,正确的是( )A、2Na++SO42-= Na2SO4 B、H2SO4= 2H+ + SO42- C、CuCl2= Cu2+ + Cl― D、NaHCO3= Na+ + H+ + CO32-3. 下列分散系能产生丁达尔效应的是( )A、NH4Cl溶液 B、浑浊的河水 C、油水 D、Fe(OH)3胶体4. 下列物质的分类正确的是( )
选项
碱
盐
碱性氧化物
酸性氧化物
A
NaOH
NaHCO3
Mn2O7
CO
B
Na2CO3
NaCl
Na2O
CO2
C
KOH
CaCO3
CaO
SO2
D
Ba(OH)2
Fe(OH)3
MgO
SO3
A、A B、B C、C D、D5. “探险队员”——硫酸,不小心走进了有许多“吃人的野兽”(即能与硫酸发生化学反应的物质)的小山,如图所示逃生线路有多种,但有一种线路是完全行不通的,处处为陷阱,即为入口→③→⑤→⑦→⑨→出口, 则该线路涉及的物质为( ) A、Na2CO3、Fe(OH)3、Zn、Fe2O3 B、SO3、Cu、BaCl2、HCl C、Zn、Fe(OH)3、KNO3、CuO D、SO3、Cu、NaCl、CuO6. 下列说法正确的是( )A、在熔融状态下不能导电的物质都属于非电解质 B、稀HCl溶液在电流的作用下电离出H+和Cl-而导电 C、液态硫酸,固体NaCl不导电,但属于电解质 D、NaOH溶液的导电能力一定比氨水强7. 下列逻辑关系图示中正确的是( )A、
A、Na2CO3、Fe(OH)3、Zn、Fe2O3 B、SO3、Cu、BaCl2、HCl C、Zn、Fe(OH)3、KNO3、CuO D、SO3、Cu、NaCl、CuO6. 下列说法正确的是( )A、在熔融状态下不能导电的物质都属于非电解质 B、稀HCl溶液在电流的作用下电离出H+和Cl-而导电 C、液态硫酸,固体NaCl不导电,但属于电解质 D、NaOH溶液的导电能力一定比氨水强7. 下列逻辑关系图示中正确的是( )A、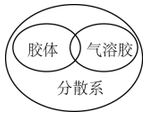 B、
B、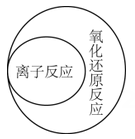 C、
C、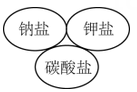 D、
D、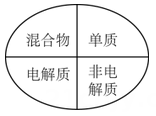 8. 下列离子方程式书写正确的是( )A、硝酸银与盐酸反应:AgNO3+Cl-=AgCl↓+NO B、铜片插入硝酸银溶液中:Cu+Ag+=Ag+Cu2+ C、硫酸和氯化钡溶液反应:Ba2++SO=BaSO4↓ D、铁钉放入硫酸铜溶液中:2Fe+3Cu2+=2Fe3++3Cu9. 下列化学反应中能用离子方程式2H++CO32-=CO2↑+H2O表示的是( )A、碳酸钠与足量稀硫酸 B、碳酸钡与稀盐酸 C、碳酸氢钠与稀盐酸 D、碳酸钠与足量醋酸(CH3COOH)10. 下列各组离子在给定条件下能大量共存的是( )A、在某无色透明溶液中:K+、NH4+、Cl-、Fe3+ B、在强碱溶液中:NO、K+、CO32-、Na+ C、有SO42-存在的溶液中:Mg2+、Br-、Ba2+、Cl- D、使石蕊试液变红的溶液中:Na+、HCO3-、Cl-、NO3-11. 下列关于氧化还原反应认识正确的是( )A、金属单质在化学反应中只能做还原剂 B、还原剂只具有还原性 C、氧化剂只具有氧化性 D、还原剂具有还原性,在反应中被氧化,得到还原产物12. 下列反应中,水只做氧化剂的是( )A、3NO2+H2O=2HNO3+NO B、2F2+2H2O=4HF+O2 C、2Na+2H2O=2NaOH+H2↑ D、2H2O2H2↑+O2↑13. 下列变化过程中,需要加入氧化剂才能实现的是( )A、H2SO4H2 B、AlO2-Al(OH)3 C、MnO2Mn2+ D、AsO33-AsO43-14. 常温下,在下列溶液中发生如下反应:
8. 下列离子方程式书写正确的是( )A、硝酸银与盐酸反应:AgNO3+Cl-=AgCl↓+NO B、铜片插入硝酸银溶液中:Cu+Ag+=Ag+Cu2+ C、硫酸和氯化钡溶液反应:Ba2++SO=BaSO4↓ D、铁钉放入硫酸铜溶液中:2Fe+3Cu2+=2Fe3++3Cu9. 下列化学反应中能用离子方程式2H++CO32-=CO2↑+H2O表示的是( )A、碳酸钠与足量稀硫酸 B、碳酸钡与稀盐酸 C、碳酸氢钠与稀盐酸 D、碳酸钠与足量醋酸(CH3COOH)10. 下列各组离子在给定条件下能大量共存的是( )A、在某无色透明溶液中:K+、NH4+、Cl-、Fe3+ B、在强碱溶液中:NO、K+、CO32-、Na+ C、有SO42-存在的溶液中:Mg2+、Br-、Ba2+、Cl- D、使石蕊试液变红的溶液中:Na+、HCO3-、Cl-、NO3-11. 下列关于氧化还原反应认识正确的是( )A、金属单质在化学反应中只能做还原剂 B、还原剂只具有还原性 C、氧化剂只具有氧化性 D、还原剂具有还原性,在反应中被氧化,得到还原产物12. 下列反应中,水只做氧化剂的是( )A、3NO2+H2O=2HNO3+NO B、2F2+2H2O=4HF+O2 C、2Na+2H2O=2NaOH+H2↑ D、2H2O2H2↑+O2↑13. 下列变化过程中,需要加入氧化剂才能实现的是( )A、H2SO4H2 B、AlO2-Al(OH)3 C、MnO2Mn2+ D、AsO33-AsO43-14. 常温下,在下列溶液中发生如下反应:①16H++10Z-+2XO4-=2X2++5Z2+8H2O
②2A2++B2=2A3++2B-
③2B-+Z2=B2+2Z-
由此判断下列说法正确的是( )
A、Z元素在①③反应中均被氧化 B、还原性由强到弱的顺序是A2+、B-、Z-、X2+ C、氧化性由强到弱的顺序是XO4-、B2、Z2、A3+ D、反应Z2+2A2+=2A3++2Z-不能进行二、非选择题(本题包括4小题,共58分)
-
15. 现有中学化学中常见的一些物质:①空气 ②氯气 ③氢氧化钠 ④熔融状态的硝酸钾 ⑤铁⑥葡萄糖⑦硫酸⑧氯化铁溶液(将序号填入下面划线中)
在以上物质中,
(1)、属于单质的是 , 属于混合物的是;(2)、属于电解质的是 , 属于非电解质的是;(3)、属于酸的是 , 属于碱的是 , 属于盐(包括盐溶液)的是;(4)、能导电的是。16. NaNO2易溶于水,外观和食盐相似,有咸味,人误食会中毒。已知NaNO2能发生如下反应:2NaNO2+4HI =2NO↑+I2+2NaI+2H2O。请回答下列问题:(1)、已知HI和HCl性质相似,写出上述反应的离子方程式并用双线桥标出电子转移的方向和数目。(2)、上述反应中(填元素名称)元素被还原,还原剂是(填化学式);(3)、NaI(填序号)。①是氧化产物 ②是还原产物
③既不是氧化产物,又不是还原产物 ④既是氧化产物,又是还原产物
(4)、根据上述反应可鉴别NaNO2和NaCl。可选用的物质有:①水 ②碘化钾淀粉试纸 ③淀粉 ④白酒 ⑤食醋你认为应该选用的物质有(填序号)。
(5)、某厂废液中含有2%~5%的NaNO2 , 直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是 。A、NaCl B、NH4Cl C、HNO3 D、浓硫酸17.(1)、I.现有一个氧化还原反应:2KMnO4 + 10KCl+8H2SO4 =2MnSO4 + 6K2SO4 +5Cl2 ↑+ 8H2O该反应中,化合价升高的反应物是 , 化合价没有发生变化的反应物是。
(2)、如果在反应后的溶液中加入NaBiO3 , 溶液又变成紫红色,则氧化性强弱:NaBiO3KMnO4(填“>”、“<”、“=”)(3)、II.人体血红蛋白分子中含有Fe2+ , 正是这些Fe2+使血红蛋白分子具有载氧功能。亚硝酸钠(NaNO2)可将人体血红蛋白中 Fe2+转化为Fe3+ , 生成高铁血红蛋白而丧失与氧气的结合能力。
Fe2+转化为Fe3+ , 生成高铁血红蛋白而丧失与氧气的结合能力。 反应过程中亚硝酸钠发生反应,说明Fe2+具有性;误食亚硝酸钠中毒,可服维生素C缓解,通过发生氧化还原反应解毒,说明维生素C具有性。
(4)、FeCl2易在酸性溶液(含HCl)中与H2O2溶液反应生成FeCl3 , 该反应的化学反应方程式为:2FeCl2 + H2O2 + 2HCl=2FeCl3 + 2H2O ,则发生反应的H2O2分子与转移的电子数之比为。
(5)、Fe3+对H2O2的分解也有催化作用,若分别用高锰酸钾和H2O2制得等质量氧气,反应过程中转移的电子数之比为
18. 有一包白色固体粉末,其中可能含有NaCl、Ba(NO3)2、CuSO4、Na2CO3中的一种或几种(已知CuCO3在溶液中不存在),现做以下实验:①将部分粉末加入水中,振荡,有白色沉淀生成,过滤后溶液呈无色;
②向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生;
③取少量②的溶液,滴入稀硫酸,有白色沉淀产生;
④另取①中过滤后的溶液加入足量AgNO3溶液产生白色沉淀。
试根据上述实验事实,回答下列问题:
(1)、原白色粉末中一定含有的物质是 , 一定不含的物质是 , 可能含有的物质是。(以上各种物质均写化学式)(2)、写出下列步骤中发生反应的离子方程式:①;
②;
③。