辽宁省鞍山市普通高中2021-2022学年高一上学期期末质量监测化学试题
试卷更新日期:2022-10-20 类型:期末考试
一、单选题
-
1. SARS-CoV-2依然在全球多个国家和地区肆虐,该病毒直径为 , 下列说法错误的是( )A、该病毒是一种胶体,可通过空气传播 B、触碰公共设施后,可用乙醇凝胶对手部进行消毒 C、对环境进行消毒时可使用84消毒液 D、勤洗手、戴口罩、保持社交距离可有效遏制病毒传播2. 下列过程的原理属于物理变化的是( )A、食物腐败 B、铜器表面出现铜绿 C、焰色试验 D、石墨转化为金刚石3. 由下列描述可推断其一定是非金属元素的是( )A、形成的单质不易失去电子 B、形成的单质能与碱反应 C、该元素的原子核外最外层只有1个电子 D、该元素的原子序数为174. 下列有关物质的成分与用途的相关说法中,错误的是( )A、钡餐的主要成分是 , 可用作肠胃造影 B、硬铝中主要含、等金属元素,可用于制造航天器 C、硫酸亚铁片的有效成分是 , 主要用于治疗缺铁性贫血 D、苏打和小苏打都是钠盐,均可用作食用碱或工业用碱5. 下列关于物质分类的正确组合是( )
选项
强碱
电解质
离子化合物
酸性氧化物
A
B
C
D
A、A B、B C、C D、D6. 某澄清溶液滴到试纸上,试纸显红色,则下列离子组合可在该溶液中大量存在的是( )A、、、 B、、、 C、、、 D、、、7. 设为阿伏加德罗常数的值,下列说法正确的是( )A、溶液中含有的数为 B、作氧化剂时转移电子数一定为 C、在足量空气中充分反应生成和的混合物,总数为 D、中含有的电子数为8. 下列关于试剂的存放说法正确的是( )A、金属Na保存在盛有煤油的细口瓶中 B、波尔多液用铁桶盛装 C、铝制容器长期盛放碳酸钠溶液 D、用棕色试剂瓶装新制氯水9. 离子方程式可揭示反应的实质,下列离子方程式书写正确的是( )A、刻蚀铜电路板: B、实验室制备氯气时的尾气处理: C、石灰乳与碳酸钠溶液反应: D、将绿豆大小的钾投入水中:10. 为除去括号内的杂质,所选用的试剂或方法正确的是( )A、(水蒸气),将气体通过碱石灰 B、NaHCO3溶液(Na2CO3),加入适量的NaOH溶液 C、MgCl2溶液(AlCl3),通入过量的氨气,滤出固体并洗净,加入适量盐酸溶解 D、Na2O2固体(Na2O),将固体置于过量而纯净的O2中充分加热11. 某化学兴趣小组在实验室中模拟并改进侯氏制碱法制备NaHCO3 , 进一步处理得到产品Na2CO3和 , 实验流程如图:
下列说法错误的是( )
A、步骤①离子方程式为: B、步骤②为煅烧,产生的气体是 C、食盐水可循环利用 D、纯碱指的是12. “海绵-铁催化剂”是指一类具有特定微孔结构的强吸附性铁单质催化剂。制备时,可将具有特定组成的铁铝合金放入适当浓度的M溶液中浸出,则M溶液可能是( )A、醋酸 B、盐酸 C、氨水 D、氢氧化钠溶液13. V(钒)能形成多种不同颜色的离子,其转化关系如图所示(注:图中所加试剂均足量),下列说法正确的是( ) A、图中转化关系只有部分存在电子转移 B、由图中转化可知,I-比Zn还原性强 C、可加入氧化剂实现溶液由黄色转化为蓝色 D、V(钒)有、、、等多种化合价14. 根据表中部分短周期元素的原子半径及主要化合价信息,下列说法正确的是( )
A、图中转化关系只有部分存在电子转移 B、由图中转化可知,I-比Zn还原性强 C、可加入氧化剂实现溶液由黄色转化为蓝色 D、V(钒)有、、、等多种化合价14. 根据表中部分短周期元素的原子半径及主要化合价信息,下列说法正确的是( )元素代号
J
L
M
Q
R
T
原子半径/nm
0.082
0.152
0.143
0.186
0.104
0.066
主要化合价
、
A、氢化物的沸点为 B、单质与冷水反应的剧烈程度为 C、L单质在T单质中燃烧可生成 D、J可形成 , 且与的核外电子排布相同15. 与NO在焦炭表面发生反应的机理简化如下(化学键和部分微粒未标出):
下列有关说法错误的是( )
A、CO2为直线形分子 B、N2O为催化剂 C、N2的结构式为: D、参与反应的微粒有部分化学键未发生断裂16. 某牛奶营养成分表的一部分如表所示,下列说法正确的是( )项目
每100g
NRV%
能量
309kJ
4%
……
钠
65mg
3%
钙
100g
15%
(注:NRV%是指每100g食品中营养素的含量占该营养素每日建议摄入量的比)A.钙的原子结构示意图:
 A、该牛奶每100g含钠盐65mg B、若牛奶的密度近似为1g/mL,则该牛奶中Na+的物质的量浓度约为 C、由表可计算出每日建议摄入钙18mg17. 某实验小组进行的制备和性质探究,下列装置和药品能实现相应实验目的的是( )
A、该牛奶每100g含钠盐65mg B、若牛奶的密度近似为1g/mL,则该牛奶中Na+的物质的量浓度约为 C、由表可计算出每日建议摄入钙18mg17. 某实验小组进行的制备和性质探究,下列装置和药品能实现相应实验目的的是( ) A、利用甲制备 B、利用乙除去中混有的HCl杂质 C、利用丙探究无漂白性 D、利用丁观察和燃烧反应的火焰颜色18. 一份由LiNO3与LiNO2组成的混合物,经测定其中N元素的质量分数为24%,则O元素的质量分数为( )A、52% B、60.4% C、64% D、69.6%19. 某实验小组利用点滴板实验来探究卤素单质的氧化性顺序,关于该实验说法正确的是( )
A、利用甲制备 B、利用乙除去中混有的HCl杂质 C、利用丙探究无漂白性 D、利用丁观察和燃烧反应的火焰颜色18. 一份由LiNO3与LiNO2组成的混合物,经测定其中N元素的质量分数为24%,则O元素的质量分数为( )A、52% B、60.4% C、64% D、69.6%19. 某实验小组利用点滴板实验来探究卤素单质的氧化性顺序,关于该实验说法正确的是( ) A、孔穴4中的溶液呈浅黄绿色 B、孔穴2中的溶液反应后与孔穴3颜色最相近 C、孔穴3、4中的溶液仅用作对比 D、仅由上述实验现象无法得出、、的氧化性顺序20. 实验室测定氧化物X(FexO)的组成,流程如下(空气对该实验结果的影响可忽略):
A、孔穴4中的溶液呈浅黄绿色 B、孔穴2中的溶液反应后与孔穴3颜色最相近 C、孔穴3、4中的溶液仅用作对比 D、仅由上述实验现象无法得出、、的氧化性顺序20. 实验室测定氧化物X(FexO)的组成,流程如下(空气对该实验结果的影响可忽略):
下列有关说法错误的是( )
A、溶液Y中 B、 C、溶液Z中的阳离子只有、H+ D、步骤Ⅰ、Ⅱ均发生了离子反应二、填空题
-
21. 回答下列问题:(1)、氯元素主要以Cl形式广泛存在于自然界。
①稳定性:ClCl- , 微粒半径:Cl Cl-。(填“>”或“<”)
②图一为氯及其化合物的“价—类”二维图。缺失的类别A为 , 物质B为(填化学式)。能够实现图中a转化的反应方程式为(合理即可)。
 (2)、某反应中发生的化学反应涉及O2、NO2、KNO3、CuSO4、K2SO4、CuO六种物质,检测器显示其中NO2的物质的量随时间变化如图所示,请回答下列问题:
(2)、某反应中发生的化学反应涉及O2、NO2、KNO3、CuSO4、K2SO4、CuO六种物质,检测器显示其中NO2的物质的量随时间变化如图所示,请回答下列问题:
①该反应中O2为(填代号)。
A.反应物 B.生成物 C.氧化剂 D.氧化产物
②写出该反应的化学方程式。
③当反应中有个电子发生转移时、产生NO2的质量为g。
22. 实验室加热液体时,常加入沸石、其主要成分为 , 根据其组成元素完成下列填空:(1)、指出元素在周期表中的位置。(2)、沸石中的元素可形成多种化合物;元素与原子半径最小的元素组成化合物甲,常作强还原剂,化合物甲的电子式为;化合物乙可作为呼吸面具或潜艇氧气的来源,乙是(填化学式),化合物乙中存在的化学键类型为。(3)、O元素和其同周期相邻的两种元素分别形成的简单氢化物中最稳定的是(填化学式)。(4)、已知硅酸(H2SiO3)为白色胶状沉淀。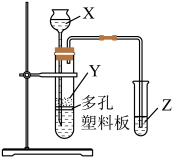
实验室中现有药品:①稀盐酸、②稀硫酸、③NaHCO3固体、④CaCO3固体、⑤Na2SiO3溶液,请选择合适药品利用上述装置设计实验验证C、Si的非金属性的变化规律;装置X、Y、Z处所盛装或放置的药品分别为、、(填序号)。但有同学认为该实验所得现象无法充分证明C、Si的非金属性强弱,如何改进?。
(5)、Uue是暂时未合成的化学元素,与Na同主族,位于第八周期,称为类钫,其一种可能存在的核素原子核中有180个中子,则中A=、Z=。三、综合题
-
23. 秋耳是中国的传统食材,其中含有丰富的蛋白质、多糖及有益元素:(1)、 (一)秋耳中铁元素的检验
实验方案:取适量干秋耳粉平均分成三份,实验操作和现象记录如下:
实验
操作步骤
检验试剂
现象
实验一
适量蒸馏水浸泡,过滤,取滤液,加检验试剂,后加入适量H2O2 , 再次加入检验试剂
KSCN溶液
均无明显现象
实验二
在坩埚中充分灼烧,加适量盐酸浸泡,取滤液,加检验试剂
KSCN溶液
极浅的红色
实验三
在坩埚中充分灼烧,加适量盐酸、H2O2浸泡,取滤液,加检验试剂
KSCN溶液
较深的红色
根据上述实验,回答下列问题:
灼烧秋耳粉时,除了坩埚还需要下列仪器中的(填代号)。A.
 B.
B. C.
C. D.
D. E.
E. (2)、实验三加入H2O2的目的是 , 写出H2O2参与的最主要反应的离子方程式。(3)、由三组实验做出如下推断,其中合理的是:____(填代号)。A、秋耳粉样品中含铁量极低 B、秋耳中的铁元素很难用蒸馏水直接溶出 C、仅用盐酸无法溶出秋耳灰分中的铁元素 D、灼烧的目的是将秋耳中的铁元素氧化(4)、(二)秋耳中铁元素的含量测定
(2)、实验三加入H2O2的目的是 , 写出H2O2参与的最主要反应的离子方程式。(3)、由三组实验做出如下推断,其中合理的是:____(填代号)。A、秋耳粉样品中含铁量极低 B、秋耳中的铁元素很难用蒸馏水直接溶出 C、仅用盐酸无法溶出秋耳灰分中的铁元素 D、灼烧的目的是将秋耳中的铁元素氧化(4)、(二)秋耳中铁元素的含量测定实验步骤如下:
①取5.000g秋耳粉,在坩埚中充分灼烧至灰白色,将灰分转移至干燥器中冷却,称其质量为0.235g;
②向灰分中加入4mL浓硝酸,微热10min,过滤,并用少量盐酸洗涤烧杯和沉淀,滤液和洗涤液合并;
③将合并液定容成50mL待测液,利用分光光度法测得铁的浓度为。
根据上述实验,回答下列问题:
步骤②洗涤烧杯和沉淀的目的是。
(5)、步骤③定容操作若仰视容量瓶刻度线,会造成秋耳样品含铁量测定结果(填“偏高”、“偏低”或“无影响”)。(6)、根据实验数据计算秋耳含铁量为。