陕西省渭南市临渭区华州区2021-2022学年高二上学期期末考试化学试题
试卷更新日期:2022-10-20 类型:期末考试
一、单选题
-
1. 化学与科学、技术、社会环境切相关。下列说法错误的是( )A、利用太阳能等清洁能源代替化石燃料,有利于节约能源保护环境 B、日常生活中的废旧电池会污染环境,应填埋处理 C、物质的化学能可以在不同的条件下转化为热能、电能被人类利用 D、家用铁锅用水清洗后放置在干燥处,能减缓铁锅生锈2. 某反应只有在高温下才具有自发性,则对该反应的△H和△S判断正确的是( )A、△H>0、△S>0 B、△H<0、△S<0 C、△H>0、△S<0 D、△H<0、△S>03. 下列事实或操作与盐类水解无关的是( )A、明矾净水 B、泡沫灭火器灭火 C、电解氯化钠溶液制备氢氧化钠 D、氯化铵溶液除铁锈4. 在密闭容器中发生下列反应aA(g)+bB(s) cC(g)+dD(g),反应达到平衡后,将容器体积扩大到原来的2倍,当再次达到平衡时,D的浓度为原平衡的0.6倍,下列叙述错误的是( )A、a+b < c+d B、平衡向正反应方向移动 C、D的物质的量变大 D、A的转化率变大5. 关于中和热的测定实验,下列说法正确的是( )A、在实验中,温度计只使用2次 B、向盛装酸的烧杯中加碱时要小心缓慢以免洒出 C、用铁丝代替玻璃棒搅拌,会使测得的中和热数值偏大 D、为了使反应进行的更完全,可以使酸或碱适当过量6. 下列说法错误的是( )A、25℃时,AgCl(s)在等浓度的CaCl2和FeCl3溶液中的溶解度不同 B、升高温度,可提高活化分子百分数,使有效碰撞几率提高,化学反应速率加快 C、活化分子之间发生的碰撞一定为有效碰撞 D、洗发时使用护发素,其主要功能是调节头发的pH使之达到适宜的酸碱度7. 将金属M连接在钢铁设施表面,可减缓水体中钢铁设施的腐蚀。在如图所示的情境中,下列有关说法正确的是( )
 A、正极的电极反应式为 B、金属M的活动性比Fe的活动性弱 C、钢铁设施在河水中的腐蚀速率比在海水中的快 D、当水体呈较强酸性时,钢铁设施表面会有气泡冒出8. 资源化利用CO2是实现“碳中和”的重要途径,CO2光催化转化为CH4的方法入选了2020年世界十大科技进展,其原理为:CO2+4H2CH4+2H2O。CO2与氢气反应制CH4的一种催化机理如图所示,下列说法正确的是( )
A、正极的电极反应式为 B、金属M的活动性比Fe的活动性弱 C、钢铁设施在河水中的腐蚀速率比在海水中的快 D、当水体呈较强酸性时,钢铁设施表面会有气泡冒出8. 资源化利用CO2是实现“碳中和”的重要途径,CO2光催化转化为CH4的方法入选了2020年世界十大科技进展,其原理为:CO2+4H2CH4+2H2O。CO2与氢气反应制CH4的一种催化机理如图所示,下列说法正确的是( ) A、反应中La2O3是中间产物 B、H2在Ni催化作用下产生•H过程的△S>0 C、反应中La2O2CO3释放出CO2 D、使用催化剂可以降低反应的焓变,从而提高化学反应速率9. 如图所示为工业合成氨的流程图。下列说法错误的是( )
A、反应中La2O3是中间产物 B、H2在Ni催化作用下产生•H过程的△S>0 C、反应中La2O2CO3释放出CO2 D、使用催化剂可以降低反应的焓变,从而提高化学反应速率9. 如图所示为工业合成氨的流程图。下列说法错误的是( ) A、步骤①中“净化”可以防止催化剂中毒 B、步骤②中“加压”既可以提高原料的转化率,又可以加快反应速率 C、步骤③、④、⑤均有利于提高原料平衡的转化率 D、为保持足够高的原料转化率,应在反应达到一定时间时将氨从混合气中分离出去10. 室温下,下列各组离子在指定溶液中一定能大量共存的是( )A、氨水溶液: Na+、K+、OH-、NO B、pH=1的溶液: Na+、NH、Cl-、CH3COO- C、0.1mol/L的NH4HCO3溶液:K+、SiO、Al3+、Cl- D、的溶液:Fe2+、Mg2+、NO、Cl-11. 在某一恒温容积可变的密闭容器中发生反应:A(g)+B(g)2C(g)。反应速率随时间的变化如图所示。下列说法正确的是( )
A、步骤①中“净化”可以防止催化剂中毒 B、步骤②中“加压”既可以提高原料的转化率,又可以加快反应速率 C、步骤③、④、⑤均有利于提高原料平衡的转化率 D、为保持足够高的原料转化率,应在反应达到一定时间时将氨从混合气中分离出去10. 室温下,下列各组离子在指定溶液中一定能大量共存的是( )A、氨水溶液: Na+、K+、OH-、NO B、pH=1的溶液: Na+、NH、Cl-、CH3COO- C、0.1mol/L的NH4HCO3溶液:K+、SiO、Al3+、Cl- D、的溶液:Fe2+、Mg2+、NO、Cl-11. 在某一恒温容积可变的密闭容器中发生反应:A(g)+B(g)2C(g)。反应速率随时间的变化如图所示。下列说法正确的是( ) A、0~t2时,υ正>υ逆 B、t2时刻改变的条件是向密闭容器中加入C C、Ⅰ、Ⅱ两过程达到平衡时,A的体积分数Ⅰ>Ⅱ D、Ⅰ、Ⅱ两过程达到平衡时,平衡常数Ⅰ>Ⅱ12. 液氨与纯水类似,也存在微弱的电离:NH3+NH3NH+NH , T ℃时,液氨的离子积常数K=c(NH)•c(NH)=1.0×10﹣30 , 若用定义pH的方式来规定pN=﹣lg c(NH),则下列叙述正确的是( )A、其他条件不变,增加液氨的量,电离平衡正向移动 B、液氨达到电离平衡时c(NH3)=c(NH)=c(NH) C、T ℃时的液氨中,pN=15 D、一定温度下,向液氨中加入氯化铵固体,电离平衡正向移动13. 工业废水中含重金属离子,可通过化学沉淀法将其除去, T℃时,Ag2S与PbS在水中的沉淀溶解平衡曲线如图所示。(Mn+表示Ag+和Pb2+)下列说法错误的是( )
A、0~t2时,υ正>υ逆 B、t2时刻改变的条件是向密闭容器中加入C C、Ⅰ、Ⅱ两过程达到平衡时,A的体积分数Ⅰ>Ⅱ D、Ⅰ、Ⅱ两过程达到平衡时,平衡常数Ⅰ>Ⅱ12. 液氨与纯水类似,也存在微弱的电离:NH3+NH3NH+NH , T ℃时,液氨的离子积常数K=c(NH)•c(NH)=1.0×10﹣30 , 若用定义pH的方式来规定pN=﹣lg c(NH),则下列叙述正确的是( )A、其他条件不变,增加液氨的量,电离平衡正向移动 B、液氨达到电离平衡时c(NH3)=c(NH)=c(NH) C、T ℃时的液氨中,pN=15 D、一定温度下,向液氨中加入氯化铵固体,电离平衡正向移动13. 工业废水中含重金属离子,可通过化学沉淀法将其除去, T℃时,Ag2S与PbS在水中的沉淀溶解平衡曲线如图所示。(Mn+表示Ag+和Pb2+)下列说法错误的是( )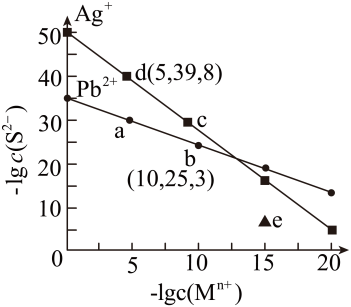 A、e点对应的PbS溶液为过饱和溶液 B、T ℃时, Ksp(PbS)=10-35.3 C、向含Ag2S沉淀的悬浊液中加入Na2S固体可实现d点到c点的变化 D、向含0.01 mol/L的Ag+、Pb2+的工业废水通入H2S气体,首先沉淀的是PbS14. 下列实验能达到实验目的的是( )
A、e点对应的PbS溶液为过饱和溶液 B、T ℃时, Ksp(PbS)=10-35.3 C、向含Ag2S沉淀的悬浊液中加入Na2S固体可实现d点到c点的变化 D、向含0.01 mol/L的Ag+、Pb2+的工业废水通入H2S气体,首先沉淀的是PbS14. 下列实验能达到实验目的的是( )选项
实验操作
实验目的
A
向1mL0.1mol/ LMgSO4溶液中加入1mL0.3mol/L KOH溶液,再滴5-6滴0.1mol/LCuSO4溶液,观察现象
比较Ksp[Cu(OH)2]、Ksp[ Mg(OH)2 ]的大小
B
用石墨电极电解Mg(NO3)2和Cu(NO3)2的混合液
比较铜和镁的金属活动性强弱
C
室温下用pH试纸测0.1mol/L NaClO溶液和0.1mol/LCH₃COONa溶液中的pH
比较CH3COOH和HClO的酸性强弱
D
向2支试管中分别加入同体积、同浓度的Na2S2O3 , 溶液,再分别加入同体积、不同浓度的稀硫酸,分别放入冷水和热水中
探究温度对反应速率的影响
A、A B、B C、C D、D15. 有一种瓦斯分析仪(如图甲)能够在煤矿巷道中的甲烷达到一定浓度时,通过传感器显示出来。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中固体电解质是Y2O3-Na2O,O2- 可以在其中自由移动。下列说法正确的是( ) A、瓦斯分析仪工作时,电池外电路中电流由电极a流向电极b B、电极b是正极,O2-由电极a流向电极b C、电极a的反应式为CH4 +5O2--8e- =CO +2H2O D、当固体电解质中有1molO2-通过时,转移电子2mol16. 在常温下,有关下列4种溶液的叙述中错误的是( )
A、瓦斯分析仪工作时,电池外电路中电流由电极a流向电极b B、电极b是正极,O2-由电极a流向电极b C、电极a的反应式为CH4 +5O2--8e- =CO +2H2O D、当固体电解质中有1molO2-通过时,转移电子2mol16. 在常温下,有关下列4种溶液的叙述中错误的是( )编号
①
②
③
④
溶液
氨水
氢氧化钠溶液
醋酸
盐酸
pH
11
11
3
3
A、分别取1mL稀释至10mL,四种溶液的pH:①>②>③>④ B、在溶液①、②中分别加入适量的氯化铵晶体,两种溶液的pH均减小 C、将aL溶液④与bL溶液②混合后,若所得溶液的pH=4,则a:b=11:9 D、将溶液①、④等体积混合,所得溶液中:c(NH)>c(Cl-)>c(OH-)>c(H+)二、填空题
-
17. 化学反应过程中发生物质变化的同时,常常伴有能量的变化。(1)、在微生物作用的条件下,NH经过两步反应被氧化成NO , 两步反应的能量变化示意图如图。


①第一步反应是(填“放热”或“吸热”)反应
②1mol NH(aq)全部氧化成NO(aq)热化学方程式为。
(2)、已知红磷比白磷稳定,且有反应:P4(白磷,s)+5O2(g) =2P2O5(s) △H1
4P(红磷,s)+5O2(g) =2P2O5(s) △H2
△H1△H2(填写“>”、“<”或“=”)
(3)、研究表明,化学反应能量变化与征键能有关。下列是部分化学键的键能数据。化学键
P-P
P-O
O=O
P=O
键能(KJ·mol-1)
197
360
499
x
已知:P4(s) +5O2(g)=P4O10(s) △H=-2378.0 kJ·mol-1 , 白磷(P4)及P4O10的结构如图,则x=
 (4)、充分燃烧一定量丁烷(C4H10)放出热量161.9 kJ,且生成的CO2 , 恰好能与100mL2.5mol·L-1氢氧化钡溶液完全反应生成沉淀,则燃烧1mol丁烷放出的热量为kJ。18. 草酸(H2C2O4)是一种还原性二元酸 ,存在于菠菜等植物中。已知:常温下,草酸的电离常数K,=5.4x10-2 , K2=5.4x10-5(1)、生活中,长期将豆腐与菠菜混合食用,容易损失钙元素且易患胆结石疾病。原因是。(2)、写出草酸在水中的电离方程式 。(3)、已知KHC2O4溶液呈酸性,则溶液中c(H2C2O4)(填“>”、“<”或“=”,下同) c(C2O)。若0.1 mol· L-1H2C2O4溶液中第二步电离的c(H+)=a mol·L-1 , 则0.1 mol·L-1KHC2O4溶液中HC2O电离出来的c(H+)a mol· L-1。(4)、常温下,将1mL某浓度的H2C2O4溶液加蒸馏水稀释,其溶液pH与加水稀释后溶液体积的关系如图1所示。
(4)、充分燃烧一定量丁烷(C4H10)放出热量161.9 kJ,且生成的CO2 , 恰好能与100mL2.5mol·L-1氢氧化钡溶液完全反应生成沉淀,则燃烧1mol丁烷放出的热量为kJ。18. 草酸(H2C2O4)是一种还原性二元酸 ,存在于菠菜等植物中。已知:常温下,草酸的电离常数K,=5.4x10-2 , K2=5.4x10-5(1)、生活中,长期将豆腐与菠菜混合食用,容易损失钙元素且易患胆结石疾病。原因是。(2)、写出草酸在水中的电离方程式 。(3)、已知KHC2O4溶液呈酸性,则溶液中c(H2C2O4)(填“>”、“<”或“=”,下同) c(C2O)。若0.1 mol· L-1H2C2O4溶液中第二步电离的c(H+)=a mol·L-1 , 则0.1 mol·L-1KHC2O4溶液中HC2O电离出来的c(H+)a mol· L-1。(4)、常温下,将1mL某浓度的H2C2O4溶液加蒸馏水稀释,其溶液pH与加水稀释后溶液体积的关系如图1所示。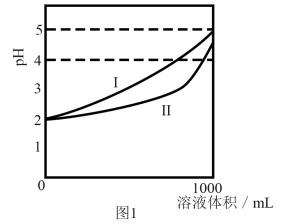
①图中能代表H2C2O2溶液稀释情况的是曲线(填“I”或“II”)。
②在稀释该溶液过程中,下列物理量始终增大的是(填字母)。
A. B.c(H+)·c(C2O) C. D.
(5)、常温下,向20 mL0.1 mol·L-1 NaHC2O4 , 溶液中缓慢滴加pH=13的NaOH溶液,混合溶液的温度与滴加NaOH溶液体积的关系如图2所示。
①试分析图中E、F、G三点,水的电离程度最大的是点。
②下列关系式正确的是(填字母)。
a.E点存在:2c(Na+)=3c(H2C2O4) +3c(H2C4O)+3c(C2O)
b.F点存在:c(H+ )=c (OH- )+c(HC2O)+c(H2C2O4)
c. G点对应的溶液中,c(Na+ )>c(OH- )>e(HC2O )>c(H2C2O4 )
三、综合题
-
19. 滴定实验是化学学科中最重要的定量实验之一(1)、Ⅰ.酸碱中的滴定---------充满HCl气体(标准状况下)的烧瓶做完喷泉实验后可得到稀盐酸,现用标准Na2CO3溶液滴定,以确定该稀盐酸的准确物质的量浓度。
用标准Na2CO3溶液滴定该稀盐酸时,Na2CO3溶液应装在如图的(填“甲”或“乙”)滴定管中,原因是(用离子方程式表示)。
 (2)、配制下列三种不同浓度的标准Na2CO3溶液,最合适的是____ (填字母)。A、5.000 mo/L B、0.5000 mol/L C、0.0500 mol/L(3)、Ⅱ.氧化还原滴定--------葡萄酒中抗氧化剂残留量的测定。葡萄酒常用Na2S2O5作抗氧化剂,测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:
(2)、配制下列三种不同浓度的标准Na2CO3溶液,最合适的是____ (填字母)。A、5.000 mo/L B、0.5000 mol/L C、0.0500 mol/L(3)、Ⅱ.氧化还原滴定--------葡萄酒中抗氧化剂残留量的测定。葡萄酒常用Na2S2O5作抗氧化剂,测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:已知:实验中加入盐酸的目的是将Na2S2O5全部转化成SO2。
实验达到滴定终点的标志是。
(4)、实验中消耗标准I2溶液25.00 mL,则所测样品中抗氧化剂的残留量(以游离SO2计算)为g/L。(5)、下列操作会导致测定结果偏高的是____(填字母)。A、滴定持续时间稍长,溶液中部分HI被空气氧化 B、滴定前平视,滴定后俯视 C、盛装标准I2溶液的滴定管用蒸馏水洗净后未润洗 D、滴定前滴定管尖嘴有气泡,滴定后气泡消失(6)、Ⅲ.沉淀滴定-------滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。参考下表数据,若用AgNO3 , 滴定NaSCN溶液,可选用的指示剂是____(填字母)
难溶物
AgCl
AgBr
AgCN
Ag2CrO4
AgSCN
颜色
白
浅黄
白
砖红
白
Ksp
1.77×10-10
5.35×10-13
1.211×10-16
1.12×10-12
1.0×10-12
A、NaCl B、NaBr C、NaCN D、Na2CrO420. 电化学原理在能量转换、物质合成等方面应用广泛。回答下列问题:(1)、我国科学家发明了一种Zn-PbO2 , 电池、电解质为K2SO4、H2SO4和KOH。由a和b两种离子交换膜隔开,形成A、B、C三个电解质溶液区域,结构示意图如图1所示:
图1
①电池中,Zn为极(填“正”或“负"), PbO2电极的电极反应为
②B区域的电解质为(填“K2SO4”、“H2SO4”或 “KOH”);阳离子交换膜为图中的膜(填“a”或“b”)。
③此电池维持电流强度0.5A(相当于每秒通过5x10-6mol电子),连续工作80分钟即接近失效。如果制造该电池所需的锌粉为6g,则电池失效时仍有 %的金属锌未参加反应。
(2)、双极膜( BP)是一种能将水分子解离为H+和OH-的特殊离子交换膜。应用双极膜制取聚硫酸铁净水剂[ Fe2(OH)n(SO4)3-0.5n]m(PFS)的电化学装置如图2所示。
①图中装置为 (填“原电池"或“电解池),a、b均为石墨电极,b极的电极反应式为。
②M为 (填“阴高子/或“阳离子”)交换膜。
21. 一碳化学是指以分子中只含一个碳原子的化合物如CO、CO2、 CH4、CH3OH等为原料,用化工方法制造产品的化学体系的总称,其主要目的是用较少的碳原料生成较多的燃料。(1)、如图是碳和水蒸气发生反应生成CO、H2的途径和三个状态的能量,该反应为吸热反应,则E1、E2、E3由大到小的顺序为。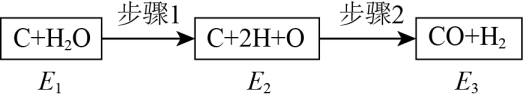 (2)、以CH3OH和CO为原料合成CH3COOH涉及的主反应和部分副反应如下:
(2)、以CH3OH和CO为原料合成CH3COOH涉及的主反应和部分副反应如下:CH3OH(g) +CO(g)= CH3COOH(g) △H1
CH3OH(g) +CO(g) +2H2(g)=CH3CH2OH(g) +H2O(g) △H2
又知乙醇氧化为乙酸的反应为:CH3CH2OH(g) +O2 (g)= CH3COOH(g) +H2O(g) △H3
则2H2 (g) +O2(g)= 2H2O(g) △H = (用△H1、△H2、△H3表示)。
(3)、CH3OH(g)和NH3(g)在一定条件下反应可制得甲胺CH3NH2(g):CH3OH(g) + NH3(g)CH3NH2 (g) +H2O(g) △H = -12kJ/mol。在某恒容密闭容器中进行该反应,其他条件不变的情况下,分别测得起始时CH3 OH( g)的物质的量和温度(T )对平衡时CH3NH2(g)的体积分数的影响如图所示。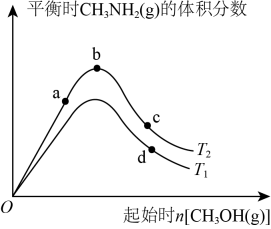
①据图分析T1T2(填“>”、“<”或“=”);
②图中(填“a”、“ b”或“c”)点对应的平衡状态中反应物NH3(g)的转化率最大。
(4)、甲醇在工业上可利用水煤气来合成:。将1mol CO和2mol H2通入密闭容器中进行反应,在一定温度和压强下达到平衡时甲醇的体积分数 (CH3OH)变化趋势如图所示。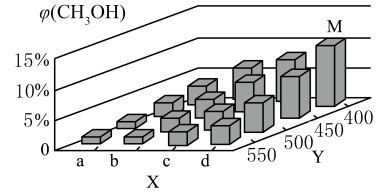
①下列不能判断该反应达到化学平衡状态的是(填字母)。
A.体系中气体的总质量保持不变
B.CO的消耗速率与CH3OH的消耗速率相等、
C.体系中CO的转化率和H2的转化率相等
D.体系中CH3OH的体积分数保持不变
②X轴上a点的数值比b点(填“大”或“小”)。图中Y轴表示的外界条件为 , 判断的理由是
③在M点所处的温度(T3℃)和压强(p0 kPa)下,反应经20 min达到平衡时 (CH3OH) =10% ,该温度下反应的平衡常数Kp =kPa-2(用平衡分压代替平衡浓度计算,分压=总压x物质的量分数)。