陕西省安康市2021-2022学年高二上学期期末考试化学试题
试卷更新日期:2022-10-20 类型:期末考试
一、单选题
-
1. 化学与生产、生活密切相关,下列说法正确的是( )A、牙膏中添加氟化物可预防龋齿 B、沼气的主要成分为甲烷,沼气属于不可再生资源 C、葡萄酒中添加适量二氧化硫,可以起到抗氧化和漂白的作用 D、氢氧化镁和碳酸钠可用作胃酸的中和剂2. 下列化学用语或图示表达正确的是( )A、火碱的化学式:NaOH B、异戊烷的分子模型:
 C、乙醇的分子式:CH3CH2OH
D、次氯酸的结构式:H—Cl—O
3. 下列方程式书写正确的是( )A、CO+2H2OH2CO3+2OH- B、NH4NO3NH+NO C、HF+H2OH3O++F- D、BaSO4(s)=Ba2+(aq)+SO(aq)4. 向盛有生石灰的试管中滴加适量的水时(如图所示,装置气密性良好),下列说法正确的是( )
C、乙醇的分子式:CH3CH2OH
D、次氯酸的结构式:H—Cl—O
3. 下列方程式书写正确的是( )A、CO+2H2OH2CO3+2OH- B、NH4NO3NH+NO C、HF+H2OH3O++F- D、BaSO4(s)=Ba2+(aq)+SO(aq)4. 向盛有生石灰的试管中滴加适量的水时(如图所示,装置气密性良好),下列说法正确的是( ) A、该反应为吸热反应 B、液面a上升,液面b下降 C、该反应生成物的总能量低于反应物的总能量 D、该反应将热能转化为化学能5. 类推是学习化学的一种重要方法,下列类推正确的是( )A、常温下,可用玻璃瓶盛装盐酸,所以也可用玻璃瓶盛装氢氟酸 B、锌在常温下以固态的形式存在,所以金属在常温下均以固态的形式存在 C、铁投入硫酸铜溶液中可置换出铜,所以钠投入硫酸铜溶液中也可置换出铜 D、点燃氢气之前要验纯,所以点燃可燃性气体之前都要验纯6. 一定条件下,在恒容密闭容器中发生反应 , 达到平衡前的反应速率分别用表示,下列关系式正确的是( )A、 B、 C、 D、7. 下列指定反应的离子方程式书写错误的是( )A、往100mL0.1mol·L-1NH4HCO3溶液中加入100mL0.1mol·L-1Ba(OH)2溶液,使其充分反应:NH+HCO+Ba2++2OH-=BaCO3↓+NH3·H2O+H2O B、碳酸钠与过量的醋酸溶液反应:CO+2CH3COOH=2CH3COO-+H2O+CO2↑ C、向Al2(SO4)3溶液中加入足量氨水:Al3++4NH3·H2O=AlO+4NH+2H2O D、过量的Cu与FeCl3溶液的反应:Cu+2Fe3+=Cu2++2Fe2+8. 室温下,将浓度为0.1的CH3COOH溶液不断加水稀释(忽略溶液温度的变化),下列各量始终保持增大的是( )A、 B、 C、 D、9. 关于物质的分类,下列组合正确的是( )
A、该反应为吸热反应 B、液面a上升,液面b下降 C、该反应生成物的总能量低于反应物的总能量 D、该反应将热能转化为化学能5. 类推是学习化学的一种重要方法,下列类推正确的是( )A、常温下,可用玻璃瓶盛装盐酸,所以也可用玻璃瓶盛装氢氟酸 B、锌在常温下以固态的形式存在,所以金属在常温下均以固态的形式存在 C、铁投入硫酸铜溶液中可置换出铜,所以钠投入硫酸铜溶液中也可置换出铜 D、点燃氢气之前要验纯,所以点燃可燃性气体之前都要验纯6. 一定条件下,在恒容密闭容器中发生反应 , 达到平衡前的反应速率分别用表示,下列关系式正确的是( )A、 B、 C、 D、7. 下列指定反应的离子方程式书写错误的是( )A、往100mL0.1mol·L-1NH4HCO3溶液中加入100mL0.1mol·L-1Ba(OH)2溶液,使其充分反应:NH+HCO+Ba2++2OH-=BaCO3↓+NH3·H2O+H2O B、碳酸钠与过量的醋酸溶液反应:CO+2CH3COOH=2CH3COO-+H2O+CO2↑ C、向Al2(SO4)3溶液中加入足量氨水:Al3++4NH3·H2O=AlO+4NH+2H2O D、过量的Cu与FeCl3溶液的反应:Cu+2Fe3+=Cu2++2Fe2+8. 室温下,将浓度为0.1的CH3COOH溶液不断加水稀释(忽略溶液温度的变化),下列各量始终保持增大的是( )A、 B、 C、 D、9. 关于物质的分类,下列组合正确的是( )选项
碱
酸
盐
酸性氧化物
A
Cu2(OH)2CO3
HNO3
KMnO4
SO3
B
NaOH
HF
Na2SiO3
CO2
C
Mg(OH)2
NaHSO4
KIO3
SO2
D
Ca(OH)2
H2SiO3
CaS
NO2
A、A B、B C、C D、D10. 较纯的可用于原电池法生产硫酸(如图所示,电极a、b均为电极,气体已换算成标准状况下),下列说法错误的是( ) A、电池总反应为 B、电极b的反应式为 C、电路中每转移电子,消耗 D、电极a发生氧化反应,得到电子11. 一种麻醉剂的分子结构式如图所示,其中X的原子核中只有1个质子,元素Y、Z、W的原子序数依次增大,且均位于X的下一周期;元素E的原子比元素W的原子多8个电子。下列说法正确的是( )
A、电池总反应为 B、电极b的反应式为 C、电路中每转移电子,消耗 D、电极a发生氧化反应,得到电子11. 一种麻醉剂的分子结构式如图所示,其中X的原子核中只有1个质子,元素Y、Z、W的原子序数依次增大,且均位于X的下一周期;元素E的原子比元素W的原子多8个电子。下列说法正确的是( ) A、该分子中所有原子均满足8电子结构 B、Y与E形成的化合物YE4是一种比水轻的油状液体 C、单质W2与化合物X2Z反应可得到单质Z2 D、简单离子半径:E>W>Z>X12. 绿原酸是金银花的抗菌、抗病毒有效药理成分之一,其结构如图所示。下列说法正确的是( )
A、该分子中所有原子均满足8电子结构 B、Y与E形成的化合物YE4是一种比水轻的油状液体 C、单质W2与化合物X2Z反应可得到单质Z2 D、简单离子半径:E>W>Z>X12. 绿原酸是金银花的抗菌、抗病毒有效药理成分之一,其结构如图所示。下列说法正确的是( ) A、M可发生酯化、加聚、水解、氧化反应 B、M属于烃类化合物 C、M中有3种不同的官能团 D、足量的M与溶液完全反应,可得到13. 一定条件下进行反应。达到平衡后,时刻改变某一反应条件所得图像如图,则改变的条件为( )
A、M可发生酯化、加聚、水解、氧化反应 B、M属于烃类化合物 C、M中有3种不同的官能团 D、足量的M与溶液完全反应,可得到13. 一定条件下进行反应。达到平衡后,时刻改变某一反应条件所得图像如图,则改变的条件为( )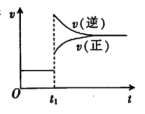 A、增大压强 B、升高温度 C、加催化剂 D、增大生成物浓度14. 二氧化氯(ClO2)是一种优良的消毒剂,可用氯酸钠和过氧化氢在酸性条件下制备,发生反应的化学方程式为2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+2H2O+O2↑。下列说法正确的是( )A、每消耗0.2molNaClO3 , 生成的O2的体积为2.24L B、该反应的离子方程式为2+H2O2+2H+=2ClO2↑+2H2O+O2↑ C、该反应中氧化产物与还原产物的物质的量之比为2:1 D、每生成0.2molClO2 , 同时转移0.4mol电子15. 对于可逆反应 , 同时符合如图各曲线,则下列判断正确的是( )
A、增大压强 B、升高温度 C、加催化剂 D、增大生成物浓度14. 二氧化氯(ClO2)是一种优良的消毒剂,可用氯酸钠和过氧化氢在酸性条件下制备,发生反应的化学方程式为2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+2H2O+O2↑。下列说法正确的是( )A、每消耗0.2molNaClO3 , 生成的O2的体积为2.24L B、该反应的离子方程式为2+H2O2+2H+=2ClO2↑+2H2O+O2↑ C、该反应中氧化产物与还原产物的物质的量之比为2:1 D、每生成0.2molClO2 , 同时转移0.4mol电子15. 对于可逆反应 , 同时符合如图各曲线,则下列判断正确的是( ) A、 , , B、 , , C、 , , D、 , ,16. 利用电解法将CO2转化为CH4的原理如图所示(两电极均为惰性电极且完全相同),下列说法正确的是( )
A、 , , B、 , , C、 , , D、 , ,16. 利用电解法将CO2转化为CH4的原理如图所示(两电极均为惰性电极且完全相同),下列说法正确的是( ) A、电极a上的反应为 B、电池工作一段时间后,左侧Na2SO4溶液浓度降低 C、电解过程中化学能转化为电能 D、每转移1 mol电子,此时生成的O2和CH4的质量比为4:117. 室温下,下列各组离子在指定环境中一定能大量共存的是( )A、含有少量SO2的溶液中:K+、Ba2+、OH-、ClO- B、0.1mol·L-1的CuSO4溶液中:Na+、H+、Cl-、 C、中性溶液中:Al3+、Mg2+、S2-、 D、=1.0×10-12mol·L-1的溶液中: 、Ca2+、CH3COO-、18. 向两个完全相同的恒容密闭容器中各加入0.048g镁,然后用注射器向上述两个密闭容器中分别注入2mL2mol·L-1盐酸、2mL2mol·L-1醋酸,测得上述密闭容器内气体的压强随时间的变化如图所示,下列说法正确的是( )
A、电极a上的反应为 B、电池工作一段时间后,左侧Na2SO4溶液浓度降低 C、电解过程中化学能转化为电能 D、每转移1 mol电子,此时生成的O2和CH4的质量比为4:117. 室温下,下列各组离子在指定环境中一定能大量共存的是( )A、含有少量SO2的溶液中:K+、Ba2+、OH-、ClO- B、0.1mol·L-1的CuSO4溶液中:Na+、H+、Cl-、 C、中性溶液中:Al3+、Mg2+、S2-、 D、=1.0×10-12mol·L-1的溶液中: 、Ca2+、CH3COO-、18. 向两个完全相同的恒容密闭容器中各加入0.048g镁,然后用注射器向上述两个密闭容器中分别注入2mL2mol·L-1盐酸、2mL2mol·L-1醋酸,测得上述密闭容器内气体的压强随时间的变化如图所示,下列说法正确的是( ) A、两个反应的反应速率除了与酸的强弱有关外,还与反应过程中产生的热量有关 B、曲线a为醋酸与镁反应的变化曲线 C、相同时间段内,盐酸生成的气体更少 D、两个反应均为吸热反应19. 下列图示与对应的叙述不相符的是( )
A、两个反应的反应速率除了与酸的强弱有关外,还与反应过程中产生的热量有关 B、曲线a为醋酸与镁反应的变化曲线 C、相同时间段内,盐酸生成的气体更少 D、两个反应均为吸热反应19. 下列图示与对应的叙述不相符的是( )A
B
C
D




铁件镀银
由褪色快慢研究反应物浓度对反应速率的影响
氮气与氧气反应生成一氧化氮的能量变化
蒸干硫酸铝溶液制无水硫酸铝固体
A、A B、B C、C D、D20. 室温下,用0.1mol·L-1的NaOH溶液滴定25mL0.1mol·L-1H2C2O4(草酸)溶液的滴定曲线如图所示[已知:Ka1(H2C2O4)=5×10-2 , Ka2(H2C2O4)=2×10-4 , 忽略溶液混合时体积和温度的变化,lg2=0.3,lg3=0.5,电离度=×100%]。下列说法正确的是( ) A、a点溶液中,0.1mol·L-1的H2C2O4溶液的电离度为50% B、b点溶液中各离子浓度大小关系为c(Na+)>c(HC2O)>c(OH-)>c(H+)>c(C2O) C、c点溶液中一定存在c(OH-)-c(H+)<c(HC2O)+c(H2C2O4) D、d的值为8.9
A、a点溶液中,0.1mol·L-1的H2C2O4溶液的电离度为50% B、b点溶液中各离子浓度大小关系为c(Na+)>c(HC2O)>c(OH-)>c(H+)>c(C2O) C、c点溶液中一定存在c(OH-)-c(H+)<c(HC2O)+c(H2C2O4) D、d的值为8.9二、综合题
-
21. 合理利用工厂烟灰,变废为宝,对保护环境具有重要意义。以某钢铁厂烟灰(主要成分为ZnO,并含少量的CuO、MnO2、Fe2O3)为原料制备氧化锌的工艺流程如下:

已知:①“浸取”时,ZnO转化为配离子,CuO转化为配离子;
②常温下, , , 。
回答下列问题:
(1)、为了提高浸取率,可采用的措施有。(填一种即可)。(2)、“滤渣①”的主要成分为。(3)、若“滤渣①”用稀盐酸处理,反应的离子方程式为 , 向反应后的溶液中加入(填化学式)溶液,可观察到溶液由黄色变为红色。(4)、写出碱式碳酸锌转化为ZnO的化学方程式:。(5)、“浸取”时加入的NH4HCO3溶液显(填“酸性”、“碱性”或“中性”),判断的理由是(写出具体的计算过程)。22. 生活中常用一定浓度的过氧乙酸(CH3COOOH)溶液作消毒液。某化学小组对过氧乙酸的制备和性质进行如图探究(夹持、加热及搅拌装置均未画出)。 (1)、Ⅰ.在磁力搅拌作用下,向仪器b中加入一定量的冰醋酸和浓硫酸,打开开关K,缓缓滴入适量30%的H2O2溶液,控制温度在20~30℃。
(1)、Ⅰ.在磁力搅拌作用下,向仪器b中加入一定量的冰醋酸和浓硫酸,打开开关K,缓缓滴入适量30%的H2O2溶液,控制温度在20~30℃。已知:过氧乙酸的氧化性强于高锰酸钾的。
仪器b的名称为冰醋酸和。
(2)、仪器a与分液漏斗相比,其优点是。(3)、控制温度在20~30℃的目的是。(4)、Ⅱ.过氧乙酸样品中常含有残留的H2O2。样品中过氧乙酸的浓度为c0mol·L-1时,发生如下反应:CH3COOOH+2I-+2H+=CH3COOH+I2+H2O;
②H2O2+2I-+2H+=I2+2H2O;
③2S2O+I2=2I-+S2O。
ⅰ.取V0mL待测液并用硫酸酸化,再用c1mol·L-1的KMnO4标准溶液滴定待测液至溶液呈粉红色,消耗V1mLKMnO4标准溶液。
ⅱ.另取V2mL(V2≠V0)待测液,加入过量的KI溶液和几滴淀粉,并用硫酸酸化,再用c2mol·L-1的Na2S2O3标准溶液滴定,达到滴定终点时消耗V3mLNa2S2O3标准溶液。
ⅰ.中发生反应的离子方程式为。
ⅱ.中用Na2S2O3标准溶液进行滴定时,达到滴定终点的标志是 , 过氧乙酸的浓度c0mol·L-1=mol·L-1(用含V0、c1、V1、c2、V2、V3的代数式表示)。
(5)、当其他操作均正确时,下列实验操作可能使测定结果偏高的是____(填标号)。A、配制Na2S2O3标准溶液时,容量瓶中还有少量的水 B、盛装Na2S2O3标准溶液的滴定管没有用标准液润洗 C、用Na2S2O3标准溶液滴定完成后,俯视滴定管读数 D、用Na2S2O3标准溶液滴定的过程中振荡锥形瓶的时间过长23.(1)、Ⅰ.我国是世界氯碱工业大国,氯碱工业即采用电解饱和食盐水的方法来制备工业原料、、NaOH,它广泛应用于轻工业、纺织工业、冶金工业、石油化学工业以及公用事业。其电解装置原理图如图1。
n为直流电源的(填“正”或“负”)极,电极D附近的pH(填“增大”、“减小”或“不变”);离子交换膜a为(填“阴”或“阳”)离子交换膜。
(2)、写出该电解装置的总反应方程式:。(3)、Ⅱ.一次化学实验课上,某兴趣小组组装了电化学装置(如图2),其中A、B、C、D、E、F均为石墨电极,U形管中为滴有几滴酚酞的溶液,甲、乙烧杯中溶质电离出的离子均是、、、中的某两种,通电后甲、乙两烧杯中溶液pH随时间变化的曲线如图3所示,已知通电一段时间后,F极产生的气体体积比A极产生的少1.12L(标准状况下)。
甲、乙两烧杯中溶液的溶质分别为、。(填化学式)
(4)、F极上的电极反应式为。(5)、①U形管中溶液先变红的一极为(填“C”或“D”)极。②若要将U形管中的溶液恢复到电解前的状态,应加入mol的(填物质名称)。
24. CH4—CO2重整技术是实现碳中和的一种CO2利用技术,具有广阔的市场前景、经济效应和社会意义。该过程中涉及的反应如下:主反应:CH4(g)+CO2(g)2CO(g)+2H2(g) △H1=+247.4kJ·mol-1
副反应:CO2(g)+H2(g)CO(g)+H2O(g) △H2
回答下列问题:
(1)、已知:CH4(g)、CO(g)和H2(g)的燃烧热(△H)分别为-890.3kJ·mol-1、-283.0kJ·mol-1、-285.8kJ·mol-1 , H2O(l)=H2O(g) △H=+44kJ·mol-1。该副反应的△H2=kJ·mol-1。(2)、 ____(填标号)有利于提高主反应中CO2的平衡转化率。A、高温低压 B、低温高压 C、低温低压(3)、800℃,在容积为10L的恒容密闭容器中充入1molCO2和1molCH4发生上述反应,4min后,反应达到平衡,此时测得反应前后总压强之比为 , H2的物质的量为1.75mol。①反应达到平衡时:v(CO2)=mol·L-1·min-1 , CH4的平衡转化率为%,c(CO)=mol·L-1。
②副反应的平衡常数K=(保留三位有效数字)。
③下列说法正确的是(填标号)。
A.当混合气体的密度不再随时间变化时,上述反应达到平衡
B.上述反应达到平衡后,保持其他条件不变,向该容器中充入少量稀有气体,主、副反应的反应速率均不改变
C.当H2O(g)的物质的量浓度不再随时间变化时,上述反应达到平衡