辽宁省沈阳市五校协作体2021-2022学年高二上学期期末联考化学试题
试卷更新日期:2022-10-20 类型:期末考试
一、单选题
-
1. 下列说法中错误的是( )A、硫难溶于水,微溶于酒精,易溶于 , 说明分子极性: B、有的金属和非金属融合制成的合金延展性变差可以用电子气理论解释 C、乳酸[]分子中只存在1个手性碳原子 D、是含非极性键的极性分子2. 能符合题意表示下列变化的离子方程式是( )A、用银作电极电解稀盐酸: B、在水溶液中的水解方程式: C、方铅矿(PbS)遇溶液生成铜蓝(CuS): D、泡沫灭火器原理:3. 关于如图所示各装置的叙述中,正确的是( )
 A、图1是原电池,总反应是: B、图2可验证铁的吸氧腐蚀,负极反应式为: C、图3装置可在待镀铁件表面镀铜 D、装置④中钢闸门应与外接电源的负极相连被保护,该方法叫做牺牲阳极法4. 在如图装置中,观察到图1装置铜电极上产生大量无色气泡,而图2装置中铜电极上无气泡产生,铬电极上产生大量有色气泡。下列叙述错误的是( )
A、图1是原电池,总反应是: B、图2可验证铁的吸氧腐蚀,负极反应式为: C、图3装置可在待镀铁件表面镀铜 D、装置④中钢闸门应与外接电源的负极相连被保护,该方法叫做牺牲阳极法4. 在如图装置中,观察到图1装置铜电极上产生大量无色气泡,而图2装置中铜电极上无气泡产生,铬电极上产生大量有色气泡。下列叙述错误的是( ) A、图1装置中Cu电极上电极反应式是2H++2e-=H2↑ B、图2装置中Cu电极上发生的电极反应为Cu-2e-=Cu2+ C、图2装置中Cr电极上电极反应式为+e-+2H+=NO2↑+H2O D、两个装置中,电子均由Cr电极经导线流向Cu电极5. 下列各组离子在指定溶液中一定能大量共存的是( )A、明矾溶液中:、、、 B、不能使酚酞变色的溶液中:、、、 C、的溶液中:、、、 D、水电离出来的的溶液中:、、、6. HCOOH燃料电池的装置如图,两电极间用阳离子交换膜隔开。下列说法正确的是( )
A、图1装置中Cu电极上电极反应式是2H++2e-=H2↑ B、图2装置中Cu电极上发生的电极反应为Cu-2e-=Cu2+ C、图2装置中Cr电极上电极反应式为+e-+2H+=NO2↑+H2O D、两个装置中,电子均由Cr电极经导线流向Cu电极5. 下列各组离子在指定溶液中一定能大量共存的是( )A、明矾溶液中:、、、 B、不能使酚酞变色的溶液中:、、、 C、的溶液中:、、、 D、水电离出来的的溶液中:、、、6. HCOOH燃料电池的装置如图,两电极间用阳离子交换膜隔开。下列说法正确的是( ) A、电池工作时,电子由a电极经外电路流向b电极 B、负极的电极反应式为 C、若X为 , 通入发生的反应为 D、理论上每消耗标准状况下22.4 L , 有2 mol 通过阳离子交换膜7. NA为阿伏加德罗常数的值。下列叙述正确的是( )A、标准状况下,22.4 L HF含有的原子数为2 NA B、32 g 中含硫硫单键键数为8 NA C、0.5 mol 通入足量的溶液中,最后溶液中含数目为NA D、0.1 mol/L的溶液显中性,1 L该溶液中含阴离子数小于0.1 NA8. 下列说法正确的是( )A、相同温度下,AgCl在相同物质的量浓度的和NaCl溶液中的溶解度、溶度积常数均相同 B、常温下,同浓度的盐酸和醋酸稀释相同倍数后,盐酸的pH大于醋酸 C、甲、乙两溶液都是强电解质,已知甲溶液的pH是乙溶液pH的两倍,则甲、乙两溶液等体积混合,混合液pH可能等于7 D、常温下,向、的饱和溶液中加入少量固体,溶液中减小9. 某锂离子电池的总反应为:。某小组以该电池为电源电解处理含废水和含、的酸性废水,并分别获得溶液和单质镍。电解处理的工作原理如图所示[为锂离子电池的电解质]。下列说法错误的是( )
A、电池工作时,电子由a电极经外电路流向b电极 B、负极的电极反应式为 C、若X为 , 通入发生的反应为 D、理论上每消耗标准状况下22.4 L , 有2 mol 通过阳离子交换膜7. NA为阿伏加德罗常数的值。下列叙述正确的是( )A、标准状况下,22.4 L HF含有的原子数为2 NA B、32 g 中含硫硫单键键数为8 NA C、0.5 mol 通入足量的溶液中,最后溶液中含数目为NA D、0.1 mol/L的溶液显中性,1 L该溶液中含阴离子数小于0.1 NA8. 下列说法正确的是( )A、相同温度下,AgCl在相同物质的量浓度的和NaCl溶液中的溶解度、溶度积常数均相同 B、常温下,同浓度的盐酸和醋酸稀释相同倍数后,盐酸的pH大于醋酸 C、甲、乙两溶液都是强电解质,已知甲溶液的pH是乙溶液pH的两倍,则甲、乙两溶液等体积混合,混合液pH可能等于7 D、常温下,向、的饱和溶液中加入少量固体,溶液中减小9. 某锂离子电池的总反应为:。某小组以该电池为电源电解处理含废水和含、的酸性废水,并分别获得溶液和单质镍。电解处理的工作原理如图所示[为锂离子电池的电解质]。下列说法错误的是( )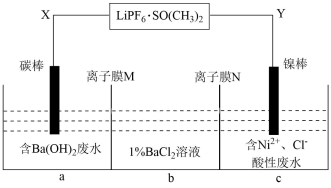 A、Y与锂离子电池的Li电极相连 B、X极反应式为 C、当电路中转移1 mol 时,b室离子数增加2NA个 D、离子膜M为阳离子交换膜,离子膜N为阴离子交换膜10. 常温下,向20 mL的某稀盐酸中滴入0.1 的羟胺溶液,羟胺的电离方程式为:(25℃常温时,)。溶液中由水电离出的氢离子浓度随滴入羟胺溶液体积的变化如图(已知:1g3=0.5),下列分析正确的是( )
A、Y与锂离子电池的Li电极相连 B、X极反应式为 C、当电路中转移1 mol 时,b室离子数增加2NA个 D、离子膜M为阳离子交换膜,离子膜N为阴离子交换膜10. 常温下,向20 mL的某稀盐酸中滴入0.1 的羟胺溶液,羟胺的电离方程式为:(25℃常温时,)。溶液中由水电离出的氢离子浓度随滴入羟胺溶液体积的变化如图(已知:1g3=0.5),下列分析正确的是( )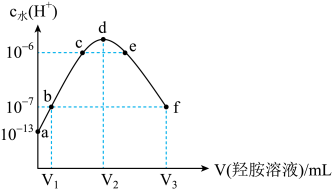 A、0.1 羟胺溶液的pH=8.5 B、c点和e点溶液的pH相同 C、b点对应溶液中存在: D、11. 下列关于物质结构的说法错误的是( )A、的空间结构为四面体形 B、基态氮原子有7种能量不同的电子,电子有5种空间运动状态 C、熔点: D、甲醛(HCHO)和光气()分子中的键角12. 25℃时,用1.00 的NaOH溶液滴定100 mL某二元弱酸 , 滴定过程中溶液的pH及、及的物质的量浓度变化如图所示,下列说法正确的是( )
A、0.1 羟胺溶液的pH=8.5 B、c点和e点溶液的pH相同 C、b点对应溶液中存在: D、11. 下列关于物质结构的说法错误的是( )A、的空间结构为四面体形 B、基态氮原子有7种能量不同的电子,电子有5种空间运动状态 C、熔点: D、甲醛(HCHO)和光气()分子中的键角12. 25℃时,用1.00 的NaOH溶液滴定100 mL某二元弱酸 , 滴定过程中溶液的pH及、及的物质的量浓度变化如图所示,下列说法正确的是( )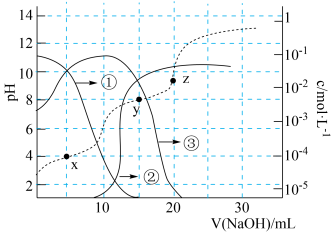 A、的 B、在Y点时, C、Z点的溶液中: D、0.01 NaHA溶液中:13. 室温下,通过下列实验探究0.01000 mo/L 溶液的性质:
A、的 B、在Y点时, C、Z点的溶液中: D、0.01 NaHA溶液中:13. 室温下,通过下列实验探究0.01000 mo/L 溶液的性质:实验1:实验测得0.01000 mol/L 溶液pH为8.6
实验2:向溶液中滴加等体积0.01000 mol/L HCl溶液,pH由8.6降为4.8
实验3:向溶液中加入等体积0.0200 mo/L 溶液,出现白色沉淀
实验4:向稀硫酸酸化的溶液中滴加溶液至溶液褪色
下列说法错误的是( )
A、0.0100 溶液中满足: B、实验2滴加盐酸过程中存在某一点满足: C、实验3所得上层清液中[已知室温时] D、实验4发生反应的离子方程式为:14. 石墨烯是一种由碳原子组成六角形呈蜂巢晶格的二维碳纳米材料(如图甲),石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(如图乙),下列说法错误的是( ) A、图甲和图乙中,1号C的杂化方式都是 B、将50 nm左右的石墨烯或氧化石墨烯溶于水,在相同条件下所得到的分散系后者更为稳定 C、利用超分子的“分子识别”特性可以将和分离开来 D、图甲中,1号C与相邻C形成键的个数为315. 某温度下,分别向体积均为100 mL,浓度均为0.1 的NaCl溶液和溶液中滴加0.1 的溶液,滴加过程中和随加入溶液体积(V)的变化关系如图所示。下列说法错误的是( )
A、图甲和图乙中,1号C的杂化方式都是 B、将50 nm左右的石墨烯或氧化石墨烯溶于水,在相同条件下所得到的分散系后者更为稳定 C、利用超分子的“分子识别”特性可以将和分离开来 D、图甲中,1号C与相邻C形成键的个数为315. 某温度下,分别向体积均为100 mL,浓度均为0.1 的NaCl溶液和溶液中滴加0.1 的溶液,滴加过程中和随加入溶液体积(V)的变化关系如图所示。下列说法错误的是( ) A、该温度下, B、C点溶液中, C、A、B、C三点溶液中大小关系为:B>C>A D、相同实验条件下,若把NaCl溶液改为等浓度的NaBr溶液,反应终点由A点向D点方向移动
A、该温度下, B、C点溶液中, C、A、B、C三点溶液中大小关系为:B>C>A D、相同实验条件下,若把NaCl溶液改为等浓度的NaBr溶液,反应终点由A点向D点方向移动二、综合题
-
16. 滴定法可用于测定样品纯度。(1)、I.双指示剂法测定烧碱样品(含)纯度:
[实验步骤]
a.迅速称取烧碱样品1.2 g,溶解后配制成250 mL溶液,备用:
b.将0.1000 mo/L HCl标准溶液装入酸式滴定管,调零,记录起始读数;
c.用碱式滴定管取20.00 mL样品溶液于锥形瓶中,滴加2滴酚酞;以HCl标准溶液滴定至第一终点(此时溶质为NaCl和),记录酸式滴定管的读数;
d.然后再向锥形瓶内滴加2滴甲基橙,继续用HCl标准溶液滴定至第二终点,记录酸式滴定管的读数。
滴定至第一终点的过程中,发生反应的离子方程式为。
(2)、判断滴定至第二终点的现象是溶液由色变为橙色。(3)、样品中NaOH的质量分数%(计算结果保留小数点后1位)。(4)、下列操作会导致测得的NaOH质量分数偏高的是(填字母序号)。a.滴定前有气泡,滴定至第一终点时气泡消失
b.达到第一终点前,锥形瓶中有气泡产生
c.第一终点后继续滴定时,锥形瓶中有少许液体溅出
d.记录酸式滴定管读数时,仰视标准液液面
(5)、II.测定三草酸合铁酸钾中铁的含量:第一步,称量m g样品于锥形瓶中,溶解后加稀酸化,用 mol/L 溶液滴定至终点,消耗溶液 mL。
第二步,向上述溶液中加入过量锌粉将转化为 , 过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀酸化,用 mol/L 溶液滴定至终点,消耗溶液 mL。
该晶体中铁的质量分数的表达式是。
17. X、Y、Q、Z、W、M、N是原子序数依次增大的前四周期元素,X的核外电子总数与其电子层数相同;Z和M同主族,W的原子序数为Y原子价电子数的3倍;基态N原子d轨道中成对电子与单电子的数目比为4:3。由上述元素中的四种组成的两种化合物常用于合成阻燃材料,其结构简式如图所示。回答下列问题: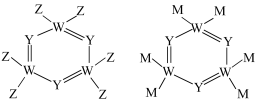 (1)、基态W原子的电子排布式为 , 其中电子占据最高能级的电子云轮廓图为形,基态W原子中自旋方向相反的两类电子数目相差 , 第三周期中第一电离能介于镁与磷元素之间的元素是。(2)、Q原子价电子层上的电子可以进行重排以便提供一个空轨道与Y原子形成配位键,该原子重排后的价电子排布图为 , 电子重排后的原子能量有所升高,原因是不符合(填“泡利原理”或“洪特规则”)。(3)、W、M形成的一种化合物以的形式存在,其中的空间结构为;中心原子的价层电子对数为 , 下列对中心原子杂化方式推断合理的是(填标号)。
(1)、基态W原子的电子排布式为 , 其中电子占据最高能级的电子云轮廓图为形,基态W原子中自旋方向相反的两类电子数目相差 , 第三周期中第一电离能介于镁与磷元素之间的元素是。(2)、Q原子价电子层上的电子可以进行重排以便提供一个空轨道与Y原子形成配位键,该原子重排后的价电子排布图为 , 电子重排后的原子能量有所升高,原因是不符合(填“泡利原理”或“洪特规则”)。(3)、W、M形成的一种化合物以的形式存在,其中的空间结构为;中心原子的价层电子对数为 , 下列对中心原子杂化方式推断合理的是(填标号)。a. b. c. d.
(4)、极易溶于水与氢键有关,则的一水合物的结构式为。(5)、能形成配离子为八面体的配合物 , 在该配合物中,位于八面体的中心。若含0.5 mol该配合物的溶液与足量溶液反应可生成71.75 g白色沉淀,则该配离子的化学式为。(6)、磷化硼晶体的晶胞如图a所示。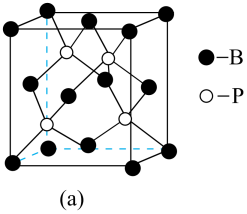
①在BP晶胞中健角为。
②磷化硼(BP)晶体中“一般共价键”与配位健的数目之比为。
③根据图(a),图(b)中矩形是沿晶胞对角面取得的截图。晶胞中各原子在矩形的位置为(填标号)。

A.
 B.
B.
C.
 D.
D.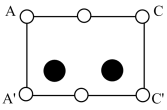
④若最近的B和P的距离为a pm,阿伏加德罗常数的值为NA , 晶体的密度为(列出计算表达式,不要化简)。
18. 磷酸二氢钾()是一种大型非线性光学晶体,在未来能源领域——“人造太阳”计划中有重要作用,以氯磷灰石(主要成分为 , 还含有少量、等杂质)为原料制备的一种工艺流程如图所示: (1)、已知“酸浸”时发生反应的化学方程式为 , 该反应体现了浓硫酸的性和性。(2)、如果将原料改为氟磷灰石,则“酸浸”时不能使用玻璃容器,原因是。(3)、常温下磷酸的电离平衡常数、、 , 的电离常数、 , 则常温下水溶液显(填“酸性”或“碱性”或“中性”);将磷酸滴入碳酸钠溶液中反应的离子方程式错误的是。
(1)、已知“酸浸”时发生反应的化学方程式为 , 该反应体现了浓硫酸的性和性。(2)、如果将原料改为氟磷灰石,则“酸浸”时不能使用玻璃容器,原因是。(3)、常温下磷酸的电离平衡常数、、 , 的电离常数、 , 则常温下水溶液显(填“酸性”或“碱性”或“中性”);将磷酸滴入碳酸钠溶液中反应的离子方程式错误的是。A.
B.
C.
D.
E.
(4)、可以通过如图所示装置电解制备:
则阴极的电极反应式为。假如通电前a、b两室溶液的质量相等,若有NA个通过交换膜,则两室溶液的质量差为g。
19. 硫化氢(H2S)、二氧化硫(SO2)是有害气体,可用多种方法进行脱除。(1)、H2S和SO2的VSEPR模型分别为、。(2)、实验室制取乙炔时,用硫酸铜溶液除去乙炔气体中混有的H2S气体,发生反应: , 计算25℃时,该反应的平衡常数为。(已知25℃时 , H2S的 , )(3)、通过电化学循环法可将H2S转化为H2SO4和H2(如图所示)。其中氧化过程发生如下两步反应:、。
①电极a上发生反应的电极反应式为。
②理论上1 mol H2S参加反应可产生H2的物质的量为。
(4)、硫酸工业的尾气中含SO2等污染性气体,通常用碱液如氨水进行吸收处理,实现绿色环保和废物利用。研究发现,Na2SO3溶液也可以用来处理废气中的SO2 , 发生反应Na2SO3+H2O+SO2=2NaHSO3。查阅资料可知,常温下,部分弱酸的电离平衡常数如表:
弱酸
HClO
H2CO3
H2SO3
电离平衡常数(25℃)
,
,
①相同物质的量浓度的三种酸溶液HClO、H2CO3和H2SO3由水电离的c(H+)最大的是(填化学式)
②将浓度均为0.1 mo/L的NaHSO3和Na2SO3等体积混合,溶液pH=7.2。分析该溶液中离子浓度从大到小依次是。
③根据表内数据,计算0.06 mol/L Na2SO3溶液的pH=(忽略的第二步水解)。
④测得吸收SO2后的NaHSO3和Na2SO3某混合溶液pH=6,进行电解制硫酸并再生Na2SO3原理示意图如图所示。
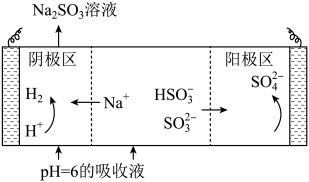
电解时阳极区会产生少量刺激性气体,结合电极方程式分析产生气体的原因是。