广西南宁市普通高中联盟2021-2022学年高二上学期期末联考化学试题
试卷更新日期:2022-10-20 类型:期末考试
一、单选题
-
1. 化学源于生活,化学让生活更加美好。从化学的视角看,下列说法错误的是( )A、广西广泛种植的木薯富含淀粉,淀粉和纤维素都是的天然高分子物质 B、钻石恒久远,一颗永流传。说明碳的这种单质性质比较稳定 C、涪陵榨菜、油醪糟誉满天下。腌制榨菜可以适量地用工业用盐代替食用盐来降低成本 D、北斗导航专用硬件结合国产处理器打造出一颗真正意义的“中国芯”,其主要成分为Si2. 设NA表示阿伏加德罗常数的数值,下列叙述正确的是( )A、7.8g Na2O2晶体中阴、阳离子总数为0.4NA B、标准状况下,11.2 L CCl4中含有原子的数目为2.5 NA C、6g H2 与过量的N2反应生成的NH3 的数目为2NA D、1 mol Cl2与足量铁在加热条件下完全反应,转移电子的数目为2NA3. 常温下,下列各组离子在指定溶液中能大量共存的是( )A、含有大量Fe3+的溶液中:NH、Na+、Cl-、SCN- B、能使石蕊溶液变红的溶液:Na+、Mg2+、Cl-、SO C、无色透明溶液:K+、MnO、SO、NO D、能使酚酞溶液变红的溶液:Al3+、Mg2+、Cl-、CO4. 下列指定反应的离子方程式正确的是( )A、Cl2通入水中制氯水:Cl2+H2O ⇌2H++Cl-+ClO- B、NO2通入水中制硝酸:2NO2+H2O=2H++NO+NO C、用稀盐酸除铁锈:Fe2O3+6H+=2Fe3++3H2O D、NaHCO3溶液与盐酸反应:2H++CO=CO2↑+ H2O5. 宋代著名法医学家宋慈的《洗冤集录》中有关于银针验毒的记载,“银针验毒”的原理是4Ag+2H2S+O2 =2Ag2S+2H2O,下列说法错误的是( )A、还原产物为H2O B、银针验毒时,空气中氧气得到电子 C、反应中Ag和H2S均是还原剂 D、每生成1个Ag2S,反应转移2 个e-6. 据最新报道,科学家最近开发出一种生物活性吸附剂,可以吸附水中大部分的微生物和噬菌体。这种新的吸附剂由成本低廉、利于环保的棉纤维素和主要成分为氢氧化铝的勃姆石制造而成。下列有关说法中错误的是( )A、Al(OH)3既能够与盐酸反应又能够与NaOH溶液反应 B、这种吸附剂也能吸附色素 C、实验室中Al(OH)3可以由可溶性铝盐溶液与足量的氨水反应制得 D、向Al2(SO4)3溶液中加入过量的NaOH溶液也能得到Al(OH)37. 下列关于SO2性质的说法中,错误的是( )A、能与NaOH溶液反应 B、能使品红溶液褪色 C、能与水反应直接生成硫酸 D、能使酸性KMnO4溶液褪色8. 下列有关实验的操作正确的是( )
实验
操作
A
配制稀硫酸
先将浓硫酸加入烧杯中,后倒入蒸馏水
B
排水法收集KMnO4分解产生的O2
先熄灭酒精灯,后移出导管
C
浓盐酸与MnO2反应制备纯净Cl2
气体产物先通过浓硫酸,后通过饱和食盐水
D
CCl4萃取碘水中的I2
先从分液漏斗下口放出有机层,后从上口倒出水层
A、A B、B C、C D、D9. W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数变化如图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。下列说法正确的是( ) A、对应简单离子半径:W<X B、对应气态氢化物的稳定性:Y>Z C、化合物XZW既含离子键,又含极性共价键 D、Z的氢化物和X的最高价氧化物对应水化物的溶液均能与Y的氧化物反应10. 已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )
A、对应简单离子半径:W<X B、对应气态氢化物的稳定性:Y>Z C、化合物XZW既含离子键,又含极性共价键 D、Z的氢化物和X的最高价氧化物对应水化物的溶液均能与Y的氧化物反应10. 已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )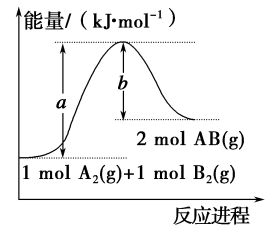 A、该反应有可能是放热反应 B、1 mol A2(g)和1 mol B2(g)反应生成2 mol AB(g)吸收的热量为(a-b) kJ C、该反应中反应物的总能量高于生成物的总能量 D、断裂1 mol A-A和1 mol B-B键,放出a kJ能量11. 如图是以稀硫酸为电解质溶液的原电池装置,下列叙述正确的是( )
A、该反应有可能是放热反应 B、1 mol A2(g)和1 mol B2(g)反应生成2 mol AB(g)吸收的热量为(a-b) kJ C、该反应中反应物的总能量高于生成物的总能量 D、断裂1 mol A-A和1 mol B-B键,放出a kJ能量11. 如图是以稀硫酸为电解质溶液的原电池装置,下列叙述正确的是( )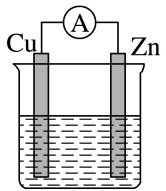 A、电解质溶液中的H+向铜极移动 B、铜片为负极,有气泡,发生还原反应 C、锌片为正极,质量不变,发生氧化反应 D、电子流动方向:锌极→导线→铜极→电解质溶液→锌极12. 在2A+B=3C+4D反应中,表示该反应速率最快的是( )A、v(A)=0.5 mol·L-1·s-1 B、v(B)=0.3 mol·L-1·s-1 C、v(C)=0.8 mol·L-1·s-1 D、v(D)=1 mol·L-1·s-113. 一定条件下,在密闭恒容的容器中,发生反应:3SiCl4(g)+2N2(g)+6H2(g)Si3N4(s)+12HCl(g) ΔH<0,能表示该反应达到平衡状态的是( )A、v逆(N2)=v正(H2) B、v正(HCl)=4v正(SiCl4) C、混合气体密度保持不变 D、c(N2)∶c(H2)∶c(HCl)=1∶3∶614. 下列反应中属于加成反应的是( )A、乙烯使酸性KMnO4溶液褪色 B、将苯滴入碘水中,振荡后分为两层,水层接近无色 C、乙烯使溴水褪色 D、甲烷与氯气混合,光照一段时间后黄绿色消失15. 502是我们日常生活中常用的瞬干胶,其结构简式如图。下列有关该有机物的说法正确的是( )
A、电解质溶液中的H+向铜极移动 B、铜片为负极,有气泡,发生还原反应 C、锌片为正极,质量不变,发生氧化反应 D、电子流动方向:锌极→导线→铜极→电解质溶液→锌极12. 在2A+B=3C+4D反应中,表示该反应速率最快的是( )A、v(A)=0.5 mol·L-1·s-1 B、v(B)=0.3 mol·L-1·s-1 C、v(C)=0.8 mol·L-1·s-1 D、v(D)=1 mol·L-1·s-113. 一定条件下,在密闭恒容的容器中,发生反应:3SiCl4(g)+2N2(g)+6H2(g)Si3N4(s)+12HCl(g) ΔH<0,能表示该反应达到平衡状态的是( )A、v逆(N2)=v正(H2) B、v正(HCl)=4v正(SiCl4) C、混合气体密度保持不变 D、c(N2)∶c(H2)∶c(HCl)=1∶3∶614. 下列反应中属于加成反应的是( )A、乙烯使酸性KMnO4溶液褪色 B、将苯滴入碘水中,振荡后分为两层,水层接近无色 C、乙烯使溴水褪色 D、甲烷与氯气混合,光照一段时间后黄绿色消失15. 502是我们日常生活中常用的瞬干胶,其结构简式如图。下列有关该有机物的说法正确的是( ) A、含有碳碳双键、羧基等官能团 B、可通过加聚反应生成高分子 C、分子式为C6H8O2N D、能使溴水褪色、能和NaHCO3溶液反应发出CO216. 下列变化中,属于吸热反应的是( )
A、含有碳碳双键、羧基等官能团 B、可通过加聚反应生成高分子 C、分子式为C6H8O2N D、能使溴水褪色、能和NaHCO3溶液反应发出CO216. 下列变化中,属于吸热反应的是( )①液态水汽化②将胆矾加热变为白色粉末③浓H2SO4稀释④KClO3分解制O2 ⑤生石灰跟水反应生成熟石灰⑥CaCO3高温分解⑦CO2+C2CO ⑧Ba(OH)2·8H2O与固体NH4Cl混合⑨C+H2O(g) CO+H2⑩Al与盐酸反应
A、①②④⑥⑦⑧⑨ B、②④⑥⑦⑧⑨ C、①③④⑤⑥⑧⑩ D、②④⑧⑨⑩17. 燃烧氢气时耗氧量小,放出热量多,已知4g H2燃烧生成液态水时放出热量为571.6kJ,表示H2燃烧热的热化学方程式为( )A、2H2(g)+O2(g)= 2H2O(l) ∆H=﹣571.6kJ/mol B、2H2(g)+O2(g)= 2H2O(g) ∆H=﹣571.6kJ/mol C、H2(g)+O2(g)= H2O(l) ∆H=﹣285.8 kJ/mol D、H2(g)+O2(g)= H2O(g) ∆H=﹣285.8 kJ/mol18. 实验室测定中和热的实验装置如图所示,下列有关说法正确的是( ) A、烧杯间填满碎泡沫塑料的作用是固定小烧杯 B、缺少的仪器是环形铁质搅拌棒 C、测酸液温度后的温度计要用水清洗后再测碱液的温度 D、向盛装酸的烧杯中加碱时要小心缓慢19. 一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
A、烧杯间填满碎泡沫塑料的作用是固定小烧杯 B、缺少的仪器是环形铁质搅拌棒 C、测酸液温度后的温度计要用水清洗后再测碱液的温度 D、向盛装酸的烧杯中加碱时要小心缓慢19. 一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( ) A、该反应的化学方程式为3B+4D⇌6A+2C B、反应进行到1s时,v(A)=v(D) C、反应进行到6s时,各物质的反应速率相等 D、反应进行到6s时,B的平均反应速率为0.05mol/(L•s)20. 盐酸与块状碳酸钙固体反应时,不能使反应的最初速率明显加快的是( )A、将块状碳酸钙固体换成粉末状固体 B、盐酸的量增加一倍 C、盐酸的用量减半浓度加倍 D、温度升高40℃21. 反应 , 达到平衡时,下列说法正确的是( )A、减小容器体积,平衡向逆向移动 B、加入催化剂,X的质量增大 C、增大 , Y的转化率增大 D、升高温度,Z的体积分数增大22. 如图表示不同温度(T)和压强(p)对可逆反应2L(g)2M(g)+2N(g) ΔH>0的影响,且p1>p2。则图中纵轴表示的意义可能是( )
A、该反应的化学方程式为3B+4D⇌6A+2C B、反应进行到1s时,v(A)=v(D) C、反应进行到6s时,各物质的反应速率相等 D、反应进行到6s时,B的平均反应速率为0.05mol/(L•s)20. 盐酸与块状碳酸钙固体反应时,不能使反应的最初速率明显加快的是( )A、将块状碳酸钙固体换成粉末状固体 B、盐酸的量增加一倍 C、盐酸的用量减半浓度加倍 D、温度升高40℃21. 反应 , 达到平衡时,下列说法正确的是( )A、减小容器体积,平衡向逆向移动 B、加入催化剂,X的质量增大 C、增大 , Y的转化率增大 D、升高温度,Z的体积分数增大22. 如图表示不同温度(T)和压强(p)对可逆反应2L(g)2M(g)+2N(g) ΔH>0的影响,且p1>p2。则图中纵轴表示的意义可能是( )
①一定条件下L的转化率 ②混合气体中M的百分含量
③混合气体中L的百分含量 ④混合气体的平均摩尔质量
A、①③ B、②④ C、①② D、②③23. 在一定体积的密闭容器中,进行反应: , 若其化学平衡常数和温度的关系如表。下列叙述正确的是( )A、 B、该反应的化学平衡常数表达式为: C、若在容器中通和各 , 在800℃下反应,某时刻测得的物质的量为 , 说明该反应已达平衡 D、在1000℃时,反应的平衡常数为24. 下列反应在任何温度下均能自发进行的是( )A、2MgO(s)+C(s)=2Mg(s)+CO2(g) ΔH>0 B、2C(s)+O2(g)=2CO(g) ΔH<0 C、Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH>0 D、2SO2(g)+O2(g)=2SO3(g) ΔH<025. 如图是温度和压强对反应影响的示意图。图中纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( ) A、X、Y、Z均为气态 B、使用催化剂Z的产率提高 C、升高温度时增大,减小,平衡向右移动 D、恒容时,混合气体的密度可作为此反应达到化学平衡状态的判断依据温度26. 下列有机物的系统命名正确的一组是( )A、CH2Br-CH2Br 二溴乙烷 B、
A、X、Y、Z均为气态 B、使用催化剂Z的产率提高 C、升高温度时增大,减小,平衡向右移动 D、恒容时,混合气体的密度可作为此反应达到化学平衡状态的判断依据温度26. 下列有机物的系统命名正确的一组是( )A、CH2Br-CH2Br 二溴乙烷 B、 1,3,4-三甲苯
C、
1,3,4-三甲苯
C、 2-乙基-1-丁烯
D、
2-乙基-1-丁烯
D、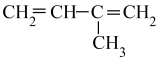 2-甲基-1,3-二丁烯
27. 某有机物A质谱图、核磁共振氢谱图如图,则A的结构简式可能为( )
2-甲基-1,3-二丁烯
27. 某有机物A质谱图、核磁共振氢谱图如图,则A的结构简式可能为( ) A、CH3OCH2CH3 B、CH3CH2OH C、CH3CHO D、CH3CH2CH2COOH28. 下列各组中的两个反应所属反应类型相同的是( )A、光照条件下,甲烷和氯气混合气体颜色变浅;乙烯使溴水褪色 B、乙烯能使溴水褪色;乙烯能使高锰酸钾酸性溶液褪色 C、丁烷在氧气中燃烧;丙烯使酸性高锰酸钾溶液褪色 D、工业上由乙烯和水反应生成乙醇;乙烯在空气中燃烧29. 下列关于苯的叙述正确的是( )
A、CH3OCH2CH3 B、CH3CH2OH C、CH3CHO D、CH3CH2CH2COOH28. 下列各组中的两个反应所属反应类型相同的是( )A、光照条件下,甲烷和氯气混合气体颜色变浅;乙烯使溴水褪色 B、乙烯能使溴水褪色;乙烯能使高锰酸钾酸性溶液褪色 C、丁烷在氧气中燃烧;丙烯使酸性高锰酸钾溶液褪色 D、工业上由乙烯和水反应生成乙醇;乙烯在空气中燃烧29. 下列关于苯的叙述正确的是( ) A、反应①为取代反应,不用催化剂苯也能和溴水发生取代反应 B、反应④中1 mol苯最多与3 mol H2发生加成反应,是因为苯分子含有三个碳碳双键 C、反应③为取代反应,有机产物是一种烃 D、反应②为氧化反应,反应现象是火焰明亮并带有浓烟30. 证明溴乙烷中溴元素的存在,下列操作步骤正确的是( )
A、反应①为取代反应,不用催化剂苯也能和溴水发生取代反应 B、反应④中1 mol苯最多与3 mol H2发生加成反应,是因为苯分子含有三个碳碳双键 C、反应③为取代反应,有机产物是一种烃 D、反应②为氧化反应,反应现象是火焰明亮并带有浓烟30. 证明溴乙烷中溴元素的存在,下列操作步骤正确的是( )①加入硝酸银溶液 ②加入氢氧化钠溶液 ③加热 ④加入稀硝酸至溶液呈酸性
A、① B、②③④① C、②③① D、④③①31. 某有机化合物的分子式为C5H12O,其中能够与Na反应产生H2的同分异构体种数为( )A、8种 B、9种 C、10种 D、11种32. 胡椒酚是植物挥发油中的一种成分,关于胡椒酚有下列说法正确的是( )
①该化合物属于芳香烃
②分子中至少有7个碳原子处于同一平面
③该化合物可以发生取代反应、加成反应、加聚反应、氧化反应
④1 mol该化合物最多可与4 mol Br2发生加成反应
A、①③ B、①②④ C、②③ D、②③④33. 已知柠檬醛的结构简式为 ,根据所学知识判断下列说法错误的是( ) A、能发生银镜反应 B、它可使酸性高锰酸钾溶液褪色 C、1mol柠檬醛最多可与2molH2发生加成反应 D、能发生还原反应34. NM3和D58是正处于临床试验阶段的小分子抗癌药物,结构如图:
,根据所学知识判断下列说法错误的是( ) A、能发生银镜反应 B、它可使酸性高锰酸钾溶液褪色 C、1mol柠檬醛最多可与2molH2发生加成反应 D、能发生还原反应34. NM3和D58是正处于临床试验阶段的小分子抗癌药物,结构如图:
关于NM3和D58的叙述,错误的是( )
A、都能与NaOH溶液反应,反应的官能团不完全相同 B、都不能发生消去反应,原因相同 C、都能与溴水反应,反应的官能团不完全相同 D、遇FeCl3溶液都显色,原因相同35. 某可乐瓶标签如图,下列说法正确的是( )营养成分表
项目
每100毫升
营养素参考值%
能量
190千焦
2%
蛋白质
0克
0%
脂肪
0克
0%
-饱和脂肪酸
0克
0%
碳水化合物
11.2克
4%
-糖
11.2克
钠
12毫克
1%
A、该可乐中含有能水解成氨基酸的营养物质 B、该可乐不含脂肪,随便喝不会变肥 C、其中的碳水化合物通常就是指糖类,糖类都有甜味 D、该可乐瓶的材料是聚对苯二甲酸乙二醇酯(PET)是采用缩聚反应生产二、综合题
-
36. 某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明Cl2的某些性质。甲同学设计了如图所示的实验装置(部分支撑用的铁架台省略)。

按要求回答下列问题。
(1)、浓盐酸与足量的MnO2反应制取Cl2的化学反应方程式为:。若用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制取Cl2 , 制得的Cl2体积总是小于1.12 L(标准状况)的原因是HCl挥发或者。(2)、①装置B中盛放的试剂名称为 , 作用是 , 现象是。②装置D和E中出现的不同现象说明的问题是。
③装置F的作用是。
④写出装置G中发生反应的离子方程式。
(3)、乙同学认为甲同学设计的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液中的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在F与之间(填装置字母序号),装置中应放入(填试剂或用品名称)。37. 海洋化学资源的综合利用对人类的发展意义重大。例如从干海带中提取粗碘的流程如图: (1)、灼烧干海带的目的是:。(2)、用沸水的目的是:;操作X是;(3)、写出加入过氧化氢后的反应的离子方程式 , 也可以改通入氯气,反应的离子方程式。(4)、操作Y用到的玻璃仪器有烧杯、。(5)、实验室常用Na2S2O3溶液滴定碘水,碘水褪色同时生成Na2S4O6 , 请写出反应的离子方程式。38. 以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。(1)、已知: 2C(s) + O2(g) = 2CO(g) ∆H1= a kJ/mol
(1)、灼烧干海带的目的是:。(2)、用沸水的目的是:;操作X是;(3)、写出加入过氧化氢后的反应的离子方程式 , 也可以改通入氯气,反应的离子方程式。(4)、操作Y用到的玻璃仪器有烧杯、。(5)、实验室常用Na2S2O3溶液滴定碘水,碘水褪色同时生成Na2S4O6 , 请写出反应的离子方程式。38. 以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。(1)、已知: 2C(s) + O2(g) = 2CO(g) ∆H1= a kJ/molN2(g) + O2(g) = 2NO(g) ∆H2= b kJ/mol
2NO(g) + 2CO(g) =2CO2(g) + N2(g) ∆H3= c kJ/mol
则 2NO(g) + C(s) = CO2(g) + N2(g) ∆H=kJ/mol
(2)、NO和CO均为汽车尾气的成分,在催化转换器中二者可发生反应减少尾气污染。已知2NO(g)+2CO(g)N2(g)+2CO2(g) ∆H<0。
①在500℃时,向恒容密闭体系中通入1mol的NO和1mol的CO进行反应时,下列描述能说明反应达到平衡状态的是。
A.(CO)正 = 2(N2)逆
B.体系中混合气体密度不变
C.混合气体的平均相对分子质量不变
D.体系中NO、CO的浓度相等
E.单位时间内消耗nmol的NO同时消耗nmol的N2
②向1L密闭容器中通入1mol的NO和1mol的CO气体,在不同温度下反应达到平衡时,NO的平衡转化率随压强变化曲线如图所示:

T1T2(填“>”、“<”),理由是。M点时混合气体中CO的体积分数为。
③一定温度下,向恒容容器中通入等物质的量的NO和CO气体,测得容器中压强随时间的变化关系如表所示:
t/min
0
1
2
3
4
5
p/kPa
200
185
173
165
160
160
该反应条件下的平衡常数Kp=(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数),该反应中的正=k正·p2(NO)p2(CO),逆=k逆·p(N2)p2(CO2),则该反应达到平衡时,k正k逆(填“>”、“<”或“=”)。
39. 功能高分子I的一种合成路线如图,其中D能与Na反应生成H2 , 且D苯环上的一氯代物有2种。
已知:
回答下列问题:
(1)、A的名称为 , 试剂a为。(2)、C的结构简式为。(3)、F中的官能团名称为。(4)、上述①-⑧的反应中,不属于取代反应的是(填数字编号)。写出反应⑦的化学方程式。(5)、符合下列条件的B的同分异构体有种。①苯环上有氨基(-NH2) ②能发生银镜反应
(6)、参照上述合成路线,以1-丁烯为原料(无机试剂任选),设计制备丙烯酸(CH2=CHCOOH)的合成路线。