广西河池市2021-2022学年高二上学期期末教学质量检测化学试题
试卷更新日期:2022-10-20 类型:期末考试
一、单选题
-
1. 盐类水解在生产生活中有着广泛的作用,下列说法中没有用到盐类水解的是( )A、热的纯碱溶液去油污 B、利用泡沫灭火器灭火 C、配制FeCl2溶液时,常加入少量铁粉 D、FeCl3粉末溶于浓盐酸配制FeCl3溶液2. 下列物质中属于强电解质,但在给定条件下不能导电的是( )A、金属铜 B、乙醇 C、液态氯化氢 D、醋酸3. 已知:H2(g)+F2(g)=2HF(g) ΔH=-270 kJ·mol-1。下列说法错误的是( )
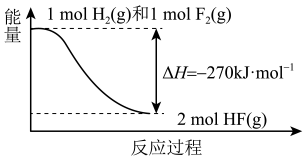 A、1 mol H2(g)与1 mol F2(g)反应生成2 mol液态HF放出的热量大于270 kJ B、在相同条件下,1 mol H2(g)与1 mol F2(g)的能量总和小于2 mol HF(g)的能量 C、该反应的逆反应是吸热反应 D、该反应过程的能量变化可用如图来表示4. 在四个不同的容器中,在不同的条件下进行合成氨反应N2(g) +3H2(g)2NH3(g),根据下列在相同时间内测得的结果判断,生成氨的化学反应速率最快的是( )A、v(NH3)=0.012 mol·L-1·s-1 B、v(H2)=0.3 mol·L-1·min -1 C、v(N2)=0.2 mol·L-1·min -1 D、v(H2)=0.6 mol·L-1·min -15. 下列化学用语表示错误的是( )A、醋酸的电离:CH3COOH CH3COO- +H+ B、硝酸铵的水解:NH+H2O NH3·H2O +OH- C、硫酸氢钠熔融时的电离:NaHSO4=Na++HSO D、碳酸钙的溶解平衡:CaCO3(s) Ca2+ (aq) +CO(aq)6. 常温下,下列各组离子一定能在指定溶液中大量共存的是( )A、pH=2的溶液:Ba2+ 、Fe3+、Cl-、SO B、滴加酚酞变红的溶液:SO、Mg2+ 、K+、NO C、 =1 ×10-12的溶液:K+、Na+、CO、Cl- D、有NO存在的溶液:NH、H+、Fe2+、Br-7. 下列事实不能用勒夏特列原理解释的是( )A、新制的氯水在光照下颜色变浅 B、合成氨时,加催化剂,使和在一定条件下转化为 C、由和组成的平衡体系加压后颜色先变深、后变浅 D、增大压强,有利于与反应生成8. 下列有关实验的说法正确的是( )A、用酸式滴定管或移液管量取25.00mLKMnO4溶液 B、酸碱中和滴定时,滴定管和锥形瓶都需用标准液或待测液润洗 C、用托盘天平称取11. 72gNaCl晶体;用10mL量筒量取7.8mL稀H2SO4 D、用pH试纸测得NaClO溶液的pH=9;用带磨口玻璃塞的试剂瓶保存KOH溶液9. 常温下,在恒容密闭容器中进行合成氨反应N2(g) +3H2(g) 2NH3(g), 下列有关叙述错误的是( )A、减小平衡体系的压强,该反应的平衡常数不变 B、向平衡体系中充入少量D2达到新平衡时,容器中存在H -D键和N-D键 C、在一定温度、压强下,加入催化剂,H2的平衡转化率保持不变 D、0.5mol N2与1.5mol H2在密闭容器中充分反应,放出a kJ的热量,则该反应的ΔH =-2a kJ·mol-110. 如图为锌铜原电池装置图,下列说法错误的是( )
A、1 mol H2(g)与1 mol F2(g)反应生成2 mol液态HF放出的热量大于270 kJ B、在相同条件下,1 mol H2(g)与1 mol F2(g)的能量总和小于2 mol HF(g)的能量 C、该反应的逆反应是吸热反应 D、该反应过程的能量变化可用如图来表示4. 在四个不同的容器中,在不同的条件下进行合成氨反应N2(g) +3H2(g)2NH3(g),根据下列在相同时间内测得的结果判断,生成氨的化学反应速率最快的是( )A、v(NH3)=0.012 mol·L-1·s-1 B、v(H2)=0.3 mol·L-1·min -1 C、v(N2)=0.2 mol·L-1·min -1 D、v(H2)=0.6 mol·L-1·min -15. 下列化学用语表示错误的是( )A、醋酸的电离:CH3COOH CH3COO- +H+ B、硝酸铵的水解:NH+H2O NH3·H2O +OH- C、硫酸氢钠熔融时的电离:NaHSO4=Na++HSO D、碳酸钙的溶解平衡:CaCO3(s) Ca2+ (aq) +CO(aq)6. 常温下,下列各组离子一定能在指定溶液中大量共存的是( )A、pH=2的溶液:Ba2+ 、Fe3+、Cl-、SO B、滴加酚酞变红的溶液:SO、Mg2+ 、K+、NO C、 =1 ×10-12的溶液:K+、Na+、CO、Cl- D、有NO存在的溶液:NH、H+、Fe2+、Br-7. 下列事实不能用勒夏特列原理解释的是( )A、新制的氯水在光照下颜色变浅 B、合成氨时,加催化剂,使和在一定条件下转化为 C、由和组成的平衡体系加压后颜色先变深、后变浅 D、增大压强,有利于与反应生成8. 下列有关实验的说法正确的是( )A、用酸式滴定管或移液管量取25.00mLKMnO4溶液 B、酸碱中和滴定时,滴定管和锥形瓶都需用标准液或待测液润洗 C、用托盘天平称取11. 72gNaCl晶体;用10mL量筒量取7.8mL稀H2SO4 D、用pH试纸测得NaClO溶液的pH=9;用带磨口玻璃塞的试剂瓶保存KOH溶液9. 常温下,在恒容密闭容器中进行合成氨反应N2(g) +3H2(g) 2NH3(g), 下列有关叙述错误的是( )A、减小平衡体系的压强,该反应的平衡常数不变 B、向平衡体系中充入少量D2达到新平衡时,容器中存在H -D键和N-D键 C、在一定温度、压强下,加入催化剂,H2的平衡转化率保持不变 D、0.5mol N2与1.5mol H2在密闭容器中充分反应,放出a kJ的热量,则该反应的ΔH =-2a kJ·mol-110. 如图为锌铜原电池装置图,下列说法错误的是( ) A、电流方向由Cu极流向Zn极 B、若将CuSO4溶液放入A池,ZnSO4溶液放入B池,电流表指针仍能偏转 C、电池工作时,Zn片带正电荷,Cu片带负电荷 D、盐桥中的阴离子移向A池11. 现有室温下四种溶液,下列有关叙述正确的是( )
A、电流方向由Cu极流向Zn极 B、若将CuSO4溶液放入A池,ZnSO4溶液放入B池,电流表指针仍能偏转 C、电池工作时,Zn片带正电荷,Cu片带负电荷 D、盐桥中的阴离子移向A池11. 现有室温下四种溶液,下列有关叙述正确的是( )序号
①
②
③
④
pH
12
12
2
2
溶液
氨水
氢氧化钾溶液
醋酸
盐酸
A、④中加入适量的醋酸钠晶体后,溶液的pH减小 B、②和③两溶液等体积混合,所得溶液中c(H+ )<c(OH- ) C、分别加水稀释100倍,四种溶液的pH:①>②>④>③ D、V1L④与V2L①溶液混合后,若混合后溶液pH=7,则V1<V212. 电解法处理酸性含铬废水(主要含有Cr2O)时,以铁板作阴、阳极,处理过程中存在反应Cr2O+6Fe2++14H+=2Cr3+ +6Fe3+ +7H2O,最后Cr3+以Cr(OH)3形式除去。下列说法错误的是( )A、阳极反应为Fe-2e- =Fe2+ B、电解过程中溶液pH不断减小 C、过程中有Fe(OH)3沉淀生成 D、电路中每转移6mol电子,最多有0. 5 mol Cr2O被还原13. 已知25℃时有关物质的颜色和溶度积(Ksp)如下表所示:物质
AgCl
AgBr
AgI
Ag2S
颜色
白
淡黄
黄
黑
Ksp
1.8×10-10
7.7×10-13
1.5×10-16
1.8×10-50
下列叙述中正确的是( )
A、向AgCl悬浊液中加入0.1mol·L-lNa2S溶液,有黑色沉淀产生 B、25℃时,AgBr、AgI饱和水溶液中c(Ag+)的大小关系为后者大于前者 C、25℃,AgCl固体在等物质的量浓度NaCl、CaCl2溶液中的溶度积不相同 D、在5mL1.8×10-6mol·L-1NaCl溶液中,加入1滴(20滴约为1mL)1×10-3mol·L-1AgNO3溶液,能产生白色沉淀14. 某温度下,在容积为2L的密闭容器中发生反应CO(g)+ H2O(g)CO2(g)+ H2(g),部分数据见下表(表中t2>t1):反应时间/min
n(CO)/mol
n(H2O)/mol
n(CO2 )/mol
n(H2 )/mol
0
1.20
0.60
0
0
t1
0.80
t2
0.20
下列说法正确的是( )
A、反应在0~t1min内的平均速率为v(CO)= mol·L-1·nin-1 B、平衡时CO的转化率约为33.33% C、该温度下反应的平衡常数为10 D、其他条件不变,若起始时n(CO) =0.60 mol,n(H2O)=1. 20 mol,则平衡时n(CO2)=0.20 mol15. Mg-空气电池的工作原理如图所示。下列说法正确的是( )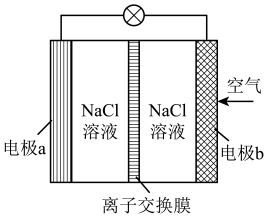 A、电池工作时电极b上会生成少量气体,该气体可能是O2 B、电池工作时,电子由电极b经外电路流向电极a C、若采用阴离子交换膜,能防止负极区形成Mg(OH)2沉淀 D、电池工作时的主要反应为2Mg+O2 +2H2O=2Mg(OH)216. 常温时,CuS的溶度积Ksp=6.3×10-36 , NiS在水中的沉淀溶解平衡曲线如下图所示:
A、电池工作时电极b上会生成少量气体,该气体可能是O2 B、电池工作时,电子由电极b经外电路流向电极a C、若采用阴离子交换膜,能防止负极区形成Mg(OH)2沉淀 D、电池工作时的主要反应为2Mg+O2 +2H2O=2Mg(OH)216. 常温时,CuS的溶度积Ksp=6.3×10-36 , NiS在水中的沉淀溶解平衡曲线如下图所示:
下列有关推断正确的是( )
A、常温时,CuS在Na2S溶液中的Ksp比在水中的小 B、常温时,NiS的溶度积Ksp(NiS) =1.0 ×10-24 C、向含等浓度Cu2+、Ni2+的混合溶液中滴加Na2S溶液,先生成NiS沉淀 D、向Y点溶液中加入Na2S溶液,可使Y点移到Z点二、综合题
-
17. 甲、乙、丙三个实验小组欲探究影响化学反应速率的因素,设计实验方案如下:(1)、I.甲组:利用KMnO4和H2C2O4(草酸)在酸性溶液中发生氧化还原反应生成CO2气体体积来探究化学反应速率的影响因素(实验中所用KMnO4溶液已加入稀硫酸酸化)。
用离子方程式表示该反应的原理:。
实验装置如图所示,实验时分液漏斗中A溶液一次性加入,A、B的成分见下表:

序号
A溶液
B溶液
①
2 mL 0.1 mol/LH2C2O4 (aq)
4 mL 0.01 mol/L KMnO4(aq)
②
2 mL 0. 2 mol/LH2C2O4 (aq)
4 mL 0.01 mol/L KMnO4(aq)
③
2 mL 0. 2 mol/LH2C2O4 (aq)
4 mL 0.01 mol/L KMnO4(aq) + MnSO4(少量)
(2)、该实验装置检查气密性的方法是。(3)、该实验探究的是对化学反应速率的影响。在反应停止之前,相同时间内针简中所得CO2的体积由大到小的顺序是(填实验序号)。(4)、II.乙组:通过测定KMnO4和H2C2O4(草酸)在酸性溶液中发生反应时KMnO4溶液褪色所需时间的长短探究浓度对化学反应速率的影响。该实验小组配制了以下溶液:①0.01 mol/L KMnO4溶液2 mL;②0.20 mol/L KMnO4溶液2 mL;③0.10 mol/L H2C2O4溶液6 mL;④0.20 mol/L H2C2O4溶液6 mL。实验时使用下列各组试剂中合理的一组是____(填字母)。
A、①②③ B、①②④ C、①③④ D、②③④(5)、使用上面选择那组试剂进行实验,测得溶液褪色时间分别为10s和5 s,计算褪色时间为10s的实验中草酸的反应速率v(H2C2O4)=mol/(L·s)。18. 如图中C、D、E、F、X、Y都是情性电极。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色。回答下列问题: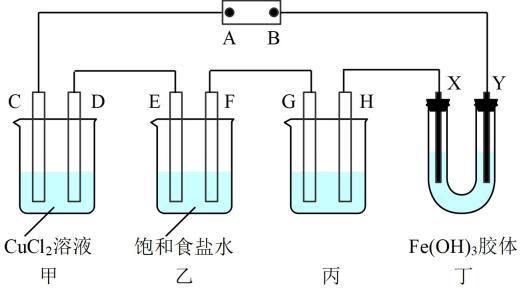 (1)、若用铅蓄电池为电源,则电源A极的材料为(填化学式)。(2)、甲装置中C电极的现象是。(3)、乙装置中的阴极产物为 , 乙装置中电解总反应的离子方程式为。(4)、装置丙用于铁上镀锌,G应该是(填名称),电镀液的成分是。(5)、已知氢氧化铁胶体中含有带正电荷的红褐色的微粒,则装置丁中的现象是。19. 醋酸是日常生活中最常见的调味剂和重要的化工原料,醋酸钾是其常见的盐。请回答下列问题:(1)、0. 2 mol· L-1CH3COOK溶液中离子浓度由大到小的顺序为。(2)、物质的量浓度均为0.2 mol·L-1的CH3COOH和CH3COOK溶液等体积混合(混合前后忽略溶液体积变化),混合液中的下列关系式正确的是____(填字母)。A、c(CH3COOH) +c(H+ )= c(CH3COO- ) +c(OH- ) B、c(H+)+c(K+ )=c(CH3COO- ) +c(OH- ) C、c(CH3COO- )+c(CH3COOH)=0.2 mol·L-1(3)、常温下0. 1 mol·L-1的CH3COOH溶液加水稀释的过程,下列表达式的数值一定变大的是____(填字母)。A、c(H+ ) B、 C、c(H+) · c(OH -) D、(4)、常温时,pH=3的醋酸溶液和pH=11的KOH溶液等体积混合后,溶液中c(K+)c(CH3COO-)(填“>”“<”或“=”,下同)。(5)、常温时,将m mol· L-1的醋酸溶液和n mol·L-1的KOH溶液等体积混合后,所得溶液的pH=7,则m与n的大小关系是mn。(6)、已知25° C时,三种酸的电离平衡常数如下:
(1)、若用铅蓄电池为电源,则电源A极的材料为(填化学式)。(2)、甲装置中C电极的现象是。(3)、乙装置中的阴极产物为 , 乙装置中电解总反应的离子方程式为。(4)、装置丙用于铁上镀锌,G应该是(填名称),电镀液的成分是。(5)、已知氢氧化铁胶体中含有带正电荷的红褐色的微粒,则装置丁中的现象是。19. 醋酸是日常生活中最常见的调味剂和重要的化工原料,醋酸钾是其常见的盐。请回答下列问题:(1)、0. 2 mol· L-1CH3COOK溶液中离子浓度由大到小的顺序为。(2)、物质的量浓度均为0.2 mol·L-1的CH3COOH和CH3COOK溶液等体积混合(混合前后忽略溶液体积变化),混合液中的下列关系式正确的是____(填字母)。A、c(CH3COOH) +c(H+ )= c(CH3COO- ) +c(OH- ) B、c(H+)+c(K+ )=c(CH3COO- ) +c(OH- ) C、c(CH3COO- )+c(CH3COOH)=0.2 mol·L-1(3)、常温下0. 1 mol·L-1的CH3COOH溶液加水稀释的过程,下列表达式的数值一定变大的是____(填字母)。A、c(H+ ) B、 C、c(H+) · c(OH -) D、(4)、常温时,pH=3的醋酸溶液和pH=11的KOH溶液等体积混合后,溶液中c(K+)c(CH3COO-)(填“>”“<”或“=”,下同)。(5)、常温时,将m mol· L-1的醋酸溶液和n mol·L-1的KOH溶液等体积混合后,所得溶液的pH=7,则m与n的大小关系是mn。(6)、已知25° C时,三种酸的电离平衡常数如下:化学式
CH3COOH
H2CO3
HClO
Ka1
1.8 ×10-5
4.3 ×10-7
3.0 ×10-8
Ka2
—
5.6 ×10-11
—
下列四种离子结合H+能力最强的是 (填字 母)。
A. HCO B. CO C. ClO- D. CH3COO-
写出HClO+Na2CO3 (少量)反应离子方程式:。
20. 回答下列问题:(1)、I.液氧甲烷火箭发动机是介于液氧煤油和液氧液氢之间的一个选择 ,其燃烧的热化学方程式为:CH4(g)+2O2(g)= CO2(g)+2H2O(l) ΔH=-890.3kJ ·mol-1 , 根据以下信息,共价键
C-H
O=O
H- O
键能/(kJ·mol-1)
413
498
464
热化学方程式
H2O(l)=H2O(g) ΔH =+44kJ·mol-1
求算C=O的键能:。
(2)、II.美国Bay工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如图所示:
该流程中第I步反应为CH4(g)+H2O(g) CO(g)+3H2(g) ΔH >0。 若下图表示在其他条件相同时,分别测定不同压强、不同温度下CH4的平衡转化率(纵坐标为CH4的平衡转化率),则p1 p2(填“>”或“<”)。
 (3)、该流程的第II步反应为CO(g) + H2O(g)H2(g)+CO2(g),反应的平衡常数随温度的变化如下表所示。
(3)、该流程的第II步反应为CO(g) + H2O(g)H2(g)+CO2(g),反应的平衡常数随温度的变化如下表所示。温度/℃
400
500
830
1000
平衡常数K
10
9
1
0.6
①从上表可以推断:此反应的正反应是(填“吸”或“放”)热反应。
②在500 ℃下,若开始时向恒容密闭容器中充入CO与H2O均为3 mol,则达到平衡后CO的转化率为。
实验编号
n(CO)
n(H2O)
n(H2)
n(CO2)
甲
2
5
4
3
乙
3
3
2
2
丙
0.25
4
2
1
③在830 ℃时,以上表的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向逆反应方向进行的有(填实验编号)。
④在一个不传热的固定容积的容器中,判断该反应达到平衡的标志是 (填字母)。
A.各组分的物质的量浓度不再改变;
B. v(CO2)正=v(H2O)逆;
C.混合气体的密度不变;
D.混合气体的平均相对分子质量不变;
E.体系的压强不再发生变化;
F.体系的温度不再发生变化。
⑤如图表示该反应在t1时刻达到平衡,在t2时刻分别因改变某个 条件而发生变化的情况:图中t2时刻发生改变的条件可能是(写出两种)。
