山东省济宁市微山县2022-2023学年高二上学期第一次月考化学试题
试卷更新日期:2022-10-20 类型:月考试卷
一、单选题(共10个小题,每题只有一个正确答案,每题2分,共20分)
-
1. 下列说法正确的是( )A、已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol B、已知2C(s)+2O2(g)=2CO2(g) ΔH=a kJ/mol,2C(s)+O2(g)=2CO(g) ΔH=b kJ/mol,则a>b C、可燃物的系数为1的燃烧反应的焓变即为该可燃物的燃烧热 D、已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.4kJ/mol,则含0.5mol NaOH的稀溶液与稀醋酸完全中和,放出的热量小于28.7kJ2. 已知:HCN(aq)与NaOH(aq)反应的 ΔH= -12.1kJ/mol ,HCl(aq)与NaOH(aq)反应的ΔH= -55.6kJ/mol。则H+(aq)与CN-(aq)反应生成HCN(aq)的等于( )A、+43.5kJ/mol B、- 67.7kJ/mol C、- 43.5kJ/mol D、+ 67.7kJ/mol3. 某化学反应的能量变化如图所示,下列说法错误的是 ( )
 A、该反应可能不需要加热就能够发生 B、该反应断键吸收的总能量大于成键释放的总能量 C、该反应可能是化合反应,也可能是分解反应 D、该反应的化学方程式可能为 2Na+2H2O =2NaOH+2H2↑4. 下列反应中,属于吸热反应的是( )A、H2在Cl2中燃烧 B、Ba(OH)2·8H2O晶体和NH4Cl晶体反应 C、NaOH与稀盐酸反应 D、Al与稀硫酸反应5. 已知反应 , 反应中相关的化学键键能数据如表所示,则1mol中的化学键完全断裂时需要的能量为( )
A、该反应可能不需要加热就能够发生 B、该反应断键吸收的总能量大于成键释放的总能量 C、该反应可能是化合反应,也可能是分解反应 D、该反应的化学方程式可能为 2Na+2H2O =2NaOH+2H2↑4. 下列反应中,属于吸热反应的是( )A、H2在Cl2中燃烧 B、Ba(OH)2·8H2O晶体和NH4Cl晶体反应 C、NaOH与稀盐酸反应 D、Al与稀硫酸反应5. 已知反应 , 反应中相关的化学键键能数据如表所示,则1mol中的化学键完全断裂时需要的能量为( )化学键
C—H
H—H
C—O
键能/()
414
802
436
326
A、432kJ B、464kJ C、864kJ D、928kJ6. 在一定温度下,向a L恒容密闭容器中加入1molX气体和2molY气体,发生如下反应:X(g) + 2Y(g)2Z(g) +D(g) 此反应达到平衡的标志是( )A、正反应和逆反应的速率都为零 B、Z的物质的量浓度不再改变 C、单位时间消耗0.1molX同时消耗0.2molY D、该反应达到化学平衡状态时,X可100%转化为D7. 对可逆反应 , 下列叙述正确的是( )A、若单位时间内生成的同时,消耗 , 则反应达到平衡状态 B、达到平衡后,保持温度不变,减小容器体积增大压强,平衡逆向移动,减小 C、降低温度,正反应速率增大,逆反应速率减少,平衡正向移动 D、其它条件不变,若增加的量,可以提高的转化率8. 某温度下,在的密闭容器中进行反应 , 若起始时加入和反应一段时间后达到平衡,则下列说法正确的是( )A、增大该体系的压强,化学平衡常数增大 B、A、的平衡转化率相等 C、该反应的化学平衡常数表达式是 D、当四种物质的物质的量之比等于方程式系数比时,反应达到平衡9. 下列叙述正确的是( )A、反应物分子间发生碰撞一定能发生化学反应 B、反应过程的自发性可判断过程发生的速率 C、反应在室温下可自发进行,则该反应的 D、反应10. 下列事实,能用勒夏特列原理解释的是( )A、酯的水解,加入稀硫酸 B、工业合成氨的温度选择 C、光照新制氯水时,溶液的颜色逐渐变浅 D、由NO2(g)和N2O4(g)组成的平衡体系,加压后颜色加深二、不定项选择题(共5小题,每题有1-2个正确答案,每题4分,少选2分,选错不得分,共20分)
-
11. 已知:2SO2(g) + O2(g) 2SO3(g) ΔH,不同条件下反应过程能量变化如图所示。

下列说法中不正确的是( )
A、反应的ΔH<0 B、过程b使用了催化剂 C、使用催化剂不能提高活化分子百分数 D、过程b发生两步反应,第一步为吸热反应,且反应较慢12. 为探究外界条件对反应:的影响,以A和B的物质的量之比为开始反应,通过实验得到不同条件下反应达到平衡时Z的物质的量分数与压强及温度的关系,实验结果如图所示。下列判断正确的是( ) A、 B、 C、其它条件相同,升高温度,增大的幅度小于 D、其它条件相同,压强增大,平衡正向移动,该反应的平衡常数增大13. 下列图示与对应的叙述不相符的是( )
A、 B、 C、其它条件相同,升高温度,增大的幅度小于 D、其它条件相同,压强增大,平衡正向移动,该反应的平衡常数增大13. 下列图示与对应的叙述不相符的是( )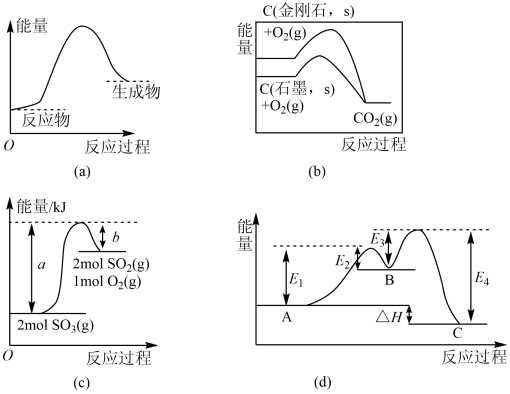 A、(a)图表示反应物断键吸收的能量大于生成物成键放出的能量 B、(b)图是金刚石与石墨分别被氧化生成的能量关系曲线,说明石墨转化为金刚石的反应的 C、由(c)图可知, D、(d)图是某反应:A→C(由两步反应A→B→C完成,B为中间产物)的能量曲线(表示能量),整个反应中14. 下列热化学方程式中,能表示相应物质的燃烧热的是( )A、 B、 C、 D、15. NO的治理是当前生态环境保护中的重要课题之一,Cu基催化剂是NH3SCR技术脱除NO中性能较为优异的新型催化剂,但SO2会造成Cu基催化剂的催化性能下降。加入CeO2可抑制SO2对Cu基催化剂的影响(含Ce化合物的比例系数均未标定),其作用机理如图所示。下列说法正确的是( )
A、(a)图表示反应物断键吸收的能量大于生成物成键放出的能量 B、(b)图是金刚石与石墨分别被氧化生成的能量关系曲线,说明石墨转化为金刚石的反应的 C、由(c)图可知, D、(d)图是某反应:A→C(由两步反应A→B→C完成,B为中间产物)的能量曲线(表示能量),整个反应中14. 下列热化学方程式中,能表示相应物质的燃烧热的是( )A、 B、 C、 D、15. NO的治理是当前生态环境保护中的重要课题之一,Cu基催化剂是NH3SCR技术脱除NO中性能较为优异的新型催化剂,但SO2会造成Cu基催化剂的催化性能下降。加入CeO2可抑制SO2对Cu基催化剂的影响(含Ce化合物的比例系数均未标定),其作用机理如图所示。下列说法正确的是( ) A、NO可以造成臭氧空洞 B、在反应机理②中,Ce元素的化合价升高 C、整个反应的化学方程式为 D、改良催化剂可以提高合成反应的平衡转化率
A、NO可以造成臭氧空洞 B、在反应机理②中,Ce元素的化合价升高 C、整个反应的化学方程式为 D、改良催化剂可以提高合成反应的平衡转化率三、非选择题(共5小题,60分。除标注外每空2分)
-
16. 在一定温度下,向体积为1L的密闭容器中通入1molX气体和0.5molY气体,各物质的物质的量随时间变化如图所示:
 (1)、该反应是(填“可逆反应”或“非可逆反应”),化学反应方程式为。(2)、在2min内X平均反应速率。(3)、若在2min末时,放出18.16kJ热量,则该反应的热化学方程式为。17. 如图1是反应A(g)+3B(g)2C(g) ΔH=-akJ•mol-1在反应过程中的能量变化关系图,回答下列问题。
(1)、该反应是(填“可逆反应”或“非可逆反应”),化学反应方程式为。(2)、在2min内X平均反应速率。(3)、若在2min末时,放出18.16kJ热量,则该反应的热化学方程式为。17. 如图1是反应A(g)+3B(g)2C(g) ΔH=-akJ•mol-1在反应过程中的能量变化关系图,回答下列问题。 (1)、由示意图知,反应物的总能量(填“>”、“<”或“=”)生成物的总能量,此反应中反应物的总键能(填“>”、“<”或“=”)生成物的总键能。(2)、a=(用Ec和Ec′表示)。(3)、加入催化剂对该反应的ΔH影响(填“有”或“无”)。(4)、已知:
(1)、由示意图知,反应物的总能量(填“>”、“<”或“=”)生成物的总能量,此反应中反应物的总键能(填“>”、“<”或“=”)生成物的总键能。(2)、a=(用Ec和Ec′表示)。(3)、加入催化剂对该反应的ΔH影响(填“有”或“无”)。(4)、已知:2CH3OH(l)+2O2(g)=2CO(g)+4H2O(g) ΔH1=-akJ•mol-1;
2CO(g)+O2(g)=2CO2(g) ΔH2=-bkJ•mol-1;
H2O(g)=H2O(l) ΔH3=-ckJ•mol-1。
则表示CH3OH(l)燃烧热的热化学方程式为:。
(5)、工业上用H2(g)和Cl2(g)反应制HCl(g),各键能为H-H:436kJ/mol,Cl-Cl:243kJ/mol,H-Cl:431kJ/mol。该反应的热化学方程式是。(6)、298K时,0.5molC2H4(g)完全燃烧生成二氧化碳和液态水,放出705.5kJ的热量。请写出表示C2H4(g)燃烧热的热化学方程式:。18.(1)、I.汽车内燃机工作时引起反应: , 是导致汽车尾气中含有NO的原因之一、已知断裂某些共价键需要的能量如表:断裂的共价键
O=O
N≡N
N-O
需要的能量
机动车发动机工作时会引发N2和O2的反应,该反应是(填“放热”或“吸热”)反应。
(2)、与合成NO的热化学方程式可以表示为 , 则。(3)、NO与CO反应的热化学方程式可以表示为 , 但该反应的速率很小,若使用机动车尾气催化转化器,尾气中的NO与CO可以转化成无害物质排封。上述反应在使用“催化转化器”后,a(填“增大”“减小”或“不变”)。(4)、已知:① ;② 。
Al和FeO发生铝热反应的热化学方程式是。
(5)、II.写出下列反应的化学平衡常数表达式:4NH3(g)+5O2(g)4NO(g)+6H2O(g)K=
(6)、H2(g)+I2(g)2HI(g)K=(7)、C(s)+H2O(g)CO(g)+H2(g)K=19.(1)、I.某温度时,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。
请回答下列问题:
该反应的化学反应方程式为。
(2)、1min时,Y的正反应速率Y的逆反应速率(填“>”“<”或“=”)(3)、反应从开始至2min,用X的浓度变化表示的平均反应速率为。(4)、II.油气开采、石油化工、煤化工等行业废气普遍含有硫化氢,通常将其回收生产硫单质(S2)。目前较为普遍的方法是克劳斯工艺和高温热分解H2S,克劳斯工艺的原理是利用以下两步反应生产单质硫:①
②
请回答下列问题:
下列措施可以加快反应②的速率的是____。
A、升高温度 B、保持容积不变,充入N2使体系压强增大 C、及时从体系中分离出S2(g) D、加入合适的催化剂(5)、高温热分解H2S的化学反应方程式是。(6)、在1470K、100kPa反应条件下,在一容积为2L的恒容容器中充入1molH2S进行高温热分解反应,反应5分钟后达到平衡,平衡时混合气体中H2S与H2的物质的量相等,H2S平衡转化率为。20. 氨气和甲醇都是重要的工业产品,试运用必要的化学原理解决有关问题。(1)、在密闭容器中,使2molN2和7mol H2在一定条件下发生反应:。①平衡后,N2和H2的转化率的比值1(填“>”“<”成“=”)。
②当达到平衡时,保持恒温,压缩容器体积,平衡(填“正向”“逆向”或“不”)移动,化学平衡常数K(填“增大”“减小”或“不变”)。
(2)、水煤气在一定条件下可合成甲醇:。将和充入1L恒容密闭容器中,在一定条件下合成甲醇,反应相同时间时测得不同温度下的转化率如图所示:
①温度在下,从反应开始至末,这段时间内的反应速率。
②由图可知,在温度低于时,CO的转化率随温度的升高而增大,原因是。
③已知c点时容器内气体的压强为p,则在下该反应的压强平衡常数Kp为(kPa)-2 (用含p的代数式表示,Kp是用各气体的分压替代浓度来计算的平衡常数,分压=总压×物质的量分数)。