浙教版科学九上期中考试小练习1
试卷更新日期:2022-10-19 类型:复习试卷
一、单选题
-
1. 某电镀厂的电镀液中含有金盐,为了回收其中的金元素,技术人员制作了“吸金球”。“吸金球”是装入一些“吸金”物质的纱袋。把“吸金球”浸入电镀液,能“吸”出盐溶液中的金。据上所述,“吸金球” 中的“吸金”物质可能是( )A、磁石(主要成分是Fe3O4) B、铁屑(Fe) C、胆矾(CuSO4·5H2O) D、活性炭(C)2. 某无色溶液中含有KNO3、BaCl2、Na2CO3、HCl中的两种溶质。向混合溶液中加入稀硫酸,只产生无色、无味的气体,则此溶液中所含有的溶质是( )A、BaCl2、Na2CO3 B、HCl、KNO3 C、Na2CO3、KNO3 D、HCl、Na2CO33. 如图是“一氧化碳与氧化铁反应”的部分实验装置,关于该实验说没正确的是( )
 A、充分反应后,向固体中加稀盐酸会产生气泡 B、在实验过程中,黑色的粉末会逐渐变成红色 C、该实验的反应原理为 FeO + COFe + CO D、在实验过程中,产生的尾气可以直接排放到空气中4. 现有 X、Y、Z 三种金属,如果把 X、Y 和Z分别投入到稀盐酸中,只有Y溶解并产生气泡,X、Z不反应;如果把X和Z分别放入硝酸银溶液中,过一会儿,在X表面有银析出,而Z没有变化,则X、Y、Z的属活动性顺序为( )A、Y > X > Z B、X > Y > Z C、Z > Y > X D、X > Z > Y5. 常见金属R与硝酸银溶液反应为:R+3AgNO3=3Ag+ R(NO3)3 , 说法正确的是( )A、反应后溶液质量一定增加 B、该金属可能是铁 C、R 的活泼性比Ag弱 D、R表面有固体析出6. 将锌粉持续加入100g含有和两种溶质的混合溶液中,充分反应。当加入锌粉的质量为6.5g时,溶液质量最小;当加入锌粉的质量为13.0g时,恰好完全反应。下列是反应中的相关量随加入锌的质量变化的关系图,其中正确的是( )A、
A、充分反应后,向固体中加稀盐酸会产生气泡 B、在实验过程中,黑色的粉末会逐渐变成红色 C、该实验的反应原理为 FeO + COFe + CO D、在实验过程中,产生的尾气可以直接排放到空气中4. 现有 X、Y、Z 三种金属,如果把 X、Y 和Z分别投入到稀盐酸中,只有Y溶解并产生气泡,X、Z不反应;如果把X和Z分别放入硝酸银溶液中,过一会儿,在X表面有银析出,而Z没有变化,则X、Y、Z的属活动性顺序为( )A、Y > X > Z B、X > Y > Z C、Z > Y > X D、X > Z > Y5. 常见金属R与硝酸银溶液反应为:R+3AgNO3=3Ag+ R(NO3)3 , 说法正确的是( )A、反应后溶液质量一定增加 B、该金属可能是铁 C、R 的活泼性比Ag弱 D、R表面有固体析出6. 将锌粉持续加入100g含有和两种溶质的混合溶液中,充分反应。当加入锌粉的质量为6.5g时,溶液质量最小;当加入锌粉的质量为13.0g时,恰好完全反应。下列是反应中的相关量随加入锌的质量变化的关系图,其中正确的是( )A、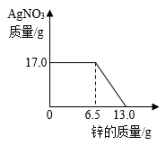 B、
B、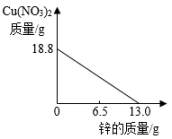 C、
C、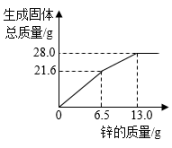 D、
D、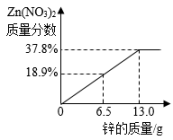 7. 向一定质量的Mg(NO3)2、AgNO3和Cu(NO3)2混合溶液中加入铁粉,反应过程中,测得混合物中溶液的质量与加入铁粉的质量关系如图所示。对该反应过程描述下列说法正确的是( )
7. 向一定质量的Mg(NO3)2、AgNO3和Cu(NO3)2混合溶液中加入铁粉,反应过程中,测得混合物中溶液的质量与加入铁粉的质量关系如图所示。对该反应过程描述下列说法正确的是( )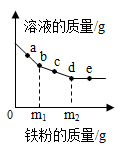 A、a点,向溶液中滴加稀盐酸,无白色沉淀 B、c点,向过滤后得到的固体中滴加稀盐酸,无气泡产生 C、d点,溶液中溶质为Mg(NO3)2、Fe(NO3)2和Cu(NO3)2 D、e点,过滤后得到的固体中只含有2种物质8. “五水共治”大大美化了河道环境某学校实验室排出的废水中含有Ag+、Ba2+”和NO3-三种离子。该校实验小组设计实验从该废水中回收银,并得到副产品碳酸钡固体,操作步骤和实验结果如下
A、a点,向溶液中滴加稀盐酸,无白色沉淀 B、c点,向过滤后得到的固体中滴加稀盐酸,无气泡产生 C、d点,溶液中溶质为Mg(NO3)2、Fe(NO3)2和Cu(NO3)2 D、e点,过滤后得到的固体中只含有2种物质8. “五水共治”大大美化了河道环境某学校实验室排出的废水中含有Ag+、Ba2+”和NO3-三种离子。该校实验小组设计实验从该废水中回收银,并得到副产品碳酸钡固体,操作步骤和实验结果如下
已知滤液B中只含有一种溶质,则下列说法不正确的是( )
A、蓝色沉淀是Cu(OH)2 B、乙一定是氢氧化钡 C、若丙是K2CO3 , 滤液C结晶后可以作为化学肥料 D、若得到19.7g碳酸钡,则证明原废水中含有13.7g钡二、填空题
-
9. 氢氧化钠和氢氧化钙是实验室常见的两种碱,它们之间有许多相似之处。(1)、氢氧化钠和氢氧化钙有相似的化学性质,原因是它们在电离时都产生了(填写微粒符号)。(2)、氢氧化钠和氢氧化钙溶液都是无色透明的液体。为鉴别它们,小明设计了如图三种方案(每种方案的两支试管中事先分别加入等量的上述两种碱)。其中可行的是方案。
 10. 为了达到收旧利废节能减排目的,从含有金属镁、铁、铜的粉末中,分离和提取出重要化工原料MgSO4和有关金属,实验过程如图:
10. 为了达到收旧利废节能减排目的,从含有金属镁、铁、铜的粉末中,分离和提取出重要化工原料MgSO4和有关金属,实验过程如图:
请回答:
(1)、金属B是。(2)、写出上述实验过程中发生反应的化学方程式。(3)、上述反应的基本反应类型属于反应。11. 请根据表中物质回答下列有关问题:序号 ① ② ③ ④ 物质 醋酸 氧化铁 熟石灰 纯碱 (1)、上表中的物质属于氧化物的是(用化学式表示)。(2)、已知醋酸的电离方程式:CH3COOH =CHCOO-+H+ , 请写出醋酸和熟石灰反应的化学方程式。(3)、选用表中的物质作为反应物,写出制取氢氧化钠的化学方程式:。三、实验探究题
-
12. 食盐是一种重要的化工原料,请回答下列问题。(1)、如图1为实验室除去粗盐中泥沙等难溶性杂质的实验步骤,其中操作Ⅰ所用的玻璃仪器有:漏斗、烧杯和。
 (2)、由于粗盐中含有少量MgCl2、CaCl2、Na2SO4等可溶性杂质,不能满足化工生产的要求,因此必须将粗盐进行精制。流程如图2。
(2)、由于粗盐中含有少量MgCl2、CaCl2、Na2SO4等可溶性杂质,不能满足化工生产的要求,因此必须将粗盐进行精制。流程如图2。

①加BaCl2是为了除去;
②不能用 KOH 溶液代替NaOH,其原因是;
③通过操作Ⅲ所得滤液中的溶质有(用化学式表示);
④操作Ⅳ中加入一定量的盐酸调pH=7的目的是。
13. 学习复分解反应发生条件时,小金同学将稀硫酸分别加入以下三支试管:试验编号
一
二
三
试管内试剂
Fe2O3粉末
NaOH溶液+酚酞试剂
MgCl2溶液
 (1)、实验一中,微热试管,出现现象时,表明Fe2O3与稀硫酸发生了反应。(2)、实验二中,当溶液刚变为无色时,此时溶液的pH7(请填“>”、“=”、“<”、“≥”或“≤”)。(3)、为了验证实验三是否发生复分解反应,小金同学进行了如下探究。
(1)、实验一中,微热试管,出现现象时,表明Fe2O3与稀硫酸发生了反应。(2)、实验二中,当溶液刚变为无色时,此时溶液的pH7(请填“>”、“=”、“<”、“≥”或“≤”)。(3)、为了验证实验三是否发生复分解反应,小金同学进行了如下探究。已知:SO42﹣对Cl﹣的检验、测定有干扰。
①沉淀A的化学式。
②步骤II中加入的试剂要足量,目的是。
③若满足m=(用含m1和m2的式子表示),证明实验三未发生复分解反应。
四、解答题
-
14. 某兴趣小组用12g镁条与溶质质量分数为49%的稀硫酸反应,测得产生氢气的质量与稀硫酸的质量关系如图(假设镁条中除表面含有氧化镁外,还有其它难溶性杂质且不与稀硫酸反应),试分析回答:
 (1)、稀硫酸质量在0~20g范围内,试用化学方程式解释未产生气体的原因。(2)、当稀硫酸质量为90g时,取出部分溶液加入碳酸钡粉末,则会产生的现象是。(3)、求出P的值。(写出计算过程,下同)(4)、计算该镁条中氧化镁的质量分数。(结果精确到0.1%)15. 有同学将金属氧化物知识整理如下:
(1)、稀硫酸质量在0~20g范围内,试用化学方程式解释未产生气体的原因。(2)、当稀硫酸质量为90g时,取出部分溶液加入碳酸钡粉末,则会产生的现象是。(3)、求出P的值。(写出计算过程,下同)(4)、计算该镁条中氧化镁的质量分数。(结果精确到0.1%)15. 有同学将金属氧化物知识整理如下:氧化钾
氧化钙
氧化钠
氧化镁
氧化铝
氧化锌
氧化铁
氧化铜
K2O
CaO
Na2O
MgO
Al2O3
ZnO
CuO
(1)、写出表中氧化铁的化学式;(2)、表中的排列规律是根据金属排列的(填序号).①元素化合价 ②活动性顺序 ③原子的相对原子质量.
(3)、氧化镁2克与足量的硫酸反应可以生成硫酸镁多少克?