浙江省温州市苍南县2022-2023学年高二上学期10月第一次月考化学试题
试卷更新日期:2022-10-18 类型:月考试卷
一、选择题(本大题共14小题,每小题3分,共42分。每小题只有一个选项符合题目要求)
-
1. 下列说法正确的是( )A、葡萄糖的燃烧热是2800 kJ/mol,则
 C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l)ΔH=-1400kJ·mol-1
B、已知101 kPa时,2C(s)+O2(g)=2CO(g)ΔH=-221 kJ/mol,则该反应的反应热为221 kJ·mol-1
C、已知稀溶液中,H+ (aq)+OH- (aq)=H2O(l) ΔH=-57.3 kJ·mol-1 , 则稀醋酸与稀氢氧化钠溶液反应生成1 mol水时放出57.3 kJ的热量
D、已知HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1 , 则98%的浓硫酸与稀氢氧化钠溶液反应生成1 mol水的中和热为-57.3 kJ·mol-1
2. 下列说法不正确的是( )A、化学反应中一定伴随能量变化 B、S在纯氧中燃烧是将全部化学能转化为热能 C、物质所含化学键键能越大,其越稳定 D、化学反应的ΔH , 只与反应体系的始态和终态有关,与反应途径无关3. 反应I:H2(g)+I2(g)
C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l)ΔH=-1400kJ·mol-1
B、已知101 kPa时,2C(s)+O2(g)=2CO(g)ΔH=-221 kJ/mol,则该反应的反应热为221 kJ·mol-1
C、已知稀溶液中,H+ (aq)+OH- (aq)=H2O(l) ΔH=-57.3 kJ·mol-1 , 则稀醋酸与稀氢氧化钠溶液反应生成1 mol水时放出57.3 kJ的热量
D、已知HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1 , 则98%的浓硫酸与稀氢氧化钠溶液反应生成1 mol水的中和热为-57.3 kJ·mol-1
2. 下列说法不正确的是( )A、化学反应中一定伴随能量变化 B、S在纯氧中燃烧是将全部化学能转化为热能 C、物质所含化学键键能越大,其越稳定 D、化学反应的ΔH , 只与反应体系的始态和终态有关,与反应途径无关3. 反应I:H2(g)+I2(g) 2HI(g)的平衡常数为K1;反应II:HI(g)
2HI(g)的平衡常数为K1;反应II:HI(g)
 H2(g)+
H2(g)+  I2(g)的平衡常数为K2 , 上述反应的平衡常数为同温度下的测定值,则K1、K2的关系为( ) A、K1=
I2(g)的平衡常数为K2 , 上述反应的平衡常数为同温度下的测定值,则K1、K2的关系为( ) A、K1= B、
B、 C、
C、 D、
D、 4. 反应A+B→C(放热)分两步进行:①A+B→X(吸热),②X→C(放热)。下列示意图中,能正确表示总反应过程中能量变化的是( )A、
4. 反应A+B→C(放热)分两步进行:①A+B→X(吸热),②X→C(放热)。下列示意图中,能正确表示总反应过程中能量变化的是( )A、 B、
B、 C、
C、 D、
D、 5. 已知凡气体分子总数增多的反应一定是熵增大的反应。一定条件下,下列反应不能自发进行的是( )A、2O3(g)=3O2(g) ΔH<0 B、2CO(g)=2C(s)+O2(g) ΔH>0 C、N2(g)+3H2(g)⇌2NH3(g) ΔH<0 D、CaCO3(s)=CaO(s)+CO2(g) ΔH>06. 中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,主要过程如下图所示。下列说法不正确的是( )
5. 已知凡气体分子总数增多的反应一定是熵增大的反应。一定条件下,下列反应不能自发进行的是( )A、2O3(g)=3O2(g) ΔH<0 B、2CO(g)=2C(s)+O2(g) ΔH>0 C、N2(g)+3H2(g)⇌2NH3(g) ΔH<0 D、CaCO3(s)=CaO(s)+CO2(g) ΔH>06. 中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,主要过程如下图所示。下列说法不正确的是( ) A、整个过程实现了光能向化学能的转换 B、过程II有O-O单键生成并放出能量 C、过程III发生的化学反应为: 2H2O2=2H2O+O2 D、整个过程的总反应方程式为: 2H2O→2H2+O27. 胶状液氢(主要成分是H2和CH4)有望用于未来的运载火箭和空间运输系统。实验测得101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ的热量;1 mol CH4完全燃烧生成液态水和CO2气体,放出890.3 kJ的热量。下列热化学方程式书写正确的是( )A、2H2(g)+O2(g)=2H2O(l) ΔH=-285.8 kJ·mol-1 B、CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1 C、CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1 D、CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=+890.3 kJ·mol-18. 关于如图的说法不正确的是( )
A、整个过程实现了光能向化学能的转换 B、过程II有O-O单键生成并放出能量 C、过程III发生的化学反应为: 2H2O2=2H2O+O2 D、整个过程的总反应方程式为: 2H2O→2H2+O27. 胶状液氢(主要成分是H2和CH4)有望用于未来的运载火箭和空间运输系统。实验测得101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ的热量;1 mol CH4完全燃烧生成液态水和CO2气体,放出890.3 kJ的热量。下列热化学方程式书写正确的是( )A、2H2(g)+O2(g)=2H2O(l) ΔH=-285.8 kJ·mol-1 B、CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1 C、CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1 D、CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=+890.3 kJ·mol-18. 关于如图的说法不正确的是( )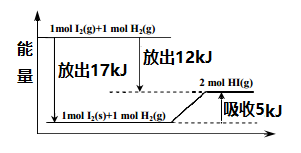 A、1mol固态碘与1molH2化合生成2molHI气体时,需要吸收5kJ的能量 B、2molHI气体分解生成1mol碘蒸气与1molH2时需要吸收12kJ的能量 C、1mol固态碘变为1mol碘蒸气时需要吸收17kJ的能量 D、碘蒸气与H2生成HI气体的反应是吸热反应9. 可逆反应:2X(g)+Y(g)
A、1mol固态碘与1molH2化合生成2molHI气体时,需要吸收5kJ的能量 B、2molHI气体分解生成1mol碘蒸气与1molH2时需要吸收12kJ的能量 C、1mol固态碘变为1mol碘蒸气时需要吸收17kJ的能量 D、碘蒸气与H2生成HI气体的反应是吸热反应9. 可逆反应:2X(g)+Y(g)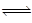 2Z(g)的平衡状态下,保持恒温恒容向容器中加入一定量的Y,下列说法正确的是(K为平衡常数,Q为浓度熵)( ) A、Q不变, K变大, Y的转化率增大 B、Q不变, K变大, X的转化率减小 C、Q变小, K不变, Y的转化率减小 D、Q增大, K不变, X的转化率增大10. 在同温同压下,下列各组热化学方程式中,△H2>△H1的是( )A、2H2(g)+O2(g) =2H2O(g) △H1; 2H2(g)+O2(g) =2H2O(l) △H2 B、S(g)+O2(g)=SO2(g) △H1; S(s) +O2(g)=SO2(g) △H2 C、C(s)+
2Z(g)的平衡状态下,保持恒温恒容向容器中加入一定量的Y,下列说法正确的是(K为平衡常数,Q为浓度熵)( ) A、Q不变, K变大, Y的转化率增大 B、Q不变, K变大, X的转化率减小 C、Q变小, K不变, Y的转化率减小 D、Q增大, K不变, X的转化率增大10. 在同温同压下,下列各组热化学方程式中,△H2>△H1的是( )A、2H2(g)+O2(g) =2H2O(g) △H1; 2H2(g)+O2(g) =2H2O(l) △H2 B、S(g)+O2(g)=SO2(g) △H1; S(s) +O2(g)=SO2(g) △H2 C、C(s)+ O2(g)=CO(g) △H1; C(s)+O2(g)=CO2(g) △H2
D、H2(g)+Cl2(g) =2HCl(g) △H1; 2H2(g)+2Cl2(g) =4HCl(g),△H2
11. 下列事实不能用勒夏特列原理解释的是( )A、开启啤酒瓶后,马上泛起大量泡沫 B、实验室中常用排饱和食盐水的方法收集氯气 C、工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 D、对于2HI(g)
O2(g)=CO(g) △H1; C(s)+O2(g)=CO2(g) △H2
D、H2(g)+Cl2(g) =2HCl(g) △H1; 2H2(g)+2Cl2(g) =4HCl(g),△H2
11. 下列事实不能用勒夏特列原理解释的是( )A、开启啤酒瓶后,马上泛起大量泡沫 B、实验室中常用排饱和食盐水的方法收集氯气 C、工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 D、对于2HI(g)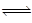 H2(g)+I2(g),达到平衡后,缩小容器容积可使体系颜色变深
12. 在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)
H2(g)+I2(g),达到平衡后,缩小容器容积可使体系颜色变深
12. 在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)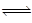 zC(g),平衡时测得A的浓度为0.6 mol/L,保持温度不变,将容器体积扩大到原来的两倍,再达平衡时,测得A的浓度为0.32 mol/L,下列有关判断正确的是( ) A、平衡向正反应方向移动 B、x+y>Z C、B的转化率升高 D、C的体积分数增大13. 在一定温度下,改变起始时n(SO2)对反应2SO2(g)+O2(g)
zC(g),平衡时测得A的浓度为0.6 mol/L,保持温度不变,将容器体积扩大到原来的两倍,再达平衡时,测得A的浓度为0.32 mol/L,下列有关判断正确的是( ) A、平衡向正反应方向移动 B、x+y>Z C、B的转化率升高 D、C的体积分数增大13. 在一定温度下,改变起始时n(SO2)对反应2SO2(g)+O2(g)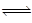 2SO3(g) △H<0的影响如下左图所示,下列说法正确的是( )
2SO3(g) △H<0的影响如下左图所示,下列说法正确的是( ) 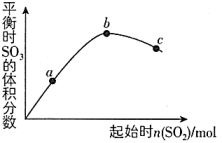 A、b、c点均为平衡点,a点未达平衡且向正反应方向进行 B、a、b、c三点中,a点时SO2的转化率最大 C、a、b、c点均为平衡点,b点时SO2的转化率最大 D、a、b、c三点的平衡常数:Kb>Kc>Ka14. 理论研究表明,在101 kPa和298 K下,HCN(g)
A、b、c点均为平衡点,a点未达平衡且向正反应方向进行 B、a、b、c三点中,a点时SO2的转化率最大 C、a、b、c点均为平衡点,b点时SO2的转化率最大 D、a、b、c三点的平衡常数:Kb>Kc>Ka14. 理论研究表明,在101 kPa和298 K下,HCN(g)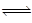 HNC(g)异构化反应过程的能量变化如上右图所示。下列说法正确的是( )
HNC(g)异构化反应过程的能量变化如上右图所示。下列说法正确的是( )  A、HNC比HCN稳定 B、该异构化反应的△H=-59.3 kJ·mol-1 C、正反应的活化能大于逆反应的活化能 D、使用催化剂,可以改变反应的反应热15. 在一定温度下的定容密闭容器中,发生反应:2X(g)
A、HNC比HCN稳定 B、该异构化反应的△H=-59.3 kJ·mol-1 C、正反应的活化能大于逆反应的活化能 D、使用催化剂,可以改变反应的反应热15. 在一定温度下的定容密闭容器中,发生反应:2X(g)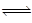 Y(g)。当下列所给有关量不再变化时,不能表明该反应已达平衡状态的是( ) A、混合气体的密度 B、混合气体的压强 C、混合气体的平均相对分子质量 D、c(Y)/c2(X)16. 某化学研究小组探究外界条件对化学反应mA(g)+nB(g)
Y(g)。当下列所给有关量不再变化时,不能表明该反应已达平衡状态的是( ) A、混合气体的密度 B、混合气体的压强 C、混合气体的平均相对分子质量 D、c(Y)/c2(X)16. 某化学研究小组探究外界条件对化学反应mA(g)+nB(g)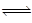 pC(g)的速率和平衡的影响,图像如下,下列判断正确的是( )
pC(g)的速率和平衡的影响,图像如下,下列判断正确的是( )  A、由图a可知,T1>T2 , 该反应的正反应为放热反应 B、由图b可知,该反应m+n<p C、图c是绝热条件下速率和时间的图像,由此说明该反应吸热 D、图d中,若m+n=p,则曲线a一定增大了压强17. 25℃时,0.1 mol/L醋酸溶液中电离平衡常数Ka=1.75×10−5 , 下列说法正确的是( )A、向该溶液中滴加几滴浓盐酸,平衡逆向移动,c(H+)减小 B、向该溶液中加少量CH3COONa固体,平衡正向移动 C、该温度下0.01 mol/L醋酸溶液Ka<1.75×10−5 D、升高温度,c(H+)增大,Ka变大18. 对反应aA(g)
A、由图a可知,T1>T2 , 该反应的正反应为放热反应 B、由图b可知,该反应m+n<p C、图c是绝热条件下速率和时间的图像,由此说明该反应吸热 D、图d中,若m+n=p,则曲线a一定增大了压强17. 25℃时,0.1 mol/L醋酸溶液中电离平衡常数Ka=1.75×10−5 , 下列说法正确的是( )A、向该溶液中滴加几滴浓盐酸,平衡逆向移动,c(H+)减小 B、向该溶液中加少量CH3COONa固体,平衡正向移动 C、该温度下0.01 mol/L醋酸溶液Ka<1.75×10−5 D、升高温度,c(H+)增大,Ka变大18. 对反应aA(g)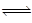 bB(g)+cC(g),向密闭容器中充入1 mol A,达平衡时,体系中B的体积分数随温度、压强的变化关系如下左图所示,下列判断正确的是( )
bB(g)+cC(g),向密闭容器中充入1 mol A,达平衡时,体系中B的体积分数随温度、压强的变化关系如下左图所示,下列判断正确的是( )  A、ΔH<0,ΔS<0 B、M、P两点的化学平衡常数:M<P C、M、N两点A的转化率:M>N D、保持恒温恒容,向P点再充入少量A,达新平衡时,B%增大
A、ΔH<0,ΔS<0 B、M、P两点的化学平衡常数:M<P C、M、N两点A的转化率:M>N D、保持恒温恒容,向P点再充入少量A,达新平衡时,B%增大二、非选择题(本大题共4小题。每空2分,共46分)
-
19. 在一定温度下,对冰醋酸加水稀释的过程中,溶液的导电能力I随加入水的体积V变化的曲线如上右图所示。请回答下列问题:
 (1)、加水前导电能力约为零的原因是。(2)、a、b、c三点对应的溶液中,c(H+)由小到大的顺序为。(3)、a、b、c三点对应的溶液中,CH3COOH的电离程度最大的是。(4)、在b→c段稀释过程中,下列始终保持增大趋势的是 。A、c(H+) B、n(H+) C、
(1)、加水前导电能力约为零的原因是。(2)、a、b、c三点对应的溶液中,c(H+)由小到大的顺序为。(3)、a、b、c三点对应的溶液中,CH3COOH的电离程度最大的是。(4)、在b→c段稀释过程中,下列始终保持增大趋势的是 。A、c(H+) B、n(H+) C、 D、
D、 20. 化学反应的热效应是人类获取和利用能量的重要途径。回答下列问题:
20. 化学反应的热效应是人类获取和利用能量的重要途径。回答下列问题: (1)、图甲表示某反应的能量变化关系,其ΔH =(用含E1、E2的代数式表示),图乙表示物质的转化路径,则ΔH 3=。(2)、已知反应:S(g)+O2(g)=SO2(g) ΔH1 ;S(s)+O2(g)=SO2(g) ΔH2 , 比较ΔH1ΔH2(填“>”“<”或“=”)。(3)、在101kPa时,氢气在1mol氧气中完全燃烧,生成2mol液态水,放出571.6kJ的热量,表示氢气燃烧热的热化学方程式为。(4)、已知相关共价键的键能数据如下表:。
(1)、图甲表示某反应的能量变化关系,其ΔH =(用含E1、E2的代数式表示),图乙表示物质的转化路径,则ΔH 3=。(2)、已知反应:S(g)+O2(g)=SO2(g) ΔH1 ;S(s)+O2(g)=SO2(g) ΔH2 , 比较ΔH1ΔH2(填“>”“<”或“=”)。(3)、在101kPa时,氢气在1mol氧气中完全燃烧,生成2mol液态水,放出571.6kJ的热量,表示氢气燃烧热的热化学方程式为。(4)、已知相关共价键的键能数据如下表:。共价键
H-H
C-H
C-C
C=C
键能/ kJ·mol-1
436
413
344
614
则 C2H6(g)
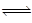 C2H4(g)+H2(g)的ΔH =___________(填字母)。A、+120 kJ·mol-1 B、+46 kJ·mol-1 C、-120 kJ·mol-1 D、-46 kJ·mol-1(5)、温室气体减排是全世界关注的热点问题。CH4-CO2的催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。
C2H4(g)+H2(g)的ΔH =___________(填字母)。A、+120 kJ·mol-1 B、+46 kJ·mol-1 C、-120 kJ·mol-1 D、-46 kJ·mol-1(5)、温室气体减排是全世界关注的热点问题。CH4-CO2的催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。CH4-CO2催化重整反应为:CH4(g)+CO2(g)
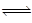 2CO(g)+2H2(g) ΔH 。
2CO(g)+2H2(g) ΔH 。已知:
C(s)+2H2(g)=CH4(g) ΔH =-75 kJ·mol-1
C(s)+O2(s)=CO2(g) ΔH =-394 kJ·mol-1l
C(s)+1/2O2(g)=CO(g) ΔH =-111 kJ·mol-1
O2(g)+2H2(g)=2H2O(l) ΔH =-571.6 kJ·mol-1
则CH4-CO2催化重整反应的ΔH = kJ·mol-1。
21. 合成氨工业对国民经济和社会发展具有重要的意义,其原理为:N2(g)+3H2(g) 2NH3(g) ΔH=-92 kJ·mol-1;据此回答以下问题:
2NH3(g) ΔH=-92 kJ·mol-1;据此回答以下问题: 实验室中模拟合成氨反应,在恒容密闭容器中,初始投入量相等的条件下,得到三组实验数据如表所示:
实验序号
温度(℃)
H2浓度(mol/L)
0 min
10 min
20 min
30 min
40min
50min
60 min
1
300
2.00
1.70
1.50
L36
1.25
1.20
1.20
2
300
2.00
1.50
1.28
1.20
1.20
1.20
1.20
3
200
2.00
1.60
1.39
1.29
1.27
1.27
1.27
(1)、实验1中,50 min时向容器中充入一定量He,则正反应速率(填“增大”、“减小”或“不变”)(2)、实验2中,前20min内以NH3的浓度变化表示的化学反应速率为。(3)、比较实验1和2,说明实验2隐含 条件是。 (4)、上述三组实验的化学中衡常数分别为K1、K2、K3 , 三者大小关系是。(5)、某温度下,若把10molN2 , 与30molH2置于体积为10 L的密闭容器内,反应达到平衡状态时,测得混合气体的压强变为开始时的0.8,则平衡时氢气的转化率为。(用百分数表示)。能说明该反应达到化学平衡状态的是(填字母)。
条件是。 (4)、上述三组实验的化学中衡常数分别为K1、K2、K3 , 三者大小关系是。(5)、某温度下,若把10molN2 , 与30molH2置于体积为10 L的密闭容器内,反应达到平衡状态时,测得混合气体的压强变为开始时的0.8,则平衡时氢气的转化率为。(用百分数表示)。能说明该反应达到化学平衡状态的是(填字母)。a.容器内压强保持不变。 b.容器内的密度保持不变
c.混合气体中c(NH3)不变 d.V正(N2)=2V逆(NH3)
(6)、对于合成氨反应而言,下列有关图像一定正确的是 (选填序号)。A、 B、
B、 C、
C、 22. 氢气是一种清洁高效的新型能源,如何经济实用的制取氢气成为重要课题。
22. 氢气是一种清洁高效的新型能源,如何经济实用的制取氢气成为重要课题。H2S可用于高效制取氢气,发生的反应为:2H2S(g)
 S2(g)+2H2(g)(1)、若起始时容器中只有H2S,平衡时三种物质的物质的量与裂解温度的关系如下左图。
S2(g)+2H2(g)(1)、若起始时容器中只有H2S,平衡时三种物质的物质的量与裂解温度的关系如下左图。

①图中曲线Y表示的物质是(填化学式)。
②C点时混合气体总物质的量为。
③若起始时容器中H2S的浓度为1.0mol/L,则A点的平衡常数K=。
(2)、若在两个等体积的恒容密闭容器中分别加入2.0mol H2S、1.0mol H2S,测得不同温度下H2S的平衡转化率如上右图所示。①H2S的裂解反应是(填“吸热”、“放热”)反应。
图中代表加入2.0mol H2S的曲线是(填代码)。
A.M点所在曲线 B.N、O点所在曲线
②M点、O点和N点的逆反应速率V(M)、V(O)和V(N)最慢的是。