安徽省黄山市2021-2022学年九年级上学期期末化学试题
试卷更新日期:2022-10-14 类型:期末考试
一、单选题
-
1. 下列过程中涉及化学变化的是( )A、烟花绽放
 B、民间剪纸
B、民间剪纸 C、雕刻蛋壳
C、雕刻蛋壳 D、纸张粉碎
D、纸张粉碎 2. 2021年3月22日—28日是第34届中国水周。关心水、爱惜水、保护水是永恒的主题。下列关于水的说法正确的是( )A、地球上可供利用的淡水资源是取之不尽,用之不竭的 B、工业废水不经处理就可任意排放 C、湘江水通过沉淀、过滤、吸附,可得到纯净的水 D、可用肥皂水来区分软水和硬水3. 下列实验操作正确的是( )A、加热高锰酸钾制氧气
2. 2021年3月22日—28日是第34届中国水周。关心水、爱惜水、保护水是永恒的主题。下列关于水的说法正确的是( )A、地球上可供利用的淡水资源是取之不尽,用之不竭的 B、工业废水不经处理就可任意排放 C、湘江水通过沉淀、过滤、吸附,可得到纯净的水 D、可用肥皂水来区分软水和硬水3. 下列实验操作正确的是( )A、加热高锰酸钾制氧气 B、铁丝在氧气
B、铁丝在氧气 C、检验装置气密性
C、检验装置气密性 D、收集CO2气体
D、收集CO2气体 4. 下列的化学符号表示2个分子的是( )A、N2 B、2H C、2Na+ D、2H2O5. 如图是某原子的结构示意图和对应元素在元素周期表中的信息。下列说法错误的是( )
4. 下列的化学符号表示2个分子的是( )A、N2 B、2H C、2Na+ D、2H2O5. 如图是某原子的结构示意图和对应元素在元素周期表中的信息。下列说法错误的是( )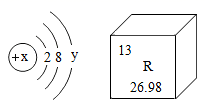 A、x为13 B、该原子易失去电子 C、该元素为非金属元素 D、该元素位于元素周期表的第三周期6. 下列对客观事实的解释正确的是( )
A、x为13 B、该原子易失去电子 C、该元素为非金属元素 D、该元素位于元素周期表的第三周期6. 下列对客观事实的解释正确的是( )选项
事实
解释
A
将煤进行粉碎后更容易燃烧
粉碎的目的是增大与氧气的接触面积
B
Fe、Fe2+、Fe3+化学性质不同
微粒中的质子数不同
C
过氧化氢溶液可以制取氧气
过氧化氢溶液中有氧分子
D
物体有热胀冷缩现象
构成物质的粒子大小随温度而改变
A、A B、B C、C D、D7. 葡萄中含有丰富的叶酸,对防癌、抗癌有积极作用,其化学式为C19H19N7O6 , 下列有关叶酸的说法正确的是( )A、叶酸的相对分子质量为441g B、叶酸中碳、氢、氮、氧四种元素的质量比为19:19:7:6 C、叶酸中氮元素的质量分数大于氧元素的质量分数 D、叶酸由19个碳原子、19个氢原子、7个氮原子和6个氧原子构成8. 某种催化剂可将汽车尾气中的一氧化碳、二氧化氮转化为两种空气中的无毒成分,反应的微观示意图如下。下列说法正确的是( ) A、四种物质均属于化合物 B、物质丁由原子构成 C、参加反应的甲与生成的丁的分子个数比为2:1 D、参加反应的甲与乙的质量比为1:29. 逻辑推理是化学学习常用的方法,以下推理正确的是( )A、二氧化碳不可燃不助燃,则使燃着木条熄灭的气体一定是二氧化碳 B、化学变化过程中会有气体产生,有气体产生的变化不一定是化学变化 C、氧气具有助燃性,氧气可用作火箭发射的燃料 D、燃烧都伴随着发光、发热的现象,则有发光、发热现象的一定是燃烧10. 水在化学实验中的作用不可忽视,如图实验解释错误的是( )
A、四种物质均属于化合物 B、物质丁由原子构成 C、参加反应的甲与生成的丁的分子个数比为2:1 D、参加反应的甲与乙的质量比为1:29. 逻辑推理是化学学习常用的方法,以下推理正确的是( )A、二氧化碳不可燃不助燃,则使燃着木条熄灭的气体一定是二氧化碳 B、化学变化过程中会有气体产生,有气体产生的变化不一定是化学变化 C、氧气具有助燃性,氧气可用作火箭发射的燃料 D、燃烧都伴随着发光、发热的现象,则有发光、发热现象的一定是燃烧10. 水在化学实验中的作用不可忽视,如图实验解释错误的是( )
 A、实验I量筒中水:通过水体积的变化得到氧气体积 B、实验Ⅱ集气瓶中水:防止集气瓶炸裂 C、实验Ⅲ烧杯中水:作为反应物 D、实验IV烧杯中水:只为了提供热量11. 建立模型是学习化学的重要方法,下列模型正确的是( )A、地壳中元素含量模型
A、实验I量筒中水:通过水体积的变化得到氧气体积 B、实验Ⅱ集气瓶中水:防止集气瓶炸裂 C、实验Ⅲ烧杯中水:作为反应物 D、实验IV烧杯中水:只为了提供热量11. 建立模型是学习化学的重要方法,下列模型正确的是( )A、地壳中元素含量模型 B、反应类型关系模型
B、反应类型关系模型 C、灭火原理模型
C、灭火原理模型 D、空气组成模型
D、空气组成模型 12. 用如图"微型"实验装置制取一氧化碳并还原氧化铜。下列说法错误的是( )
12. 用如图"微型"实验装置制取一氧化碳并还原氧化铜。下列说法错误的是( )
资料:①HCOOH(甲酸) H2O+CO↑;②CuO+CO Cu+CO2。
A、反应①属于分解反应 B、反应②中各元素的化合价均改变 C、反应过程中 a处黑色固体变红 D、气球的作用是收集一氧化碳,防止其污染大气二、科普阅读题
-
13. 阅读下列短文,回答问题:
农作物秸秆直接还田,埋伏地下的秸秆会产生热量、制造厌氧的环境,不利于作物的生长。如何变废为宝,是众多科学家和工程师努力的目标。
秸秆回收后,对其进行粉碎、酸碱、加热、气爆处理,破坏包裹在纤维素外的半纤维素和木质素。然后,利用热纤梭菌将纤维最终水解成葡萄糖,再用酿酒酵母将糖发酵成乙醇。
生物乙醇制备完成后,再与汽油按照1:9的比例混合,制成车用乙醇汽油。目前,我国一些地区基本实现了车用乙醇汽油替代普通汽油。
(1)、车用乙醇汽油属于(填“混合物”或“纯净物”)。(2)、下列说法正确的是____。A、利用秸秆制备生物乙醇过程能“变废为宝”,体现化学学科价值 B、使用乙醇汽油可一定程度减少大气污染 C、使用乙醇汽油可一定程度节省石油资源(3)、农作物秸秆制取生物乙醇,具有不与人争粮、不与粮争地的强大优势。写出乙醇完全燃烧时反应化学方程式 , 检验乙醇完全燃烧产物中含碳化合物的方法(用化学方程式表示)。(4)、在下图所示的标志中,张贴在加油站合理的是____。A、 B、
B、 C、
C、 D、
D、
三、综合题
-
14. 下图是实验室制取气体的一些装置,据图回答下列有关问题。

(友情提示:以下所选装置均填装置序号)
(1)、写出指定仪器的名称:①;②。(2)、写出用装置B制取氧气的化学方程式;要收集较纯净氧气,最好选择装置来收集。(3)、实验室在常温下用块状“电石”固体与水反应制取微溶于水的乙炔气体(化学式为C2H2),该反应必须严格控制加水速度,以免剧烈反应放出的热引起发生装置炸裂。你认为上图中最适合制取乙炔气体的发生装置是;如果用如图所示装置收集乙炔,气体应从(填“a”或“b”)端管口进入。 15. 利用空气制取氮肥的流程如图所示:
15. 利用空气制取氮肥的流程如图所示: (1)、I中是利用氧气和氮气的沸点不同分离液态空气,发生的是(填“物理变化”或“化学变化”)(2)、单质X是一种常见气体,其化学式是。(3)、反应Ⅱ的基本反应类型是(填“化合反应”或“分解反应”)。(4)、Ⅲ中催化剂在化学反应前后和不变。(5)、写出反应IV的化学方程式是。16. 某学习小组对二氧化碳展开了一系列的探究。(1)、(一)验证CO2性质
(1)、I中是利用氧气和氮气的沸点不同分离液态空气,发生的是(填“物理变化”或“化学变化”)(2)、单质X是一种常见气体,其化学式是。(3)、反应Ⅱ的基本反应类型是(填“化合反应”或“分解反应”)。(4)、Ⅲ中催化剂在化学反应前后和不变。(5)、写出反应IV的化学方程式是。16. 某学习小组对二氧化碳展开了一系列的探究。(1)、(一)验证CO2性质下图是验证CO2性质的实验装置。实验时,持续通入CO2步骤I:打开K1 , 关闭K2 , 观察现象。步骤Ⅱ:关闭K1 , 打开K2 , 加热水,一段时间后,观察现象。

步骤I:烧杯中的现象为 , 说明CO2具有的化学性质是。
(2)、步骤Ⅱ:一段时间后,观察到试管I、Ⅱ中的实验现象是 , 由此证明了二氧化碳具有的化学性质是(用化学方程式表示)。(3)、(二)探究是否可用排水集气法收集到CO2。利用传感器对是否可用排水集气法收集到CO2展开探究,实验装置如图1所示:

实验步骤如下:
①按实验装置图1组装仪器。
②用压强传感器自带的注射器通过活塞A向三颈烧瓶注入50mL空气,并一直压住注射器,若压强传感器的读数 , 证明装置气密性良好。
③打开活塞A,将注射器中的稀盐酸迅速注入仪器b中,反应一段时间后,用放在A处进行验满,收集满后迅速关闭活塞A,并用止水夹夹住导气管B处。
④用压强传感器自带的注射器通过活塞A向三颈烧瓶中注入15mLH2O,观察两分钟之内体系的压强变化如图2所示。
(4)、【总结与拓展】图2中30s后体系的压强瞬间增大,之后到100s之间压强又逐渐减小的原因是。
(5)、经过测算,消耗CO2的量约为收集到的CO2总量的0.53%,因此排水集气法(填“可以”或“不可以”)收集到CO2气体。(6)、量变引起质变,6克碳与a克氧气在密闭容器中充分燃烧生成的气体既有二氧化碳又有一氧化碳,求a的取值范围。四、计算题
-
17. 某兴趣小组对石灰石样品进行如下实验分析:取12克样品放入烧杯中,将75克稀盐酸分3次加入烧杯中,充分反应后(杂质不溶于水,也不与酸反应),测得剩余固体的质量记录如下。请计算:
次数
1
2
3
加入稀盐酸的质量/g
25
25
25
剩余固体的质量/g
8
4
2
(1)、样品中碳酸钙的质量为。(2)、生成的二氧化碳的质量为多少克?
-