河北省廊坊市2021-2022学年上学期高三年级9月调研考试化学试题
试卷更新日期:2022-10-14 类型:月考试卷
一、单选题
-
1. 化学知识无处不在,下列与古诗文记载对应的化学知识错误的是( )
常见古诗文记载
化学知识
A
《泉州府志》:元时南安有黄长者为宅煮糖,宅垣忽坏,去土而糖白,后人遂效之。
泥土具有吸附作用,能将红糖变白糖
B
《荀子·劝学》:冰水为之,而寒于水。
冰的能量低于水,冰变为水属于吸热反应
C
《本草纲目》:采蒿蓼之属,晒干烧灰,以原水淋汁,久则凝淀如石(石碱),浣衣发面。
石碱具有碱性,遇酸产生气体
D
《天工开物》:凡研硝(KNO3)不以铁碾入石臼,相激火生,祸不可测。
性质不稳定,撞击易爆炸
A、A B、B C、C D、D2. 下列有关化学用语正确的是( )A、NaOH的电子式: B、I4O9(碘酸碘)中碘的化合价为+1、+5
C、NH5的结构与NH4Cl相似,NH5的结构式为
B、I4O9(碘酸碘)中碘的化合价为+1、+5
C、NH5的结构与NH4Cl相似,NH5的结构式为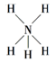 D、离子结构示意图
D、离子结构示意图 可以表示35Cl- , 也可以表示37Cl-
3. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、1 mol Na2O2与水完全反应后的溶液中所含的NaOH分子数为2NA B、28 g N2与CO的混合物中含有的电子总数为14NA C、1.0 L 1.0 mol·L-1 AlCl3溶液中所含Al3+的数目为NA D、34 g H2O2中含有非极性共价键的数目为2NA4. 由一种阳离子与两种酸根离子组成的盐称为混盐。向混盐CaOCl2中加入足量浓硫酸,可发生反应:CaOCl2 +H2SO4(浓)=CaSO4 +Cl2↑+H2O。下列说法错误的是(NA表示阿伏加德罗常数的值)( )A、混盐CaOCl2 中既含离子键又含共价键 B、浓硫酸体现氧化性与酸性 C、每产生1mol氯气,转移电子数为NA D、1mol混盐CaOCl2中含有离子数为3NA5. 下列由实验得出的结论正确的是( )
可以表示35Cl- , 也可以表示37Cl-
3. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、1 mol Na2O2与水完全反应后的溶液中所含的NaOH分子数为2NA B、28 g N2与CO的混合物中含有的电子总数为14NA C、1.0 L 1.0 mol·L-1 AlCl3溶液中所含Al3+的数目为NA D、34 g H2O2中含有非极性共价键的数目为2NA4. 由一种阳离子与两种酸根离子组成的盐称为混盐。向混盐CaOCl2中加入足量浓硫酸,可发生反应:CaOCl2 +H2SO4(浓)=CaSO4 +Cl2↑+H2O。下列说法错误的是(NA表示阿伏加德罗常数的值)( )A、混盐CaOCl2 中既含离子键又含共价键 B、浓硫酸体现氧化性与酸性 C、每产生1mol氯气,转移电子数为NA D、1mol混盐CaOCl2中含有离子数为3NA5. 下列由实验得出的结论正确的是( )选项
实 验
实验结论或解释
A
向2mL 0.1mol/L FeCl3溶液中滴加0.1mol/L KI溶液5~6滴,充分反应后,再滴加几滴0.01mol/L KSCN溶液,出现血红色溶液。
Fe3+与I-之间的反应属于可逆反应
B
探究温度对硫代硫酸钠与硫酸反应速率的影响时,若先将两种溶液混合并计时,再用水浴加热至设定温度
则测得的反应速率偏高
C
分别向装有2mL 0.1mol/L H2C2O4溶液和2mL 0.2mol/L H2C2O4溶液的两支试管中加入4mL 0.01mol/L酸性KMnO4溶液,振荡,后者溶液先褪色。
探究浓度对反应速率的影响
D
将石灰石与盐酸反应产生的气体直接通入水玻璃中,生成白色沉淀
非金属性: C >Si
A、A B、B C、C D、D6. 对于下列实验,能正确描述其反应的离子方程式是( )A、用Na2SO3溶液吸收少量Cl2: B、向CaCl2溶液中通入CO2: C、向H2O2溶液中滴加少量FeCl3: D、同浓度同体积NH4HSO4溶液与NaOH溶液混合:7. 工业上,可采用还原法处理尾气中NO,其原理:2NO(g)+2H2(g)N2(g)+2H2O(g) △H<0。在化学上,正反应速率方程式表示为v(正)=k(正)·cm(NO)·cn(H2),逆反应速率方程式表示为v(逆)=k(逆)·cx(N2)·cy(H2O),其中,k表示反应速率常数,只与温度有关,m,n,x,y叫反应级数,由实验测定。在恒容密闭容器中充入NO、H2 , 在T℃下进行实验,测得有关数据如下:实验
c(NO)/mol·L-1
c(H2)/mol·L-1
v(正)/mol·L-1·min-1
①
0.10
0.10
0.414k
②
0.10
0.40
1.656k
③
0.20
0.10
1.656k
下列有关推断正确的是( )
A、上述反应中,正反应活化能大于逆反应活化能 B、若升高温度,则k(正)增大,k(逆)减小 C、在上述反应中,反应级数:m=2,n=1 D、在一定温度下,NO、H2的浓度对正反应速率影响程度相同8. T ℃时,在一固定容积的密闭容器中发生反应:A(g)+B(g) C(s) ΔH<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是( )
C(s) ΔH<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是( )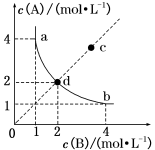 A、T ℃时,该反应的平衡常数值为4 B、c点没有达到平衡,此时反应向逆向进行 C、若c点为平衡点,则此时容器内的温度高于T ℃ D、T ℃时,直线cd上的点均为平衡状态9. 下列实验操作能达到实验目的的是( )
A、T ℃时,该反应的平衡常数值为4 B、c点没有达到平衡,此时反应向逆向进行 C、若c点为平衡点,则此时容器内的温度高于T ℃ D、T ℃时,直线cd上的点均为平衡状态9. 下列实验操作能达到实验目的的是( ) A、图甲装置可证明非金属性强弱:S>C>Si B、图乙装置可用于检验有乙烯生成 C、图丙装置可通过蒸干AlCl3饱和溶液制备AlCl3晶体 D、图丁装置可用来测定中和热10. 某废催化剂含SiO2、ZnS、CuS及少量的Fe3O4。某实验小组以该废催化剂为原料,回收锌和铜,设计实验流程如图。下列说法正确的是( )
A、图甲装置可证明非金属性强弱:S>C>Si B、图乙装置可用于检验有乙烯生成 C、图丙装置可通过蒸干AlCl3饱和溶液制备AlCl3晶体 D、图丁装置可用来测定中和热10. 某废催化剂含SiO2、ZnS、CuS及少量的Fe3O4。某实验小组以该废催化剂为原料,回收锌和铜,设计实验流程如图。下列说法正确的是( )
注:CuS既不溶于稀硫酸,也不与稀硫酸反应
A、步骤①中,生成的气体可用CuSO4溶液吸收 B、步骤②中的加热操作需维持在较高温度下进行,以加快反应速率 C、滤渣2成分只有SiO2 D、检验滤液1中是否含有Fe2+ , 可以先加新制氯水再加KSCN11. 交叉偶联的反应机理如图,图中R为烃基,Ph为苯基。下列说法错误的是( ) A、●CH2R是反应的中间体 B、循环产物Ni呈现的化合价有3种 C、反应过程中Ni的成键数目发生变化 D、交叉偶联的总反应为RCH2I+PhI+Mn PhCH2R+MnI2
A、●CH2R是反应的中间体 B、循环产物Ni呈现的化合价有3种 C、反应过程中Ni的成键数目发生变化 D、交叉偶联的总反应为RCH2I+PhI+Mn PhCH2R+MnI2二、多选题
-
12. 短周期元素X、Y、Z、M原子序数依次增大,它们组成一种团簇分子,结构如图所示。X、M的族序数均等于周期序数,Y原子核外最外层电子数是其电子总数的。下列说法正确的是( )
 A、简单离子半径:Y>Z>M B、常温下Z和M的单质均能溶于浓硝酸 C、X+与Y结合形成的化合物是离子晶体 D、Z的最高价氧化物的水化物碱性强于M的最高价氧化物的水化物碱性13. CO2催化重整CH4的反应:(Ⅰ)CH4(g)+CO2(g) 2CO(g)+2H2(g);ΔH1 ,
A、简单离子半径:Y>Z>M B、常温下Z和M的单质均能溶于浓硝酸 C、X+与Y结合形成的化合物是离子晶体 D、Z的最高价氧化物的水化物碱性强于M的最高价氧化物的水化物碱性13. CO2催化重整CH4的反应:(Ⅰ)CH4(g)+CO2(g) 2CO(g)+2H2(g);ΔH1 ,主要副反应:(Ⅱ)H2(g)+CO2(g) CO(g)+H2O(g);ΔH2>0,
(Ⅲ)4H2(g)+CO2(g) CH4(g)+2H2O(g);ΔH3<0。
在恒容反应器中按体积分数V(CH4)∶V(CO2)=50%∶50%充入气体,加入催化剂,测得反应器中平衡时各物质的体积分数与温度的关系如图所示。下列说法正确的是( )
 A、ΔH1=2ΔH2-ΔH3<0 B、其他条件不变,适当增大起始时V(CH4)∶V(CO2),可抑制副反应(Ⅱ)、(Ⅲ)的进行 C、300~580℃时,H2O的体积分数不断增大,是由于反应(Ⅲ)生成H2O的量大于反应(Ⅱ)消耗的量 D、T℃时,在2.0L容器中加入2mol CH4、2mol CO2以及催化剂进行重整反应,测得CO2的平衡转化率为75%,则反应(Ⅰ)的平衡常数小于81
A、ΔH1=2ΔH2-ΔH3<0 B、其他条件不变,适当增大起始时V(CH4)∶V(CO2),可抑制副反应(Ⅱ)、(Ⅲ)的进行 C、300~580℃时,H2O的体积分数不断增大,是由于反应(Ⅲ)生成H2O的量大于反应(Ⅱ)消耗的量 D、T℃时,在2.0L容器中加入2mol CH4、2mol CO2以及催化剂进行重整反应,测得CO2的平衡转化率为75%,则反应(Ⅰ)的平衡常数小于81三、综合题
-
14. 有反应N2(g)+3H2(g) 2NH3(g) ΔH<0,(1)、在恒温恒压条件下进行,能判断反应处于平衡状态的是____;A、单位时间内生成1 mol N2 , 同时生成3 mol NH3 B、单位时间内生成3 mol H2 , 同时生成6 mol N-H键 C、混合气体的密度不再随时间而改变 D、容器中气体的压强不再随时间而改变 E、容器中气体的平均分子质量不再随时间而改变(2)、一定温度下某恒容密闭容器中,充入3 mol H2和1 mol N2 , 2 min达到平衡状态时,总气体的物质的量变为原来0.9倍,则此时N2转化率为;若此时放出的热量为18.44 kJ,则其热化学方程式为;根据所求出的热化学方程式,且已知1 mol氮氮三键断裂需要945.8 kJ的能量,1 mol氢氢键断裂需要436 kJ的能量,求1 mol N-H键断裂吸收的能量。(3)、氨气可用作碱性燃料电池的燃料,电池反应为4NH3+3O2═2N2+6H2O,则氨燃料电池的负极电极反应为。15. “氢能”将是未来最理想的新能源。(1)、实验测得,lg氢气燃烧生成液态水放出142.9 kJ热量,则氢气燃烧热的热化学方程式为:____(填序号)A、2H2(g)+O2(g)=2H2O(l) △H=-142.9kJ/mol B、H2(g)+O2(g)=H2O(l) △H=-285.8kJ/mol C、2H2+O2=2H2O(l) △H=-571.6 kJ/mol D、H2(g)+O2(g)=H2O(g) △H=-285.8 kJ/mol(2)、某化学家根据“原子经济”的思想,设计了如下制备H2的反应步骤:
①CaBr2+H2O CaO+2HBr ②2HBr+HgHgBr2+H2
③HgBr2+__ +_ ④2HgO2Hg+O2↑
请你根据“原子经济”的思想完成上述步骤③的化学方程式:HgBr2+__+_。
请根据“绿色化学”的思想评估该方法制H2的主要缺点:。
(3)、利用核能把水分解制氢气,是目前正在研究的课题。如图图是其中的一种流程,其中用了过量碘。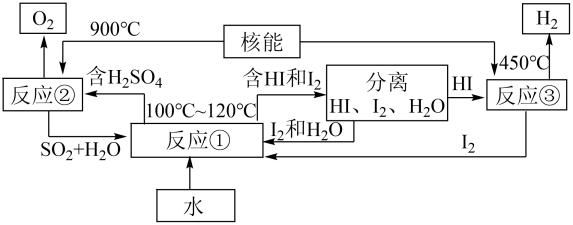
请写出化学方程式:
反应①。反应②。
(4)、氢气通常用生产水煤气的方法制得。其中CO(g)+ H2O(g) CO2(g)+ H2(g) ;△H<0,在850℃时,平衡常数K=1。若升高温度到950℃时,达到平衡时K1(填“>”“<”或“=”)
(5)、850℃时,若向一容积可变的密闭容器中同时充入 1.0 mol CO、3.0molH2O、1.0mol CO2 和x molH2 , 则:①当x=5.0时,上述平衡向(填正反应或逆反应)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是。
(6)、在850℃时,若设x=5.0 mol和x=6.0mol,其它物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a b(填“大小”、“小于”或“等于”)。16. 通过废旧的钴酸锂电池可以回收金属铝、锂和钴。其生产流程如下所示:
已知:①钴酸锂电池正极材料为LiCoO2、炭黑及铝片;②。回答下列问题:
(1)、电池“预处理”时需要将电池完全放电,原因是。(2)、不溶性的LiCoO2在“浸取、还原”过程中发生反应的离子方程式为 .(3)、若溶液中离子浓度为时。认为完全沉淀。则Al 完全沉淀时溶液的pH至少为。(4)、P2O4是磷酸酯类,密度比水小。是该实验的萃取剂。通过“反萃取”,可以循环利用。下列关于“萃取”的说法正确的是(填字母代号)。a.使用一定量P2O4萃取时应该将萃取剂分多次萃取,萃取效率更高
b.分液漏斗使用前一定要检验是否漏液
c.振荡过程中,需要打开活塞放气
d.萃取后分液时需要先旋开活塞,再打开上端玻璃塞
(5)、“反萃取”时不宜加入烧碱溶液的原因是。反萃取时获取P2O4的操作方法是。(6)、CoC2O4是制备钴的重要原料。取18.3g CoC2O4·2HO在空气中受热的质量变化曲线如图所示。已知曲线中温度高于或等于300℃时所得固体为不同的钴氧化物。写出B→C点发生反应的化学方程式:。 17. 常温常压下,一氧化二氯(Cl2O)为棕黄色气体,沸点为3.8℃,42℃以上分解生成Cl2和O2 , Cl2O易溶于水并与水反应生成HClO。(1)、[制备产品]
17. 常温常压下,一氧化二氯(Cl2O)为棕黄色气体,沸点为3.8℃,42℃以上分解生成Cl2和O2 , Cl2O易溶于水并与水反应生成HClO。(1)、[制备产品]将氯气和空气(不参与反应)按体积比1:3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O(不含Cl2)制备次氯酸溶液。
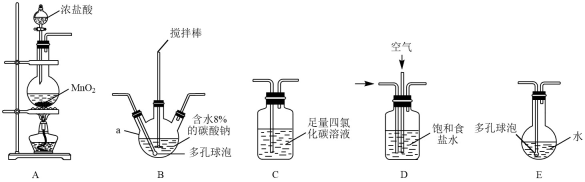
各装置的连接顺序为→→→C→;(填字母)
(2)、装置B中多孔球泡和搅拌棒的作用是;装置C的作用是;(3)、制备Cl2O的化学方程式为;(4)、此方法相对于用氯气直接溶于水制备次氯酸溶液的主要优点是;(5)、反应过程中,装置B需放在中:(选填“冷水”或“热水”)(6)、[测定浓度]已知次氯酸可被FeSO4等物质还原。用下列实验方案测定装置E所得溶液中次氯酸的物质的量浓度:量取10 mL上述次氯酸溶液,并稀释至100 mL,再从中取出10.00 mL于锥形瓶中,并加入10.00 mL 0.8 mol/L的FeSO4溶液,充分反应后,用0.05000 mol/L的酸性KMnO4溶液滴定至终点,消耗KMnO4溶液24.00 mL,则原次氯酸的物质的量浓度为。(保留四位有效数字)