河北省保定市2022-2023学年高三上学期9月份考试化学试题
试卷更新日期:2022-10-14 类型:月考试卷
一、单选题
-
1. 2022世界人工智能大会于9月1日在上海举行,其主题为“智联世界元生无界”。下列在人工智能领域应用广泛的材料中属于金属材料的是( )A、聚偏氟乙烯人工皮肤 B、氮化硼半导体陶瓷 C、可降解硅酸铝陶瓷纤维 D、钛镍形状记忆合金2. 国际学术期刊《科学》发表了我国科学家在实验室里首次实现以二氧化碳为原料经过11步反应人工合成淀粉的论文,合成效率是传统农业生产淀粉效率的8.5倍左右,其中第3步反应的化学方程式为3

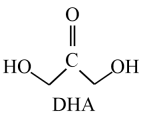 。下列有关说法错误的是( ) A、淀粉属于糖类 B、镉(Cd)与钛(Ti)均属于过渡金属元素 C、DHA与果糖互为同系物 D、上述反应属于加成反应3. “夏禹铸九鼎,天下分九州”,青铜器在古时被称为“吉金”,是红铜与锡、铅等的合金。铜锈大多呈青绿色,主要含有Cu2(OH)3Cl和Cu2(OH)2CO3。下列说法错误的是( )A、青铜器中锡、铅对铜有保护作用 B、青铜的熔点低于纯铜 C、Cu2(OH)3Cl和Cu2(OH)2CO3都属于盐类 D、可用FeCl3溶液浸泡青铜器来清洗青铜器的铜锈4. 标准状况下,在甲室中充入25.5gNH3与17gH2的混合气体,乙室中充入HCl与N2的混合气体,静止时活塞位置如图。已知乙室中气体的质量比甲室中气体的质量多123g。将活塞a去掉,当HCl与NH3完全反应后,活塞b将静止于刻度的位置是( )
。下列有关说法错误的是( ) A、淀粉属于糖类 B、镉(Cd)与钛(Ti)均属于过渡金属元素 C、DHA与果糖互为同系物 D、上述反应属于加成反应3. “夏禹铸九鼎,天下分九州”,青铜器在古时被称为“吉金”,是红铜与锡、铅等的合金。铜锈大多呈青绿色,主要含有Cu2(OH)3Cl和Cu2(OH)2CO3。下列说法错误的是( )A、青铜器中锡、铅对铜有保护作用 B、青铜的熔点低于纯铜 C、Cu2(OH)3Cl和Cu2(OH)2CO3都属于盐类 D、可用FeCl3溶液浸泡青铜器来清洗青铜器的铜锈4. 标准状况下,在甲室中充入25.5gNH3与17gH2的混合气体,乙室中充入HCl与N2的混合气体,静止时活塞位置如图。已知乙室中气体的质量比甲室中气体的质量多123g。将活塞a去掉,当HCl与NH3完全反应后,活塞b将静止于刻度的位置是( ) A、11 B、12 C、13 D、145. 利用下列装置(夹持装置略)进行实验,不能达到实验目的的是( )
A、11 B、12 C、13 D、145. 利用下列装置(夹持装置略)进行实验,不能达到实验目的的是( )A
B
C
D




制备氢氧化亚铁沉淀
比较KMnO4、Cl2、S的氧化性
制备无水MgCl2
用CCl4萃取碘水中的碘并分液
A、A B、B C、C D、D6. 在给定条件下,下列选项所示物质间不满足每一步转化均能实现的是( )A、Na2O2Na2SO3FeSO4 B、Cu2SSO2H2SO4 C、AlNaAlO2Al(OH)3 D、Fe(s)Fe3O4(s)Fe(NO3)3(aq)7. 氟锑酸(HSbF6)属于超强酸,其酸性比纯硫酸还要强2×1019倍,实验室常以SbCl3、Cl2和HF为原料通过反应SbCl3+Cl2=SbCl5、SbCl5+6HF=HSbF6+5HCl制备。制备SbCl5的实验装置如图所示。已知:SbCl3的熔点为73.4℃,沸点为220.3℃,易水解;SbCl5的熔点为3.5℃,液态SbCl5在140℃时发生分解,2.9kPa下沸点为79℃,也易水解。下列说法错误的是( ) A、装置I中的b为冷凝水的出水口 B、装置II可吸收Cl2和空气中的水蒸气 C、由SbCl5制备HSbF6时,不能选用玻璃仪器 D、SbCl5制备完成后,可直接常压蒸馏分离出SbCl58. 已知NA为阿伏加德罗常数的值。下列说法正确的是( )A、标准状况下,3.36LHF中含有的质子数为1.5NA B、向0.4mol•L-1的NH4Cl溶液中通入NH3至中性,溶液中的数目为0.4NA C、标准状况下,6.72L氯气与足量热的NaOH溶液充分反应生成H2O、NaCl和NaClO3时,转移的电子数为0.5NA D、用铜作电极电解饱和NaCl溶液,当电路中通过0.2mole-时,阴、阳两极产生的气体分子总数为0.2NA9. 短周期主族元素R、X、Y、Z的原子序数依次增大,Y原子最外层电子数等于最内层电子数的一半。某物质(M)由R、X、Z三种元素组成,它的结构式如图所示。下列推断错误的是( )
A、装置I中的b为冷凝水的出水口 B、装置II可吸收Cl2和空气中的水蒸气 C、由SbCl5制备HSbF6时,不能选用玻璃仪器 D、SbCl5制备完成后,可直接常压蒸馏分离出SbCl58. 已知NA为阿伏加德罗常数的值。下列说法正确的是( )A、标准状况下,3.36LHF中含有的质子数为1.5NA B、向0.4mol•L-1的NH4Cl溶液中通入NH3至中性,溶液中的数目为0.4NA C、标准状况下,6.72L氯气与足量热的NaOH溶液充分反应生成H2O、NaCl和NaClO3时,转移的电子数为0.5NA D、用铜作电极电解饱和NaCl溶液,当电路中通过0.2mole-时,阴、阳两极产生的气体分子总数为0.2NA9. 短周期主族元素R、X、Y、Z的原子序数依次增大,Y原子最外层电子数等于最内层电子数的一半。某物质(M)由R、X、Z三种元素组成,它的结构式如图所示。下列推断错误的是( ) A、原子半径:Y>Z B、X和R组成的化合物不可能使溴水褪色 C、M中含极性键和非极性键 D、Y的最高价氧化物对应的水化物是强碱10. 实验室中利用洁净的铜片和浓硫酸进行如图实验,经检测,所得固体中含有Cu2S和白色物质X,下列说法错误的是( )
A、原子半径:Y>Z B、X和R组成的化合物不可能使溴水褪色 C、M中含极性键和非极性键 D、Y的最高价氧化物对应的水化物是强碱10. 实验室中利用洁净的铜片和浓硫酸进行如图实验,经检测,所得固体中含有Cu2S和白色物质X,下列说法错误的是( ) A、白色物质X为CuSO4 B、微热5min待Cu反应结束后,转移电子的物质的量为0.48mol C、放出的NO在标准状况下的体积为0.896L D、向Y溶液中逐滴加入过量的氨水,先产生蓝色沉淀,后沉淀溶解11. 某小组探究氧化铁和乙醇的反应,装置如图,观察到红色的氧化铁全部变为黑色固体M。
A、白色物质X为CuSO4 B、微热5min待Cu反应结束后,转移电子的物质的量为0.48mol C、放出的NO在标准状况下的体积为0.896L D、向Y溶液中逐滴加入过量的氨水,先产生蓝色沉淀,后沉淀溶解11. 某小组探究氧化铁和乙醇的反应,装置如图,观察到红色的氧化铁全部变为黑色固体M。
为了检验M的组成,进行下列实验:
①M能被磁铁吸引;加入足量稀硫酸,振荡,固体全部溶解,未观察到有气体生成;
②取少量①所得溶液于试管中,加入KSCN溶液,溶液变成血红色;
③另取少量①所得溶液于试管中,滴入适量酸性KMnO4溶液,KMnO4溶液褪色。
下列叙述正确的是( )
A、因为是无水乙醇参加反应,所以无水硫酸铜不会变蓝 B、试管2中未观察到砖红色沉淀说明反应中没有乙醛生成 C、M中一定有+3价铁,可能有0价铁 D、步骤②的反应中+3价铁表现氧化性,步骤③的反应中+2价铁表现还原性12. 钯(Pd)的性质与铂相似,一种从废钯催化剂(主要成分为Pd、α-Al2O3和活性炭,还含少量Fe、Cu等元素)中回收海绵钯的工艺流程如图:
已知:阴、阳离子交换树脂的基本工作原理分别为R-Cl+M-R-M+Cl-、R-Na+N+R-N+Na+。下列说法错误的是( )
A、“灼烧”的主要目的是除去活性炭 B、“酸浸”过程中温度不宜过高 C、“离子交换”所用树脂为阳离子交换树脂 D、“还原”过程中氧化剂与还原剂的物质的量之比为1∶2二、多选题
-
13. 实验是化学研究的重要手段,根据下列实验操作和现象所得到的实验结论正确的是( )
选项
实验操作和现象
实验结论
A
将少量Cl2通入FeBr2溶液中,再加入CCl4 , 振荡、静置,CCl4层为无色
Br-的还原性比Fe2+的弱
B
向CuSO4溶液中加入KI溶液,再加入苯,振荡,上层呈紫红色,下层有白色沉淀生成
Cu2+可以氧化I- , 白色沉淀可能为CuI
C
将海带剪碎,加蒸馏水浸泡,过滤,向滤液中滴加几滴稀硫酸和1mLH2O2 , 再滴加几滴淀粉溶液,溶液变为蓝色
海带中含有IO
D
向装有Ag2O固体的两支试管中分别加入稀硝酸和氨水,Ag2O均溶解
Ag2O是两性氧化物
A、A B、B C、C D、D三、综合题
-
14. 磁性氧化铁因其特殊的超顺磁性,在巨磁电阻、磁性液体和磁记录、软磁、永磁、磁致冷、巨磁阻抗材料以及磁光器件、磁探测器等方面具有广阔的应用前景。以高硫铝土矿(主要含Al2O3、Fe2O3、SiO2和少量的FeS2等)为原料提取氧化铝和磁性氧化铁的流程如图:
 (1)、磁性氧化铁的化学式为;写出滤渣I中主要成分的一种用途:。(2)、操作I在实验中要用到的玻璃仪器有。(3)、焙烧I中,FeS2发生反应的化学方程式为。(4)、焙烧I的过程中采用如图所示的“多层逆流焙烧”,“多层逆流焙烧”的优点是(任答一点)。
(1)、磁性氧化铁的化学式为;写出滤渣I中主要成分的一种用途:。(2)、操作I在实验中要用到的玻璃仪器有。(3)、焙烧I中,FeS2发生反应的化学方程式为。(4)、焙烧I的过程中采用如图所示的“多层逆流焙烧”,“多层逆流焙烧”的优点是(任答一点)。 (5)、焙烧II中氧化铝参与反应的化学方程式为。(6)、反应III中加入FeS2的目的是作(填“氧化剂”或“还原剂”)。反应Ⅲ的煅烧温度对磁性氧化铁的纯度有很大影响。已知温度对磁性氧化铁纯度的影响如图所示,则煅烧时,温度最好控制在℃。
(5)、焙烧II中氧化铝参与反应的化学方程式为。(6)、反应III中加入FeS2的目的是作(填“氧化剂”或“还原剂”)。反应Ⅲ的煅烧温度对磁性氧化铁的纯度有很大影响。已知温度对磁性氧化铁纯度的影响如图所示,则煅烧时,温度最好控制在℃。 (7)、滤液经过一系列操作可获得Al2O3 , 请简述这一系列操作的具体过程:。15. 电子晶体是原子或离子在同一平面上整齐排列的二维晶体,也称为维格纳晶体,通常用于制造新型半导体。氮化钙(Ca3N2)是一种电子晶体,具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于新型半导体陶瓷工业等领域。氮化钙在空气中会被氧化,遇水强烈水解,产生刺激性气味气体。实验室设计如图装置用Ca与N2反应制备Ca3N2 , 并对Ca3N2纯度进行测定。回答下列问题:(1)、I.Ca3N2的制备
(7)、滤液经过一系列操作可获得Al2O3 , 请简述这一系列操作的具体过程:。15. 电子晶体是原子或离子在同一平面上整齐排列的二维晶体,也称为维格纳晶体,通常用于制造新型半导体。氮化钙(Ca3N2)是一种电子晶体,具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于新型半导体陶瓷工业等领域。氮化钙在空气中会被氧化,遇水强烈水解,产生刺激性气味气体。实验室设计如图装置用Ca与N2反应制备Ca3N2 , 并对Ca3N2纯度进行测定。回答下列问题:(1)、I.Ca3N2的制备
仪器a的名称为 , E装置的主要作用是。
(2)、实验开始时应首先点燃(填“A”或“C”)处酒精灯,当观察到时点燃另一处酒精灯。(3)、II.Ca3N2纯度的测定(已知所含的杂质只有单质钙)方案一:①按图1所示连接装置,检查装置气密性后加入试剂,打开K1 , K2 , 通入N2 , 将装置内空气排尽;②测定虚线框内装置及试剂的质量m1;③ , 用分液漏斗加入足量的水,至不再产生气体;④;⑤再次测定虚线框内装置及试剂的质量m2。则产品中Ca3N2的质量分数表达式为。
 (4)、方案二:按图2所示连接装置,检查装置气密性后加入试剂。打开分液漏斗活塞向三颈烧瓶中加入蒸馏水,打开K持续通入水蒸气,将产生的氨气全部蒸出,并用100mL1.00mol•L-1稀硫酸标准液完全吸收(液体体积变化忽略不计)。从烧杯中量取10.00mL吸收液注入锥形瓶中,用1.00mol•L-1的NaOH标准溶液滴定过量的稀硫酸,到终点时消耗12.20mLNaOH溶液。则产品中Ca3N2的质量分数为。
(4)、方案二:按图2所示连接装置,检查装置气密性后加入试剂。打开分液漏斗活塞向三颈烧瓶中加入蒸馏水,打开K持续通入水蒸气,将产生的氨气全部蒸出,并用100mL1.00mol•L-1稀硫酸标准液完全吸收(液体体积变化忽略不计)。从烧杯中量取10.00mL吸收液注入锥形瓶中,用1.00mol•L-1的NaOH标准溶液滴定过量的稀硫酸,到终点时消耗12.20mLNaOH溶液。则产品中Ca3N2的质量分数为。 16. 《自然·电子学》杂志报道了电子产品中使用的二氧化钒能够“记住”先前外部刺激的全部历史。这是第一种被确定为具有记忆属性的材料。实验室以V2O5为原料合成用于制备VO2的氧钒(IV)碱式碳酸铵晶体,过程如下:
16. 《自然·电子学》杂志报道了电子产品中使用的二氧化钒能够“记住”先前外部刺激的全部历史。这是第一种被确定为具有记忆属性的材料。实验室以V2O5为原料合成用于制备VO2的氧钒(IV)碱式碳酸铵晶体,过程如下:V2O5VOCl2溶液(NH4)5[(VO6)(CO3)4(OH)9]•10H2O
回答下列问题:
(1)、步骤I中生成VOCl2溶液的同时还生成一种无色无污染的气体,该反应的化学方程式为 , 加入N2H4•2HCl的作用是。(2)、步骤II可在如图装置(气密性良好)中进行。已知:VO2+能被O2氧化。
装置B中盛装的试剂是;向C中通入CO2的作用是。
(3)、加完VOCl2溶液后继续搅拌数分钟,使反应完全,小心取下分液漏斗,停止通气,立即塞上橡胶塞,将锥形瓶置于CO2保护下的干燥器中,静置,得到紫色晶体,过滤。此时紫色晶体上残留的杂质离子主要为 , 接下来的简要操作是 , 最后用乙醚洗涤2~3次,干燥后称重。(必须使用的药品为饱和NH4HCO3溶液、无水乙醇)。(4)、氧钒(IV)碱式碳酸铵晶体在隔绝空气条件下加热分解,可得到VO2 , 写出该反应的化学方程式:。(5)、工业上用NaClO与NH3反应生产肼,其反应的化学方程式为NaClO+2NH3=N2H4+NaCl+H2O。工业次氯酸钠溶液中含有氯酸钠会影响所得肼的产品质量。测定次氯酸钠样品中的氯酸钠含量的方法如下:取10.00mL碱性NaClO溶液试样,加入过量H2O2 , 将次氯酸钠完全还原(ClO在酸性条件下具有强氧化性,但碱性条件下几乎无氧化性),加热煮沸,冷却至室温,加入硫酸至酸性,再加入0.1000mol•L-1硫酸亚铁标准溶液30.00mL,充分反应后,用0.01000mol•L-1酸性K2Cr2O7溶液滴定至终点(Cr2O被还原为),消耗该溶液20.00mL。①实验中加热煮沸的目的是。
②次氯酸钠样品中NaClO3的含量为g•L-1。
17. 2022年全球遭遇了严重的干旱气候,海洋污染也非常严重。为解决全球环境污染与气候变化问题,2022年11月30日将在北京举行2022年环境污染与环境治理国际会议(ICEPEG2022)。(1)、工业废水中的重金属离子会导致环境污染,危害人体健康,可用多种方法去除。①纳米零价铝法:纳米铝粉有很强的吸附性和还原性,水中溶解的氧在纳米铝粉表面产生-OH(羟基自由基),可将甘氨酸铬中的有机基团降解,释放出的铬(VI)被纳米铝粉去除。向AlCl3溶液中滴加碱性NaBH4溶液,溶液中(B元素的化合价为+3价)与Al3+反应可生成纳米铝粉、H2和 , 其离子方程式为。
②金属炭法:其他条件相同,分别取铝炭混合物和铁炭混合物,与含Zn2+的废水反应相同时间,Zn2+去除率与废水pH的关系如图所示。

废水pH为3时,铝炭混合物对Zn2+的去除率远大于铁炭混合物的主要原因是。废水pH大于6,随着pH增大,铝炭混合物对Zn2+的去除率增大的原因是。
(2)、废水中的会污染环境,用微生物法和铁炭法均可将还原脱除。①微生物法脱硫:富含有机物的弱酸性废水在微生物作用下产生CH3COOH、H2等物质,可将废水中的还原为H2S,同时用N2或CO2将H2S从水中吹出,再用碱液吸收。CH3COOH与在SBR细菌作用下生成CO2和H2S的离子方程式为。将H2S从水中吹出时,用CO2比用N2效果更好,其原因是。
②铁炭法脱硫:铁炭混合物(铁屑与活性炭的混合物)在酸性废水中产生原子态H,可将废水中的转化为硫化物沉淀除去,该硫化物的化学式为。为提高铁炭混合物对废水的处理效果常通入少量空气,反应过程中废水pH随时间变化如图所示。反应进行15min后溶液pH缓慢下降的原因可能是。

-