广东省2022-2023学年高三上学期9月份大联考化学试题
试卷更新日期:2022-10-14 类型:月考试卷
一、单选题
-
1. 中华文明源远流长,为人类发展做出了巨大贡献。下列承载中国各时代成就的重要物品中,主要由合金材料制成的是( )
物品




选项
A.商朝大理石枭形立雕
B.战国水晶杯
C.宋代清明上河图
D.当代“天眼”(全球最大射电望远镜)的球面射电板
A、A B、B C、C D、D2. 位于广东的中国“散裂中子源”科学装置在锂电池、铁基超导、分子研究、超分子研究等领域取得了数百项重大突破,该项目2022年4月被评为“广东科技创新成果特等奖”,下列叙述错误的是( )A、基态锂原子的核外电子有3种不同的空间运动状态 B、基态的价电子排布式为 C、的立体构型为三角锥形 D、分子识别和自组装都是超分子的特征3. 我国在世界上首先合成了蛋白质、核糖核酸,又率先实现了CO2人工合成淀粉、糖、油脂、醋等营养物质,今年3月全球首个CO2加氢制汽油又实现了量产,下列有关叙述正确的是( )A、淀粉、蛋白质、汽油都是高分子化合物 B、CO2合成营养物质及加氢制汽油若实现量产,能缓解温室效应、能源危机和粮食危机 C、葡萄糖和麦芽糖都属于还原性糖,二者互为同系物 D、100mL 0.1mol/L的醋酸溶液中含有醋酸分子的数目为0.01NA (NA表示阿伏加德罗常数的值)4. 学校有很多后勤人员辛勤劳动为同学们服务,我们要感谢他们,下列劳动过程没有运用相关化学知识的是( )选项
劳动过程
化学知识
A
电工师傅开紫外灯消毒
蛋白质水解可以得到氨基酸
B
后勤师傅给钢铁防护栏涂防锈漆
钢铁与潮湿空气隔绝可防止腐蚀
C
饭堂师傅用热的纯碱溶液洗锅
升温可以促进溶液的水解
D
生活服务部用冰箱保存牛奶
降低温度能减慢化学反应速率
A、A B、B C、C D、D5. 下列实验中,能实现不同价态含硫物质的转化的是( )A、向含足量NaOH的溶液中加入 B、常温下,向试管中加入1mL浓硫酸和一小块铜片 C、将0.5g硫粉和1.0g铁粉均匀混合,在石棉网上堆成条状,用红热玻璃棒触及粉末一端至粉末红热 D、向固体中加入70%的浓硫酸制备6. 如图1所示为磷化硼的晶胞结构,如图2所示为硼酸晶体的层状结构(虚线表示氢键)。下列说法错误的是( )
 A、磷化硼的化学式为BP B、磷化硼晶体中含有配位键 C、是三元酸 D、含1mol 的硼酸晶体中有3mol氢键7. 甲~戊均为短周期元素,在周期表中的相对位置如图所示。甲、乙、丙都是非金属元素,且乙的最高价氧化物对应的水化物是一种含氧酸,下列说法错误的是( )
A、磷化硼的化学式为BP B、磷化硼晶体中含有配位键 C、是三元酸 D、含1mol 的硼酸晶体中有3mol氢键7. 甲~戊均为短周期元素,在周期表中的相对位置如图所示。甲、乙、丙都是非金属元素,且乙的最高价氧化物对应的水化物是一种含氧酸,下列说法错误的是( )甲
乙
丙
丁
戊
A、丁的氧化物一定既能与强酸反应,又能与强碱反应 B、简单氢化物的稳定性:丙>戊 C、原子半径:丁>戊>乙>丙 D、甲~戊的最高价氧化物对应的水化物中只有一种强酸8. 某铁矿石的有效成分是Fe2O3 , 用如图所示装置测该铁矿石有效成分的含量(杂质不参与反应),称取2.00g铁矿石于硬质玻璃管A中,充分反应后测得干燥管B增重1.32g,C增重0.10g,下列相关说法中错误的是( ) A、应先通一段时间CO,称量干燥管B后,再加热硬质玻璃管A B、干燥管C的作用是防止空气中的水蒸气和CO2进入干燥管B C、在硬质玻璃管A中发生的反应中,Fe2O3为氧化剂 D、铁矿石有效成分的质量分数为86.0%9. 电解原理在工业生产中应用广泛,下列有关电解原理的应用正确的是( )A、工业上用电解饱和食盐水制备烧碱、氯气等化工原料 B、可通过电解熔融冶炼铝 C、电镀时,镀层金属作阴极,待镀金属作阳极 D、电解精炼铜时,阳极减少的质量一定等于阴极增加的质量10. 部分含铜物质的分类与相应化合价关系如图所示。下列推断不合理的是( )
A、应先通一段时间CO,称量干燥管B后,再加热硬质玻璃管A B、干燥管C的作用是防止空气中的水蒸气和CO2进入干燥管B C、在硬质玻璃管A中发生的反应中,Fe2O3为氧化剂 D、铁矿石有效成分的质量分数为86.0%9. 电解原理在工业生产中应用广泛,下列有关电解原理的应用正确的是( )A、工业上用电解饱和食盐水制备烧碱、氯气等化工原料 B、可通过电解熔融冶炼铝 C、电镀时,镀层金属作阴极,待镀金属作阳极 D、电解精炼铜时,阳极减少的质量一定等于阴极增加的质量10. 部分含铜物质的分类与相应化合价关系如图所示。下列推断不合理的是( ) A、新制d的悬浊液可用于检验病人是否患有糖尿病 B、a与溶液反应的离子方程式为 C、若e为无水 , 熔点: D、若e为 , e的水溶液中、、、可以大量共存11. 实验证据推理是化学研究的常用方法,下列实验操作和现象均符合题意,并一定能得到正确结论的是( )
A、新制d的悬浊液可用于检验病人是否患有糖尿病 B、a与溶液反应的离子方程式为 C、若e为无水 , 熔点: D、若e为 , e的水溶液中、、、可以大量共存11. 实验证据推理是化学研究的常用方法,下列实验操作和现象均符合题意,并一定能得到正确结论的是( )选项
实验操作
现象
结论
A
密闭环境中,将浓盐酸滴加到小苏打溶液中,并将产生的气体通入水玻璃中
水玻璃中出现白色胶状沉淀
非金属性:C>Si
B
取少量硫酸酸化的溶液,先加入几滴双氧水,再加入几滴KSCN溶液
加入KSCN后溶液变红
该溶液已经氧化变质
C
取两支相同的试管,分别加入2mL 0.1mol/L和1mL 0.1mol/L溶液,再同时向两支试管中加入2mL 0.1mol/L 溶液
加入2mL 溶液的试管出现浑浊时间短
其他条件相同,溶液浓度越大,和反应的速率越快
D
取2mL 0.5mol/L的溶液于试管中,置于冷水中,一段时间后取出逐渐加热
冷水中的溶液为蓝色,加热后逐渐变黄
是吸热反应
A、A B、B C、C D、D12. 是一种有毒气体,能溶于水,人们常用溶液除去气体中混有的杂质,生成黑褐色的CuS沉淀。下列说法正确的是( )A、的在水溶液中电离方程式: B、少量NaOH溶液吸收可得到NaHS,NaHS的电离方程式: C、反应可以发生,说明大于 D、常温下,将pH=5.8的溶液稀释100倍,溶液pH=7.813. 我国科学家研制了一种铬(24号元素)基催化剂,实现了甲烷向甲醇的高效转化,微观示意图如下,下列说法正确的是( ) A、基态铬原子的电子排布式为 B、甲、乙、丙中的C和O原子都是杂化 C、理论上,22.4L甲完全转化能生成1mol乙 D、该催化过程有极性键和非极性键的断裂,也有极性键和非极性键的形成14. 其他条件相同,向温度分别为800K和1000K的恒容密闭容器加入足量焦炭并充入 , 发生反应。从开始,CO和分压的对数和 , 随时间变化曲线如图所示,已知:M点坐标为(0,2.77),N点坐标为(z,1.49),下列判断正确的是( )
A、基态铬原子的电子排布式为 B、甲、乙、丙中的C和O原子都是杂化 C、理论上,22.4L甲完全转化能生成1mol乙 D、该催化过程有极性键和非极性键的断裂,也有极性键和非极性键的形成14. 其他条件相同,向温度分别为800K和1000K的恒容密闭容器加入足量焦炭并充入 , 发生反应。从开始,CO和分压的对数和 , 随时间变化曲线如图所示,已知:M点坐标为(0,2.77),N点坐标为(z,1.49),下列判断正确的是( ) A、800K时随时间变化的曲线是n,1000K时随时间变化的曲线是m B、反应是放热反应 C、用分压表示反应速率,曲线q在0~z min内的平均速率 D、只向平衡体系中加入焦炭,的转化率增大15. 下图为接触法制硫酸的示意图,已知 △H<0,下列说法正确的是( )
A、800K时随时间变化的曲线是n,1000K时随时间变化的曲线是m B、反应是放热反应 C、用分压表示反应速率,曲线q在0~z min内的平均速率 D、只向平衡体系中加入焦炭,的转化率增大15. 下图为接触法制硫酸的示意图,已知 △H<0,下列说法正确的是( )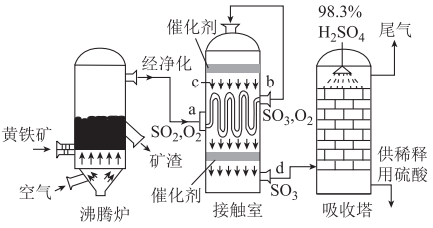 A、黄铁矿的主要成分是 , 沸腾炉中发生反应的化学方程式为 B、接触室的热交换器的作用是加热a处气体,冷却c处气体,控制气体接触催化剂时的温度 C、催化剂的目的是提高反应的平衡转化率 D、应将98.3%的浓硫酸换成蒸馏水,以便吸收更多的16. 一种新型的电化学合成的装置如图所示,正极产生两种阴离子,CEM和AEM是离子交换膜。下列说法错误的是( )
A、黄铁矿的主要成分是 , 沸腾炉中发生反应的化学方程式为 B、接触室的热交换器的作用是加热a处气体,冷却c处气体,控制气体接触催化剂时的温度 C、催化剂的目的是提高反应的平衡转化率 D、应将98.3%的浓硫酸换成蒸馏水,以便吸收更多的16. 一种新型的电化学合成的装置如图所示,正极产生两种阴离子,CEM和AEM是离子交换膜。下列说法错误的是( ) A、正极的电极反应式为 B、CEM、AEM分别是阳离子交换膜、阴离子交换膜 C、通过调控去离子水的流量,可以直接得到不同浓度的溶液 D、负极产生1mol 的同时,理论上正极产生1mol
A、正极的电极反应式为 B、CEM、AEM分别是阳离子交换膜、阴离子交换膜 C、通过调控去离子水的流量,可以直接得到不同浓度的溶液 D、负极产生1mol 的同时,理论上正极产生1mol二、综合题
-
17. 硝酸铁和亚硫酸钠在生产中应用广泛,具有较强的氧化性,易溶于水,微溶于浓硝酸;在空气中容易氧化变质。学习小组欲探究硝酸铁与亚硫酸钠的反应,进行相关实验。回答下列问题:(1)、Fe、N、O、Na、S五种元素中,电负性最大的是(填元素符号)。(2)、制备100mL 0.1mol/L的溶液:

①用如图所示装置制备溶液:用电子天平称取g(保留2位有效数字)铁粉,加入b中,向a中加入5mL 12.4mol/L的硝酸(浓硝酸)溶液,将a中溶液全部滴入b中,然后关闭活塞,水浴温度保持70℃左右。b中观察到的现象是 , 控制水温不宜过高或过低的目的是。
②待b中无固体剩余后,冷却至室温,将溶液稀释到100mL即可得到0.1mol/L的溶液。下列仪器中,稀释过程不需要用到的有(填选项字母)。测得0.1mol/L的溶液pH=1.26。

③室温下,取10mL②中所配溶液,稀释至100mL,测得pH=1.87,解释溶液稀释10倍,pH增大不到1的原因:。
(3)、探究上述硝酸铁溶液与亚硫酸钠的反应:①验证是否氧化变质:取少量粉末,配制成溶液,加入足量稀盐酸,再加入溶液,无沉淀生成,结论:。
②常温下,取5mL制备的0.1mol/L 溶液,一边缓慢加入。上述粉末,一边振荡(忽略溶液体积变化,实验过程确保硝酸铁溶液足量),再加入溶液,产生不溶于硝酸的白色沉淀。
甲认为是氧化 , 乙认为是过量的氧化。
为验证溶液被溶液氧化的原因,仅通过通入HCl气体或加入NaOH固体改变溶液的pH(和对反应无影响,忽略溶液体积变化),重复上述实验,同时用pH计监测溶液pH变化过程,结果如下表所示:
溶液的pH
现象、分析及pH变化
1.87
产生白色沉淀,说明被氧化;pH逐渐减小,减小至pH=1.52左右维持不变
1.52
产生白色沉淀,说明被氧化;pH维持1.52不变
1.26
产生白色沉淀,说明被氧化;pH逐渐增大,增大至pH=1.52左右维持不变
据此分析溶液不同pH值时被溶液氧化的原因:。
(4)、含铁盐应用广泛,写出一种含铁盐的化学式并写出该盐的一种用途:。18. 工厂焊接车间会产生大量含Al、、Cu等杂质的粗铁,回收利用这些粗铁生产高纯氧化铁的工艺如图所示(先将粗铁磨成粗铁粉):
回答下列问题:
(1)、向粗铁粉中加入NaOH溶液,有可燃性气体生成,操作1之后,Al元素全部在溶液1中,且只有一种存在形式。请写出向粗铁粉中加入NaOH溶液发生所有反应的离子方程式:。(2)、浊液2中含有少量红色固体,取少量该浊液,加入KSCN溶液,溶液(填“变”或“不变”)红色,另取少量该浊液过滤,向滤液中加入溶液,现象是。向浊液2中加入溶液,红色固体溶于稀硫酸中,写出该反应的化学方程式: , 其中是(填“氧化剂”或“还原剂”)。(3)、溶液3中与氨水反应的离子方程式为 , 该工艺条件下,氨水的电离常数 , 的溶度积 , 当时,通过计算判断是否已经沉淀完全[认为沉淀完全],写出计算过程:。(4)、操作2是指(填操作名称);溶液4呈深蓝色,是因为存在(填离子符号)。19. 的过量排放会造成温室效应,科学家提出用将固定并生成甲烷进行综合利用。反应历程如下(吸附在催化剂表面的物种用*标注):①
②
③
④
⑤
⑥
主反应生成甲烷和气态水,该反应可逆且正反应方向放热。副反应是吸热反应。
回答下列问题:
(1)、根据上述反应历程,写出主反应的热化学方程式:(△H用相应步骤的焓变的代数式表示)。反应 , 用键能计算的焓变与测得的焓变不一致,原因为 , 该反应平衡常数的表达式为。(2)、380℃时,向1L恒容密闭容器中充入1mol 和4mol , 同时发生主副反应。平衡后测得c()=1.93mol/L,c()随时间(t)的变化如图所示:
①温度高于380℃,重复上述过程,请在答题卷框中画出,c()随时间的变化曲线,并做必要的标注 (假设温度不影响催化剂活性,不考虑副反应影响)。
②380℃时,主反应的平衡常数K=(写出计只算式,不用计算出结果)。
③若将容器改为绝热容器,初始温度为380℃,其他条件不变,反应物主要发生主反应,少部分发生副反应,达到新平衡时,甲烷的产率降低,解释甲烷产率降低的原因:。
(3)、为实现连续性生产,将与按体积比为1:4的混合气体,控制40mL/min的气流速率通过380℃催化剂表面,通过催化剂后反应仍未平衡。①欲提高产率,可采取的措施是(写一种即可)。
②测得的转化率为80%,则的反应速率为mL/min。
20. 化合物G是重要的药物中间体,因酚难以直接发生酯化反应,其合成线路如图所示:
已知:
①;
②
 ;
;③与D发生取代反应生成E和HCl。
回答下列问题:
(1)、A的分子式是。(2)、B中所含官能团的名称为羟基和。(3)、写出一个符合下列条件的化学反应方程式: , 该反应的反应类型是。①仅C分子的一种官能团参与反应;
②除C外,不加入其他任何有机试剂。
(4)、符合下列条件的C的同分异构体有种(不考虑立体异构);其中核磁共振氢谱吸收峰数目最少的结构简式为。①与溶液发生显色反应;
②分子中有两个醛基;
③分子中无甲基。
(5)、下列关于E的描述,正确的有____ (填选项字母)。A、属于芳香烃 B、1mol E最多能消耗2mol NaOH C、可使溴水和酸性高锰酸钾溶液褪色 D、1mol E最多能与4mol 发生加成反应(6)、F→G发生消去反应,生成物除G外,另一无机产物的化学式是。(7)、参照上述合成路线和信息,写出以甲苯和苯酚为原料制备苯甲酸苯酚酯 的合成路线(无机试剂任选):。
的合成路线(无机试剂任选):。