甘肃省张掖市2022-2023学年高三上学期第一次诊断考试化学试题
试卷更新日期:2022-10-14 类型:月考试卷
一、单选题
-
1. 下列说法正确的是( )A、“熔喷布”可用于制作N95型等口罩,生产“熔喷布”的主要原料是聚丙烯,它属于纯净物 B、“山东舰”上用于舰载机降落拦阻索的是一种特种钢缆,属于新型无机非金属材料 C、喝补铁剂(含Fe2+)时,加服维生素C效果更好,因维生素C具有抗氧化性 D、我国部分城市在推广使用的“甲醇汽油”,有降低排放废气的优点,无任何负面作用2. 下列关于化学用语的说法正确的是( )A、和属于同素异形体 B、的电子式是
 C、乙烯的结构简式是
D、的电离方程式是
3. 设NA为阿伏加德罗常数的值。下列说法正确的是( )A、11gK2S和K2O2的混合物中含有的离子数目为0.3NA B、标准状况下,4.48LCCl4所含的分子数为0.2NA C、一定条件下,32gSO2与足量O2反应,转移的电子数为NA D、0.1mol·L-1Na2SO4溶液中含有的氧原子数为0.4NA4. 某白色粉末由两种物质组成,为鉴别其成分进行如下实验:
C、乙烯的结构简式是
D、的电离方程式是
3. 设NA为阿伏加德罗常数的值。下列说法正确的是( )A、11gK2S和K2O2的混合物中含有的离子数目为0.3NA B、标准状况下,4.48LCCl4所含的分子数为0.2NA C、一定条件下,32gSO2与足量O2反应,转移的电子数为NA D、0.1mol·L-1Na2SO4溶液中含有的氧原子数为0.4NA4. 某白色粉末由两种物质组成,为鉴别其成分进行如下实验:①取少量样品加入足量水仍有部分固体未溶解;再加入足量稀盐酸,有气泡产生,固体全部溶解;
②取少量样品加入足量稀硫酸有气泡产生,振荡后仍有固体存在。
该白色粉末可能为( )
A、NaHCO3、Al(OH)3 B、AgCl、NaHCO3 C、Na2SO3、BaCO3 D、Na2CO3、CuSO45. 用下列装置能达到实验目的的是( ) A、用甲装置灼烧碎海带 B、用乙装置蒸发MgCl2溶液制备无水MgCl2 C、丙装置中:①中试剂为稀硫酸,②中为Na2S,③中为AgNO3和AgCl的浊液,用该装置比较Ksp(AgCl)和Ksp(Ag2S)的相对大小 D、用丁装置分离I2和CCl46. 下列反应的离子方程式书写正确的是( )A、溶液与过量溶液反应: B、金属Na与溶液反应: C、少量与KClO溶液反应: D、草酸与酸性溶液反应:7. 已知扎那米韦是流感病毒神经氨酸酶抑制剂,其对流感病毒的抑制是以缓慢结合的方式进行的,具有高度特异性,其分子结构如图所示。
A、用甲装置灼烧碎海带 B、用乙装置蒸发MgCl2溶液制备无水MgCl2 C、丙装置中:①中试剂为稀硫酸,②中为Na2S,③中为AgNO3和AgCl的浊液,用该装置比较Ksp(AgCl)和Ksp(Ag2S)的相对大小 D、用丁装置分离I2和CCl46. 下列反应的离子方程式书写正确的是( )A、溶液与过量溶液反应: B、金属Na与溶液反应: C、少量与KClO溶液反应: D、草酸与酸性溶液反应:7. 已知扎那米韦是流感病毒神经氨酸酶抑制剂,其对流感病毒的抑制是以缓慢结合的方式进行的,具有高度特异性,其分子结构如图所示。
下列说法正确的是( )
A、该物质的分子式为C12H19N4O7 B、1 mol该物质与NaOH溶液反应,可以消耗4 mol NaOH C、在一定条件下,该物质可以发生消去、加成、取代等反应 D、该物质能使溴水或酸性高锰酸钾溶液褪色,能与FeCl3溶液发生显色反应8. 分属周期表前三周期的四种元素W、X、Y、Z可形成结构如下的物质,该物质中所有原子均满足稳定结构,W的原子序数最大,Y、Z处于同一周期。下列说法错误的是( )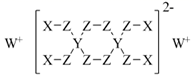 A、X、Z可形成具有强氧化性的高效消毒剂 B、Y的最高价氧化物对应的水化物中,除了氢原子外所有原子满足8电子稳定结构 C、由Z和W形成的化合物中可以存在共价键 D、X、Y、Z的原子半径从大到小为: Y > Z >X9. 下列实验操作能达到相应实验目的的是( )
A、X、Z可形成具有强氧化性的高效消毒剂 B、Y的最高价氧化物对应的水化物中,除了氢原子外所有原子满足8电子稳定结构 C、由Z和W形成的化合物中可以存在共价键 D、X、Y、Z的原子半径从大到小为: Y > Z >X9. 下列实验操作能达到相应实验目的的是( )选项
实验操作
实验目的
A
将二氧化硫气体通入紫色石蕊试液中,观察溶液颜色查化
证明二氧化硫具有漂白性
B
向2mL1mol·L-1NaOH溶液中先加入3滴1mol·L-1
FeCl3溶液.再加入3滴1mol·L-1MgCl2溶液
证明
Ksp[Mg(OH)2]>Ksp[Fe(OH)3]
C
相同温度下,向两支盛有相同体积不同浓度H2O2溶液的试管中分别滴入适量相同浓度的CuSO4溶液和FeCl3溶液
探究Cu2+、Fe3+对H2O2 分解速率的影响
D
向2mL品红溶液和2mL加入少许醋酸的品红溶液中分别滴入3滴含NaClO的“84”消毒液,观察红色褪色快慢
证明随溶液ph减小,“84”消毒液的氧化能力增强
A、A B、B C、C D、D10. George A.Olah教授和其合作者使用Ru-PNP pincer络合物作催化剂,用五乙烯六胺(PEHA)多聚物来捕获二氧化碳,可以直接将空气中二氧化碳转化为甲醇,反应可能的过程如图所示。下列叙述错误的是( ) A、甲醇可作为车用燃料 B、总反应方程式为 C、循环过程中催化剂参与中间反应 D、反应过程中只有极性键的断裂和形成11. 新型锂空气电池能量密度高、成本低,可作为未来电动汽车的动力源,其工作原理如右图所示。下列有关该电池的说法正确的是( )
A、甲醇可作为车用燃料 B、总反应方程式为 C、循环过程中催化剂参与中间反应 D、反应过程中只有极性键的断裂和形成11. 新型锂空气电池能量密度高、成本低,可作为未来电动汽车的动力源,其工作原理如右图所示。下列有关该电池的说法正确的是( ) A、充电时,金属锂为阳极 B、放电时,正负两极周围都有LiOH C、放电时,每消耗22.4LO2 , 转移4mol电子 D、放电和充电时,Li+迁移方向相反12. 赤泥是铝土矿生产Al2O3过程中产生的一种固体废弃物,现设计从赤泥中(含Fe2O3、Al2O3、Ga2O3)提取镓(Ga)的工艺如图所示,下列说法错误的是( )
A、充电时,金属锂为阳极 B、放电时,正负两极周围都有LiOH C、放电时,每消耗22.4LO2 , 转移4mol电子 D、放电和充电时,Li+迁移方向相反12. 赤泥是铝土矿生产Al2O3过程中产生的一种固体废弃物,现设计从赤泥中(含Fe2O3、Al2O3、Ga2O3)提取镓(Ga)的工艺如图所示,下列说法错误的是( )
已知:Ga2O3与Al2O3性质相似,能与NaOH反应生成可溶性盐NaGaO2。
A、浸渣A的主要成分是Fe2O3 B、溶液B中含有金属元素的离子主要有Na+、Al3+ C、通过萃取、反萃取的操作可实现Ga元素的富集 D、电解过程中阴极的电极反应式为+2H2O+3e− =4OH−+Ga13. pH=0的某X溶液中,除H+外,还可能存在Al3+、Fe2+、、Ba2+、Cl-、、、中的若干种,现取适量X溶液进行如下一系列实验:
下列有关判断错误的是( )
A、生成气体A的离子方程式为3Fe2++4H++=3Fe3++NO↑+2H2O B、生成沉淀G的离子方程式为AlO+CO2+2H2O=Al(OH)3↓+ C、溶液X中一定没有的离子仅为、Ba2+ D、溶液X中一定含有的离子是H+、Fe2+、、、Al3+14. 已知H3PO4是一种三元中强酸。25℃时,向某浓度H3PO4溶液中逐滴加入NaOH溶液,滴加过程中各种含磷微粒的物质的量分数δ随溶液pH的变化曲线如图所示。下列说法错误的是( ) A、曲线2表示 , 曲线4表示PO B、25℃时,H3PO4的电离常数 C、pH=7.2时,溶液中由水电离出的c(H+)=10-6.8 mol·L-1 D、pH=12.3时,溶液中5c(Na+)=2c(H3PO4)+2c(H2PO)+2c(HPO)+2c(PO)
A、曲线2表示 , 曲线4表示PO B、25℃时,H3PO4的电离常数 C、pH=7.2时,溶液中由水电离出的c(H+)=10-6.8 mol·L-1 D、pH=12.3时,溶液中5c(Na+)=2c(H3PO4)+2c(H2PO)+2c(HPO)+2c(PO)二、综合题
-
15. 为解决国家“973计划”中钒、铬资源的利用问题,2013年6月攀钢成立“钒铬渣分离提取钒铬技术研究”课题组,2020年5月课题组公布了提取钒铬的工艺流程:

已知:
①钒铬渣中含有 , 及等;
②时,的溶度积常数为;。
回答下列问题:
(1)、“氧化焙烧”时,钒铬渣中化合价发生变化的元素为铬及(用元素名称表示)。(2)、为加快“水浸”速率,可采取的措施为(写出一种即可)。(3)、“除杂”产生的滤渣2的成分是(用化学式表示)。(4)、写出“煅烧”时反应的化学方程式(已知“沉钒”时析出正五价钒的含氧酸铵盐)。(5)、“还原”溶液中的时发生反应的离子方程式为 , 已知双氧水还原的效率与温度的关系如图,分析时,双氧水还原效率最高的原因。(6)、“沉铬”过程中,含铬元素的离子刚好完全沉淀时,溶液的pH=(已知溶液中离子浓度时认为已完全沉淀)。 16. 苯甲酸乙酯是重要的精细化工试剂,常用于配制水果型食用香精。实验室制备苯甲酸乙酯的流程如图1所示:
16. 苯甲酸乙酯是重要的精细化工试剂,常用于配制水果型食用香精。实验室制备苯甲酸乙酯的流程如图1所示:
部分物质的相关性质如表所示:
物质
苯甲酸
乙醇
苯甲酸乙酯
常温性状
白色片状或针状晶体
无色液体
无色液体
沸点/℃
249
78
213
相对分子质量
122
46
150
溶解性
微溶于水,溶于乙醇、乙醚等
与水以任意比互溶
难溶于冷水,微溶于热水,溶于乙醇和乙醚等
回答下列问题:
(1)、步骤①中反应的装置如图2所示(加热和夹持装置已略)。将一小团棉花放入仪器B中靠近活塞孔处,将吸水剂放入仪器B中,在仪器C中加入12.2g苯甲酸晶体、30mL无水乙醇(约0.5mol)和3mL浓硫酸,加入几粒沸石,加热至液体微沸,回流反应1.5~2h。仪器A的作用是。 (2)、设置仪器B的作用为。(3)、反应结束后,对仪器C中的混合液进行分离提纯,操作Ⅰ是;操作Ⅱ所用的玻璃仪器除了烧杯外,还有。(4)、反应结束后,步骤③中向混合液2中倒入冷水的目的除溶解浓硫酸外,还有;加入的试剂X为(填化学式)。(5)、最终得到苯甲酸乙酯12.0g,则产率为%(结果保留三位有效数字)17. 硫化氢广泛存在于燃气及废水中,热分解或氧化硫化氢有利于环境保护并回收硫资源。回答下列问题:(1)、1gH2S气体完全燃烧,生成液态水和SO2气体,放出17.24kJ的热量,写出表示H2S(g)的燃烧热的热化学方程式:。(2)、利用H2S的热分解反应可生产H2:。现将0.20mol H2S(g)通入到某恒压(压强p=a MPa)密闭容器中,在不同温度下测得H2S的平衡转化率如图1所示。
(2)、设置仪器B的作用为。(3)、反应结束后,对仪器C中的混合液进行分离提纯,操作Ⅰ是;操作Ⅱ所用的玻璃仪器除了烧杯外,还有。(4)、反应结束后,步骤③中向混合液2中倒入冷水的目的除溶解浓硫酸外,还有;加入的试剂X为(填化学式)。(5)、最终得到苯甲酸乙酯12.0g,则产率为%(结果保留三位有效数字)17. 硫化氢广泛存在于燃气及废水中,热分解或氧化硫化氢有利于环境保护并回收硫资源。回答下列问题:(1)、1gH2S气体完全燃烧,生成液态水和SO2气体,放出17.24kJ的热量,写出表示H2S(g)的燃烧热的热化学方程式:。(2)、利用H2S的热分解反应可生产H2:。现将0.20mol H2S(g)通入到某恒压(压强p=a MPa)密闭容器中,在不同温度下测得H2S的平衡转化率如图1所示。
已知:对于气相反应,用某组分(B)的平衡分压(pB)代替物质的量浓度(cB)也可表示平衡常数(Kp)。(的物质的量分数,为平衡时气体总压强)。
温度升高时,混合气体的平均摩尔质量(填“增大”“减小”或“不变”)。温度为T4℃时,该反应的平衡常数=MPa(用含a的代数式表示)。
(3)、用氯气除去废水中H2S的反应为 , 该反应的可能机理如下:a. 慢
快
快
b. 快
慢
快
c. 慢
快
d. 快
慢
①机理a的中间体为。
②已知 , 为正反应速率,k为速率常数,上述机理中与该速率方程一致的是(填字母)。
(4)、科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫。质子膜H2S燃料电池的结构如图2所示。
①a极的电极反应式为。
②电池工作时,H+经质子膜进入区(填“a极”或“b极”)。
18. Ge、GaAs、CdTe、CdSe等均为重要的半导体材料,在电子、材料等领域应用广泛。回答下列问题:(1)、Ge基态原子核外电子排布式为[Ar]。(2)、第四周期主族元素中,第一电离能介于Ga、As之间的元素是(填元素符号)。(3)、碲的化合物TeO2、TeO3、H2Te三种物质中,H2Te的中心原子杂化类型为 , 分子构型为V形的是(4)、GaCl3熔点为77.9℃,气体在270℃左右以二聚体存在,GaCl3二聚体的结构式为。GaF3熔点为1000℃,GaCl3熔点低于GaF3的原因是。(5)、CdSe的一种晶体为闪锌矿型结构,晶胞结构如图所示。
①原子坐标参数A为( , , ),则B、C的原子坐标参数分别为、
②已知Cd、Se的半径分别为anm和bnm,则CdSe的密度为g·cm-3(列出计算表达式,NA表示阿伏加德罗常数的值)。
19. 用两种不饱和烃A和D为原料可以合成一类新药有机物J ,合成路线如下:
已知①

②有机物J结构中含两个环。
回答下列问题:
(1)、C的名称是。(2)、A→B试剂和反应条件为。(3)、H→J的化学反应方程式为。(4)、已知 符合下列条件的 N的同分异构体有种,其中核磁共振氢谱显示环上只有 3 组峰,且峰面积之比为 4:4:1,写出符合条件一种同分异构体的结构简式。
符合下列条件的 N的同分异构体有种,其中核磁共振氢谱显示环上只有 3 组峰,且峰面积之比为 4:4:1,写出符合条件一种同分异构体的结构简式。①含有基团
 、环上有三个取代基②与NaHCO3反应产生气泡 ③可发生缩聚反应,M的所有同分异构体在下列表征仪器中显示的信号(或数据)完全相同是。
、环上有三个取代基②与NaHCO3反应产生气泡 ③可发生缩聚反应,M的所有同分异构体在下列表征仪器中显示的信号(或数据)完全相同是。a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪
(5)、利用题中信息和所学知识,写出以A和甲烷为原料,合成 的路线流程图(其它试剂自选)。
的路线流程图(其它试剂自选)。