河南省开封五县联考 2022-2023学年高二上学期9月月考化学试题
试卷更新日期:2022-10-14 类型:月考试卷
一、单选题
-
1. 人类的一切活动都离不开能量,下列化学反应属于吸热反应的是( )A、3MnO2(s)+4Al(s)=2Al2O3(s)+3Mn(s) B、Fe(s)+2HCl(aq)=FeCl2(aq)+H2(g) C、C(s)+CO2(g)=2CO(g) D、2Na2O2(s)+2H2O(l)=4NaOH(aq)+O2(g)2. 研究表明,在一定条件下,气态HCN(a)与CNH(b)两种分子的互变反应过程能量变化如图所示。下列说法正确的是( )
 A、CNH比HCN更稳定 B、HCN(g)→CNH(g)为吸热反应,但反应条件不一定要加热 C、1molHCN(g)中的所有化学键全部断开需要放出127.2kJ的热量 D、1molHCN(g)转化为1molCNH(g)需要吸收56.3kJ的热量3. 已知H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ·mol-1。下列说法正确的是( )A、1L1mol·L-1盐酸和1L1mol·L-1氨水反应放出热量为57.3kJ B、1L1mol·L-1高氯酸溶液和1L1mol·L-1NaOH溶液反应放出热量为57.3kJ C、含0.5molH2SO4的浓硫酸和1L1mol·L-1NaOH溶液反应放出热量为57.3kJ D、1L0.5mol·L-1稀硫酸和1L0.5mol·L-1Ba(OH)2溶液反应放出热量为57.3kJ4. 下列关于反应能量的说法正确的是( )A、一定条件下:①2SO2(g)+O2(g)2SO3(g) △H1;②2SO3(g)2SO2(g)+O2(g) △H2 , 则△H1<△H2 B、相同条件下,若1molH(g)具有的能量为E1 , 1molH2(g)具有的能量为E2 , 则有2E1=E2 C、甲烷的燃烧热△H=-890.3kJ·mol-1 , 则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1 D、已知H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ·mol-1 , 则1molNaOH固体与含0.5molH2SO4的稀硫酸混合放出57.3kJ的热量5. “世上无难事,九天可揽月”,我国的航空航天事业取得了举世瞩目的成就。碳酰肼类化合物[Mn(L)3](ClO4)2是种优良的含能材料,可作为火箭推进剂的组分,其相关反应的能量变化如图所示,已知△H2=-299kJ·mol-1 , 则△H1(kJ·mol-1)为( )
A、CNH比HCN更稳定 B、HCN(g)→CNH(g)为吸热反应,但反应条件不一定要加热 C、1molHCN(g)中的所有化学键全部断开需要放出127.2kJ的热量 D、1molHCN(g)转化为1molCNH(g)需要吸收56.3kJ的热量3. 已知H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ·mol-1。下列说法正确的是( )A、1L1mol·L-1盐酸和1L1mol·L-1氨水反应放出热量为57.3kJ B、1L1mol·L-1高氯酸溶液和1L1mol·L-1NaOH溶液反应放出热量为57.3kJ C、含0.5molH2SO4的浓硫酸和1L1mol·L-1NaOH溶液反应放出热量为57.3kJ D、1L0.5mol·L-1稀硫酸和1L0.5mol·L-1Ba(OH)2溶液反应放出热量为57.3kJ4. 下列关于反应能量的说法正确的是( )A、一定条件下:①2SO2(g)+O2(g)2SO3(g) △H1;②2SO3(g)2SO2(g)+O2(g) △H2 , 则△H1<△H2 B、相同条件下,若1molH(g)具有的能量为E1 , 1molH2(g)具有的能量为E2 , 则有2E1=E2 C、甲烷的燃烧热△H=-890.3kJ·mol-1 , 则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1 D、已知H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ·mol-1 , 则1molNaOH固体与含0.5molH2SO4的稀硫酸混合放出57.3kJ的热量5. “世上无难事,九天可揽月”,我国的航空航天事业取得了举世瞩目的成就。碳酰肼类化合物[Mn(L)3](ClO4)2是种优良的含能材料,可作为火箭推进剂的组分,其相关反应的能量变化如图所示,已知△H2=-299kJ·mol-1 , 则△H1(kJ·mol-1)为( )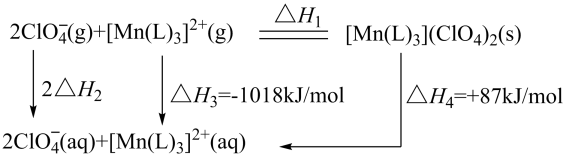 A、-1389 B、-1334 C、-1703 D、-15636. 在C(s)+CO2(g)=2CO(g)的反应中,现采取下列措施:①增加碳的量②缩小体积,增大压强③通入CO2④恒容下充入N2⑤恒压下充入N2 , 上述能够使反应速率增大的措施是( )A、①④ B、②③ C、①③ D、②④7. 下列说法中错误的是( )A、对有气体参加的化学反应,增大压强使容器容积减小,可使单位体积内活化分子数增加,因而化学反应速率增大 B、活化分子之间发生的碰撞不一定是有效碰撞 C、增大反应物浓度,可使反应物分子中活化分子的百分数增大,从而增大化学反应速率 D、加入适宜催化剂,可使反应物分子中活化分子的百分数增大,从而增大化学反应速率8. 一定温度下,在固定体积的密闭容器中发生下列反应:2HI(g)H2(g)+I2(g)。HI起始浓度为0.20mol/L,若c(HI)由0.18mol/L降到0.14mol/L时,需要20s,那么c(HI)由0.20mol/L降到0.18mol/L时,所需反应的时间为( )A、等于10s B、小于10s C、大于10s D、以上答案都错误9. 已知C粉和H2O(g)在恒温恒容的密闭容器中,发生反应C(s)+H2O(g)CO(g)+H2(g) △H>0。反应达到平衡时,下列叙述正确的是( )A、充入一定量的氩气,n(H2)减少 B、更换高效催化剂,CO的产率增大 C、再加入一定量的C粉,H2的体积分数增大 D、再充入一定量的H2O(g),H2O(g)转化率减小10. 图中的曲线是反应2A(g)+B(g)
A、-1389 B、-1334 C、-1703 D、-15636. 在C(s)+CO2(g)=2CO(g)的反应中,现采取下列措施:①增加碳的量②缩小体积,增大压强③通入CO2④恒容下充入N2⑤恒压下充入N2 , 上述能够使反应速率增大的措施是( )A、①④ B、②③ C、①③ D、②④7. 下列说法中错误的是( )A、对有气体参加的化学反应,增大压强使容器容积减小,可使单位体积内活化分子数增加,因而化学反应速率增大 B、活化分子之间发生的碰撞不一定是有效碰撞 C、增大反应物浓度,可使反应物分子中活化分子的百分数增大,从而增大化学反应速率 D、加入适宜催化剂,可使反应物分子中活化分子的百分数增大,从而增大化学反应速率8. 一定温度下,在固定体积的密闭容器中发生下列反应:2HI(g)H2(g)+I2(g)。HI起始浓度为0.20mol/L,若c(HI)由0.18mol/L降到0.14mol/L时,需要20s,那么c(HI)由0.20mol/L降到0.18mol/L时,所需反应的时间为( )A、等于10s B、小于10s C、大于10s D、以上答案都错误9. 已知C粉和H2O(g)在恒温恒容的密闭容器中,发生反应C(s)+H2O(g)CO(g)+H2(g) △H>0。反应达到平衡时,下列叙述正确的是( )A、充入一定量的氩气,n(H2)减少 B、更换高效催化剂,CO的产率增大 C、再加入一定量的C粉,H2的体积分数增大 D、再充入一定量的H2O(g),H2O(g)转化率减小10. 图中的曲线是反应2A(g)+B(g) 2C(g) △H=QkJ/mol在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c、d四点,则下列描述正确的是( )
2C(g) △H=QkJ/mol在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c、d四点,则下列描述正确的是( ) A、Q<0 B、平衡常数值:b点<d点 C、T1温度下若由a点达到平衡,可以采取增大压强的方法 D、c点v(正)<v(逆)11. 已知下列反应的平衡常数:H2S(g)=H2(g)+S(s) K1;S(s)+O2(g)=SO2(g) K2;则反应H2(g)+SO2(g)=O2(g)+H2S(g)的平衡常数是( )A、K1+K2 B、K1-K2 C、 D、12. 如图所示,初始体积均为1L的两容器,甲保持恒容,乙保持恒压。起始时关闭活塞K,向甲中充入1molPCl5(g),乙中充入1molPCl3(g)和1molCl2(g)。恒温下,均发生反应:PCl5(g)PCl3(g)+Cl2(g)。达平衡时,乙的容积为0.8L。下列说法错误的是( )
A、Q<0 B、平衡常数值:b点<d点 C、T1温度下若由a点达到平衡,可以采取增大压强的方法 D、c点v(正)<v(逆)11. 已知下列反应的平衡常数:H2S(g)=H2(g)+S(s) K1;S(s)+O2(g)=SO2(g) K2;则反应H2(g)+SO2(g)=O2(g)+H2S(g)的平衡常数是( )A、K1+K2 B、K1-K2 C、 D、12. 如图所示,初始体积均为1L的两容器,甲保持恒容,乙保持恒压。起始时关闭活塞K,向甲中充入1molPCl5(g),乙中充入1molPCl3(g)和1molCl2(g)。恒温下,均发生反应:PCl5(g)PCl3(g)+Cl2(g)。达平衡时,乙的容积为0.8L。下列说法错误的是( ) A、平衡时PCl5(g)的体积分数:甲<乙 B、从乙中移走0.5molPCl3(g),0.5molCl2(g),再次平衡时乙中n(PCl5)=0.2mol C、打开K一段时间,再次平衡时乙容器的体积为0.6L D、甲中PCl5(g)的转化率小于60%13. 已知凡气体分子总数增多的反应一定是熵增大的反应。一定条件下,下列反应不能自发进行的是( )A、3O2(g)=2O3(g) △H>0 B、2C(s)+O2(g)=2CO(g) △H<0 C、N2(g)+3H2(g)2NH3(g) △H<0 D、CaCO3(s)=CaO(s)+CO2(g) △H>014. 可逆反应2A+B(s)C达到平衡后,加压或升温,A的转化率都增大,则下列结论一定正确的是( )A、A为非气体,C为气体,正反应为放热反应 B、A为气体,C的状态不确定,正反应为吸热反应 C、A、C均为气体,正反应为吸热反应 D、A为气体,C为非气体,正反应为放热反应15. 某温度下,反应H2(g)+Br2(g)2HBr(g)的平衡常数为1×103 , 则该温度下,反应4HBr(g)2H2+2Br2的平衡常数为( )A、1×103 B、1×10-3 C、1×10-6 D、1×10616. 定条件下,合成氨反应为:N2+3H22NH3。图1表示能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线,图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响,下列说法错误的是( )
A、平衡时PCl5(g)的体积分数:甲<乙 B、从乙中移走0.5molPCl3(g),0.5molCl2(g),再次平衡时乙中n(PCl5)=0.2mol C、打开K一段时间,再次平衡时乙容器的体积为0.6L D、甲中PCl5(g)的转化率小于60%13. 已知凡气体分子总数增多的反应一定是熵增大的反应。一定条件下,下列反应不能自发进行的是( )A、3O2(g)=2O3(g) △H>0 B、2C(s)+O2(g)=2CO(g) △H<0 C、N2(g)+3H2(g)2NH3(g) △H<0 D、CaCO3(s)=CaO(s)+CO2(g) △H>014. 可逆反应2A+B(s)C达到平衡后,加压或升温,A的转化率都增大,则下列结论一定正确的是( )A、A为非气体,C为气体,正反应为放热反应 B、A为气体,C的状态不确定,正反应为吸热反应 C、A、C均为气体,正反应为吸热反应 D、A为气体,C为非气体,正反应为放热反应15. 某温度下,反应H2(g)+Br2(g)2HBr(g)的平衡常数为1×103 , 则该温度下,反应4HBr(g)2H2+2Br2的平衡常数为( )A、1×103 B、1×10-3 C、1×10-6 D、1×10616. 定条件下,合成氨反应为:N2+3H22NH3。图1表示能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线,图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响,下列说法错误的是( )

 A、升高温度,该反应的平衡常数减小 B、由图2信息,10min内该反应的平均速率v(H2)=0.045mol·L-1·min-1 C、由图2信息,从11min起其它条件不变,压缩容器的体积,则n(N2)的变化曲线为d D、图3中温度T1<T2 , a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是b点
A、升高温度,该反应的平衡常数减小 B、由图2信息,10min内该反应的平均速率v(H2)=0.045mol·L-1·min-1 C、由图2信息,从11min起其它条件不变,压缩容器的体积,则n(N2)的变化曲线为d D、图3中温度T1<T2 , a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是b点二、填空题
-
17. 有科学家预言,氢能将成为21世纪的主要能源之一,而且是一种理想的绿色能源。(1)、氢能被称为绿色能源的原因是(只答一点即可)。(2)、在101kPa下,1gH2完全燃烧生成液态水放出143.9kJ的热量,请回答下列问题:
①该反应的生成物总能量(填“大于”“小于”或“等于”)反应物总能量。
②氢气的燃烧热为。
③该反应的热化学方程式为。
④若1molH2完全燃烧生成1mol气态水放出241kJ的热量,已知H-O的键能为463kJ·mol-1 , H-H的键能为436kJ·mol-1 , 计算O=O的键能为kJ·mol-1。
(3)、氢能的储存是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知:Mg(s)+H2(g)=MgH2(s) △H1=-72.5kJ·mol-1
Mg2Ni(s)+2H2(g)=Mg2NiH4(s) △H2=-64.4kJ·mol-1;
MgNi2(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s) △H3。
则△H3=kJ·mol-1。
18. CO在工业生产中具有重要作用。(1)、CO(g)+2H2(g)CH3OH(g) △H1=-90.7kJ·mol-12CH3OH(g)CH3OCH3(g)+H2O(g) △H2=-23.5kJ·mol-1
已知△G=△H-T△S,反应CO(g)+2H2(g)CH3OH(g)的△G随温度的变化是图1中的(填“L1”或“L2”)。
 (2)、已知在催化剂M作用下,NO2(g)+CO(g)CO2(g)+NO(g) △H<0。
(2)、已知在催化剂M作用下,NO2(g)+CO(g)CO2(g)+NO(g) △H<0。①一定温度下,假设正逆反应速率与浓度关系为v正=k1c(NO2)•c(CO),v逆=k2c(CO2)•c(NO),k1、k2只与温度相关,则反应的平衡常数K=(用含k1、k2的式子表示)。
②催化剂M活性随温度变化情况如图2所示,相同时间测得NO2的转化率随反应温度变化情况如图3所示,写出T0后NO2的转化率出现如图变化的可能原因。

③在图3中画出并标注,其他条件不变,增大压强(催化剂不失活)情况下,NO2的转化率随温度变化图。
三、综合题
-
19. 工厂烟气(主要含SO2、NO)直接排放会造成空气污染,需处理后才能排放。(1)、O3氧化。
O3氧化过程中部分反应的能量变化如图所示,Ea1是反应的活化能,一定条件下,活化能越大反应速率越慢,反应越困难。

①写出SO2与O3反应的热化学方程式:。
②在相同条件下,O3与NO反应的速率O3与SO2的反应速率。(填>、=、<)
③其他条件不变时,工厂烟气处理主要发生NO与O3反应,即使增加n(O3),O3氧化SO2的反应几乎不受影响,可能原因是。
(2)、NaClO氧化。40℃时向一定量NaClO溶液中按一定流速持续通入工厂烟气,溶液的pH与ORP值(氧化还原电位)随时间变化如图所示。

①写出5min时溶液中NO与ClO-反应生成和Cl-的离子方程式:。
②烟气中含有少量SO2 , NO的脱除率比不含SO2的烟气高,可能原因是。
20. 将玉米秸秆进行热化学裂解可制备出以CO、CO2、H2、N2为主要成分的生物质原料气,对原料气进行预处理后,可用于生产甲醇、乙醇等燃料。(1)、已知:几种常见共价键的键能如表所示。共价键
C-H
C-O
C≡O
H-H
O-H
键能(kJ·mol-1)
410
358
839
436
467
由此可估算反应CO(g)+2H2(g)CH3OH(g)的焓变△H=kJ·mol-1。
(2)、若在恒温恒容的密闭容器中按n(CO):n(H2)=1:2投料进行上述反应,下列说法正确的是____(填标号)。A、体系压强不再发生变化时,反应达到化学平衡状态 B、平衡体系中,H2和CO的物质的量之比为1∶2 C、平衡后投入适量的CH3OH,一段时间后再次平衡,CH3OH的体积分数与原平衡相比增大 D、其他条件不变,增大CO的浓度,能提高CO的平衡转化率(3)、H2和CO2合成乙醇的反应为2CO2(g)+6H2(g)C2H5OH(g)+3H2O(g)。将等物质的量的H2和CO2充入一刚性容器中,测得平衡时C2H5OH的体积分数随温度和压强的变化关系如图所示。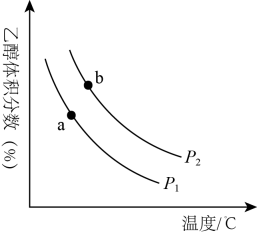
①a、b两点的平衡常数KaKb(填“>”“<”或“=”)。判断依据是。
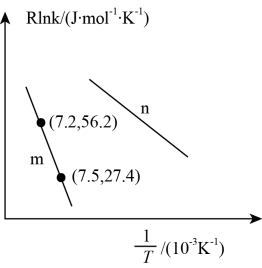
②已知Arrhenius经验公式为Rlnk=-+C(Ea为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效能,进行了实验探究,依据实验数据获得如图所示曲线。在m催化剂作用下,该反应的活化能Ea=kJ·mol-1。
 21. CO2的回收与利用是科学家研究的热点课题。工业上有一种用CO2生产甲醇燃料的方法:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1。将6molCO2和8molH2充入2L的恒温刚性密闭容器中,测得的氢气物质的量随时间变化如图所示(实线)。
21. CO2的回收与利用是科学家研究的热点课题。工业上有一种用CO2生产甲醇燃料的方法:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1。将6molCO2和8molH2充入2L的恒温刚性密闭容器中,测得的氢气物质的量随时间变化如图所示(实线)。 (1)、下列说法能表明该反应已经达到平衡状态的是____(填序号)。A、3v正(CO2)=v逆(H2) B、混合气体的密度保持不变 C、n(CO2):n(H2)保持不变 D、压强保持不变(2)、b点逆反应速率(填大于、等于或小于)c点正反应速率。(3)、平衡时CH3OH的产率为(产率=实际产量/理论产量),若平衡时的总压强为p0 , 该条件下反应的平衡常数Kp=。(4)、若达到平衡后往容器中充入4molCO2 , 2molH2O,请问此时v正v逆(填“大于”,“小于”或者“等于”)。(5)、仅改变某一实验条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示,达到新平衡时的平衡常数与原平衡相比。(慎“增大”,“减小”或者“不变”)。(6)、如果要加快反应速率并且提高H2平衡转化率,可以采取的措施有(写两条)。
(1)、下列说法能表明该反应已经达到平衡状态的是____(填序号)。A、3v正(CO2)=v逆(H2) B、混合气体的密度保持不变 C、n(CO2):n(H2)保持不变 D、压强保持不变(2)、b点逆反应速率(填大于、等于或小于)c点正反应速率。(3)、平衡时CH3OH的产率为(产率=实际产量/理论产量),若平衡时的总压强为p0 , 该条件下反应的平衡常数Kp=。(4)、若达到平衡后往容器中充入4molCO2 , 2molH2O,请问此时v正v逆(填“大于”,“小于”或者“等于”)。(5)、仅改变某一实验条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示,达到新平衡时的平衡常数与原平衡相比。(慎“增大”,“减小”或者“不变”)。(6)、如果要加快反应速率并且提高H2平衡转化率,可以采取的措施有(写两条)。