浙江省舟山市金衢山五校联盟2022-2023学年九年级上学期科学9月质量检测试卷
试卷更新日期:2022-10-14 类型:月考试卷
一、选择题(本题有15小题,第1-10小题,每小题3分,第11-15小题,每小题4分,共50分,请选出一个符合题意的正确选项,不选、多选、错选,均不给分)
-
1. 合理利用化学物质会提高生活质量,下列物质的利用有害于身体健康的是( )A、加碘食盐用于调味 B、小苏打用于制糕点 C、氮气用于食品防腐 D、甲醛用于肉类保鲜2. 化学与生活密切相关,从化学的角度认识生活中的问题,下列说法正确的是( )A、地沟油经化学方法处理制成航空燃油,实现变废为宝 B、食品添加剂符合国家许可,制作食品过程中可随意添加 C、脂肪、糖类、动物蛋白都是人体必须的营养素,吃得越多越好 D、生活污水不是化工废水,可向江河湖泊里任意排放3. 科学实验必须按规范进行操作,下列实验操作中规范的是( )A、取少量氯化钠
 B、闻药品气味
B、闻药品气味 C、滴加液体
C、滴加液体 D、用湿润的玻璃棒蘸取试液检测pH
D、用湿润的玻璃棒蘸取试液检测pH 4. 诗词是民族灿烂文化的瑰宝,下列著名诗句中只含有物理变化的是( )A、野火烧不尽,春风吹又生 B、粉身碎骨浑不怕,要留清白在人间 C、夜来风雨声,花落知多少 D、春蚕到死丝方尽,蜡炬成灰泪始干5. 下列过程中不发生化学变化的是( )A、
4. 诗词是民族灿烂文化的瑰宝,下列著名诗句中只含有物理变化的是( )A、野火烧不尽,春风吹又生 B、粉身碎骨浑不怕,要留清白在人间 C、夜来风雨声,花落知多少 D、春蚕到死丝方尽,蜡炬成灰泪始干5. 下列过程中不发生化学变化的是( )A、 B、
B、 C、
C、 D、
D、 6. 建立宏观和微观之间的联系是一种科学思维方式,下列对宏观事实的微观解释不正确的是( )A、白色的无水硫酸铜遇水变蓝色,是因为CuSO4 , 遇H2O转化为 B、警用缉毒犬能根据气味发现毒品,是因为分子在不断运动 C、不同种酸的化学性质有所不同,与酸电离生成的阴离子不同有关 D、5mL酒精和5mL水混合后体积小于10mL,是因为混合过程中分子变小了7. 下表是某同学对知识的归纳,其中能表示甲组含有乙丙丁的是( )
6. 建立宏观和微观之间的联系是一种科学思维方式,下列对宏观事实的微观解释不正确的是( )A、白色的无水硫酸铜遇水变蓝色,是因为CuSO4 , 遇H2O转化为 B、警用缉毒犬能根据气味发现毒品,是因为分子在不断运动 C、不同种酸的化学性质有所不同,与酸电离生成的阴离子不同有关 D、5mL酒精和5mL水混合后体积小于10mL,是因为混合过程中分子变小了7. 下表是某同学对知识的归纳,其中能表示甲组含有乙丙丁的是( )甲
乙
丙
丁
A
常用的碱
熟石灰
纯碱
烧碱
B
化石燃料
煤
石油
天然气
C
化学性质
可燃性
酸性
挥发性
D
含氧化合物
甲烷
水
A、A B、B C、C D、D8. 学校为预防传染病的扩散,要求学生在饭前便后用84消毒液洗手。84消毒液的主要成分是次氯酸钠(),则属于( )A、氧化物 B、酸 C、碱 D、盐9. 下列物质的溶液,不另加试剂就不能签别出来的一组( )A、 B、 C、 D、10. 下列方法中,不能达到目的是( )选项
物质(括号内为杂质)
除去杂质的方法
A
溶液()
加入适量
B
加水溶解,过滤
C
CO(CO2)
通过足量氢氧化钠溶液,并干燥
D
溶液()
加足量氧化铜粉末,过滤
A、A B、B C、C D、D11. 下列关于物质组成与分类的说法中正确的是( )A、含有氧元素的化合物叫做氧化物 B、氢氧化钠的构成粒子是 C、原子核是由质子和电子构成 D、是由三个氢元素和一个氮元素构成的12. 把下列各组物质的溶液混合,再加入足量盐酸,最终会有沉淀生成的是( )A、 B、 C、 D、13. 在化学反应前后,物质所含元素化合价发生变化的反应是氧化还原反应,它与化学反应基本类型间的关系如图所示,下列示列中错误的是( ) A、阴影1:C+O2CO2 B、阴影2:2H2O2H2↑+O2↑ C、阴影3:+2HCl=MgCl2+2H2O D、阴影4:Fe+CuSO4=FeSO4+Cu14. 等质量的M、N两种金属,分别与相同质量分数的足量稀盐酸反应(已知M、N在生成物中均为+2价),生成氢气质量和反应时间的关系如右图所示,下列叙述正确的是( )
A、阴影1:C+O2CO2 B、阴影2:2H2O2H2↑+O2↑ C、阴影3:+2HCl=MgCl2+2H2O D、阴影4:Fe+CuSO4=FeSO4+Cu14. 等质量的M、N两种金属,分别与相同质量分数的足量稀盐酸反应(已知M、N在生成物中均为+2价),生成氢气质量和反应时间的关系如右图所示,下列叙述正确的是( ) A、相对原子质量较大的是N B、生成H的质量M<N C、M、N两种金属中较活泼的是N D、产生H的速率N>M15. 小明同学在总结酸碱盐之间的相互反应关系时发现,选用适当物质可以实现如图所示的所有反应,若中间的物质为硫酸钡,那么对酸、碱、甲盐、乙盐四种物质的推断中,合理的是( )
A、相对原子质量较大的是N B、生成H的质量M<N C、M、N两种金属中较活泼的是N D、产生H的速率N>M15. 小明同学在总结酸碱盐之间的相互反应关系时发现,选用适当物质可以实现如图所示的所有反应,若中间的物质为硫酸钡,那么对酸、碱、甲盐、乙盐四种物质的推断中,合理的是( ) A、HCl NaOH BaCl2 Na2SO4 B、HCl Ba(OH)2 Na2SO4 BaCl2 C、H2SO4 Ba(OH)2 Na2SO4 BaCl2 D、H2SO4 NaOH BaCl2 Na2SO4
A、HCl NaOH BaCl2 Na2SO4 B、HCl Ba(OH)2 Na2SO4 BaCl2 C、H2SO4 Ba(OH)2 Na2SO4 BaCl2 D、H2SO4 NaOH BaCl2 Na2SO4二、填空题(本题有9小题20空格,每空2分,共40分)
-
16. 请按要求从下列物质中①CO ②NaHCO3③KNO3④CH4⑤N2⑥选择合适的物质,将其序号填写在下列横线上:(1)、最简单的有机物 ;(2)、具有还原性的有毒气体。17. 化学在我们身边。请从下列物质中选择适当的物质填空(用化学式表示)。
A.硫酸铜 B.硝酸钾 C.水银 D.氮气 E.食醋 F.石灰石
(1)、实验室制取二氧化碳的原料是:。(2)、可用于配制杀菌剂波尔多液的是。18. 钛及钛合金具有密度小、强度高、耐腐蚀等优良性能,被广泛应用于航天、化工、医药等方面。我国四川省有丰富的钛铁矿资源,从中可以提取金属钛。(1)、饮铁矿的主要成分是钛酸亚铁(FeTiO2),其中铁元素化合价为+2,氧元素化合价为-2,则钛酸亚铁中钛元素(Ti)的化合价为。(2)、钛铁矿中提取金属钛要经过较复杂的流程,其中得到金属钛的反应为:。根据此反应,比较金属镁(Mg)和钛(Ti)的活动性,较强的是。19. 根据下列实验图示分析问题: (1)、上述三个反应都是物质与氧发生的反应,它们都属于氧化反应。氧气在氧化反应中提供氧,它具有氧化性。如果从元素化合价变化角度来理解氧化反应及氧化性,则从化学反应前后氧元素化合价变化角度分析,氧气在上述反应中具有氧化性的原因是。(2)、通过类比、分析反应 发现,该反应中具有氧化性的物质是(填化学式)。20. 用化学方程式描述下列事实。(1)、常温下,铝具有根好的抗腐蚀性能,是因为铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,反应的化学方程式是。(2)、高温条件下一氧化碳能把铁从磁铁矿石(主要成分为)中还原出来,反应的化学方程式是。21. 根据下图装置,回答下列有关问题:
(1)、上述三个反应都是物质与氧发生的反应,它们都属于氧化反应。氧气在氧化反应中提供氧,它具有氧化性。如果从元素化合价变化角度来理解氧化反应及氧化性,则从化学反应前后氧元素化合价变化角度分析,氧气在上述反应中具有氧化性的原因是。(2)、通过类比、分析反应 发现,该反应中具有氧化性的物质是(填化学式)。20. 用化学方程式描述下列事实。(1)、常温下,铝具有根好的抗腐蚀性能,是因为铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,反应的化学方程式是。(2)、高温条件下一氧化碳能把铁从磁铁矿石(主要成分为)中还原出来,反应的化学方程式是。21. 根据下图装置,回答下列有关问题: (1)、装置图中仪器a的名称为。(2)、实验室要制取氢气,既要控制反应的发生和停止,又要采用与收集氧气方法相同,可选用的发生装置和和收集装置的组合是。(3)、若将A装置改进,可以作为实验室氢气还原氧化铜的装置,除了将导管通入到试管底部,还需改进的是。22. 一百六十年前,鸦片-曾使中国面临“亡国灭种”的危险,民族英雄林则徐坚决领导了禁烟斗争,他们先把鸦片投入到盐卤池中浸泡、溶解,再投入生石灰,倾刻得间池中沸腾,烟土随之湮灭。池中生石灰与水反应的化学方程式是:;“倾刻间池中沸腾”说明此反应过程会(填“吸收”或“放出”大量热量)。23. 小明制作了如图甲所示的简易酸碱灭火器,并进行如图乙所示的灭火操作,结束后对瓶中残留液进行了如下实验:①取少量残留液于试管中,滴加公演无色酚酞试液,变红色;②另取少量残留液于试管中,滴加适量硝酸银溶液,有白色沉淀,则残留液中一定含有:消防部门配置的酸碱灭火器中的酸为 , 可大大延长保质期。
(1)、装置图中仪器a的名称为。(2)、实验室要制取氢气,既要控制反应的发生和停止,又要采用与收集氧气方法相同,可选用的发生装置和和收集装置的组合是。(3)、若将A装置改进,可以作为实验室氢气还原氧化铜的装置,除了将导管通入到试管底部,还需改进的是。22. 一百六十年前,鸦片-曾使中国面临“亡国灭种”的危险,民族英雄林则徐坚决领导了禁烟斗争,他们先把鸦片投入到盐卤池中浸泡、溶解,再投入生石灰,倾刻得间池中沸腾,烟土随之湮灭。池中生石灰与水反应的化学方程式是:;“倾刻间池中沸腾”说明此反应过程会(填“吸收”或“放出”大量热量)。23. 小明制作了如图甲所示的简易酸碱灭火器,并进行如图乙所示的灭火操作,结束后对瓶中残留液进行了如下实验:①取少量残留液于试管中,滴加公演无色酚酞试液,变红色;②另取少量残留液于试管中,滴加适量硝酸银溶液,有白色沉淀,则残留液中一定含有:消防部门配置的酸碱灭火器中的酸为 , 可大大延长保质期。 24. 金属在日常生活中有着广泛的用途,常见金属的活动性顺序如图1.请回答下面问题
24. 金属在日常生活中有着广泛的用途,常见金属的活动性顺序如图1.请回答下面问题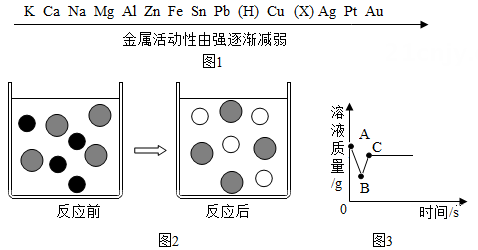 (1)、金属活动性顺序表中的X是填写相应的元素符号)元素。(2)、若向CuSO4 , 溶液中加入过量的Fe片,充分反应,如图2表示该反应前后溶液中存在的主要离子,请写出该图形代表的离子(填离子符号)O:(3)、向一定质量AgNO3和的混合溶液中加入过量的Zn粉,溶液质量随反应时间的变化情况如图3所示,图中B点溶液中含有的溶质有(填化学式)。
(1)、金属活动性顺序表中的X是填写相应的元素符号)元素。(2)、若向CuSO4 , 溶液中加入过量的Fe片,充分反应,如图2表示该反应前后溶液中存在的主要离子,请写出该图形代表的离子(填离子符号)O:(3)、向一定质量AgNO3和的混合溶液中加入过量的Zn粉,溶液质量随反应时间的变化情况如图3所示,图中B点溶液中含有的溶质有(填化学式)。三、实验探究题(本题有5小题15空格,第25-26小题,每空2分,第27-29小题,每空3分,共40分)
-
25. 现有三只烧杯,分别盛有稀盐酸、稀硫酸、碳酸钠溶液中的一种,并向其中滴加了酚酞溶液或石蕊溶液,结果如下图所示。
 (1)、B溶液呈(选填“酸性”、“碱性”、或“中性”)(2)、取A中溶液于试管中,加入氧化铁,溶液由无色变为黄色。则黄色溶液中含有的金属阳离子为 (填写离子符号)。26. 某科学兴趣小组对铁生锈的原因做了如下探究。
(1)、B溶液呈(选填“酸性”、“碱性”、或“中性”)(2)、取A中溶液于试管中,加入氧化铁,溶液由无色变为黄色。则黄色溶液中含有的金属阳离子为 (填写离子符号)。26. 某科学兴趣小组对铁生锈的原因做了如下探究。 (1)、用如图所示实验探究铁生锈的条件(每支试管中均放有完全相同的洁净铁钉)。
(1)、用如图所示实验探究铁生锈的条件(每支试管中均放有完全相同的洁净铁钉)。甲同学认为,试管A发生的现象就能够说明铁的锈蚀是铁与空气中的氧气、水蒸气共同作用的结果。乙同学不同意他的观点,认为必须全面观察试管(选填试管编号)发生的现象,并经过科学严谨的推理,才能得出上述结论。
(2)、利用试管D实验的目的是进一步探究铁在的环境中是否更容易锈蚀。(3)、为防止金属锈蚀,除了采用覆盖保护膜等情施以外,还可以制成合金,这是因为合金与纯金属相比,其组成和内部组织结构发生变化,从而引起的变化。27. 我国不少地方有端午吃“灰水粽”的习俗,所谓“灰水粽”是指用草木灰的浸出液(俗称“灰水”)浸泡糯米做成的粽子,这种粽子清香软糯,小乐对制作“灰水粽”的草木灰展开了如下探究:
【查阅资料】①糯米中加入食用碱可起到中和微生物生成的酸、软化食物纤维等作用:
②草木灰中富含钾盐,主要成分是K2CO3 , 还含有少量K2SO4 , 和KCl。
【实验探究】检验草木灰的成分,并测定草木灰中K2CO3 , 的质量分数。
(1)、取适量草木灰于烧杯中,加足量水浸泡,过滤得到草木灰的浸出液;取少量没出液于试管中,滴加几演酚酞试液,观察到酚酞试液变成红色,则说明草木灰的浸出液呈 , 可起到食用碱的作用。(2)、为了检验草木灰的浸出液中存在Cl- , 小乐先往浸出液中加入足量的溶液后过滤,这样操作的目的是。(3)、小海用图示装置(图中夹持仪器已略去)测定草木灰中K2CO3 , 的质量分数,实验中通过测定丙装置质量的增加量来计算K2CO3的质量(草木灰中其他成分退稀盐酸不产生气体),实验过程中需持续缓缓通入空气,如果不往装置中持续缓慢通入空气,会导致测量结果偏小,其原因是。28. 碱式氯化镁【Mg(OH)Cl】受热能分解,它分解后产物是什么?小科进行了探究。【猜想】Mg(OH)Cl分解后产物可能有:Mg、MgCl2、MgO、HCl气体、H2O、Cl2。
老师告诉他产物就是上述猪想中的其中几种,并提示Cl2是一种黄绿色有刺激性气味的气体。

【实验一】取少量的Mg(OH)Cl放入大试管中,按如图所示装置进行实验。加热过程中观察到足量硝酸银溶液中有白色沉淀产生,一段时间后,沉淀不再产生,大试管口也没有液滴形成,管内有固体剩余,无其他现象。由此推知Mg(OH)Cl分解后产物中有气体,无其他气体。
【实验二】取少量实验一的剩刹余固体于试管中,加入足量稀盐酸,没有气泡产生。由此推知Mg(OH)Cl分解后产物中没有。
【实验三】再取少量实验一的剩余固体,加入足量稀硝酸,固体全部溶解,再滴入AgNO3溶液,无沉淀产生。由此推知Mg(OH)Cl分解后产物中没有。
【结论】Mg(OH)Cl受热分解的化学反应方程式为。
29. 某KNO3化肥中可能混进了NH4Cl、(NH4)2SO4、K2CO3 , 三种物质中的一种或几种,同学们对该化肥开展了以下探究活动。
 (1)、KNO3是一种肥;(2)、加入盐酸,无气泡产生,说明混合物中不含;(3)、小明通过白色沉淀F,认为该化肥中一定混进了NH4Cl和、一定没有K2CO3小强认为这个结论不正确,他的理由是。
(1)、KNO3是一种肥;(2)、加入盐酸,无气泡产生,说明混合物中不含;(3)、小明通过白色沉淀F,认为该化肥中一定混进了NH4Cl和、一定没有K2CO3小强认为这个结论不正确,他的理由是。四、计算分析题(本题有6小题,第31、32、34小题8分,第30每小题6分,第33、35小题10分,共50分)
-
30. 一种主要成分是过碳酸钠(Na2CO4)的新型洗涤剂,能清除衣服上难以清洗的汗渍、果汁渍等。过碳酸钠会与水反应产生碳酸钠和过氧化氢。(1)、过碳酸钠中的碳、氧元素质量比为。(2)、Na2CO3与Na2CO4都是由离子构成的盐,但Na2CO3却不能与水反应生成过氧化氢。这是因为构成它们的不同。(3)、这种新型洗涤剂在贮存时会因为而变质,所以要密封。31. 如图,要使石头滚下,山羊必须给石头一个足够“翻越小坡”的能量(E),当石头滚落到谷底时会释放能量,化学反应就如那块石头一样,反应物需要一定的能量才能“翻越小坡”,反应才会发生,若反应中加入催化剂,可降低“翻越小坡”需要的能量,任何化学反应都伴随着能量变化,若反应物的总能量比生成物的总能量高,该反应为放热反应,反之,则为吸热反应,反应中放出或吸收的能量等于反应物总能量与生成物总能量的差值。(1)、图1 表示(填“放热”或“吸热)反应;反应物总能量与生成物总能量的差值是(E2-E1),

反应所需“翻越小坡”的能量是(用代数式表示)。
(2)、图2中曲线a、b表示同一反应在不同条件下的反应过程,曲线(填“a”或“b”)表示加入了催化剂的反应过程。(3)、氢气在氧气中燃烧生成水,水分解为氢气和氧气的反应是(填“放热”或“吸热”)。32. 某化学兴趣小组的同学想从含有Al2(SO4)3、CuSO4的废液中回收金属铜,设计流程如图:
 (1)、 过滤操作中用到的所有玻璃仪器为。(2)、 I中有关反应的化学方程式为。(3)、 溶液B中所含的溶质是(填化学式);(4)、Ⅱ中加入过量稀硫酸的目的是。33. 利用中和反应可以测定酸或碱溶液中溶质的质量分数,向20g溶质质量分数为4%的氢氧化钠溶液中不断滴加40g稀盐酸。
(1)、 过滤操作中用到的所有玻璃仪器为。(2)、 I中有关反应的化学方程式为。(3)、 溶液B中所含的溶质是(填化学式);(4)、Ⅱ中加入过量稀硫酸的目的是。33. 利用中和反应可以测定酸或碱溶液中溶质的质量分数,向20g溶质质量分数为4%的氢氧化钠溶液中不断滴加40g稀盐酸。 (1)、a、b、c三溶液,滴入石蕊试液呈红色的是溶液。(2)、从微粒角度分析,此反应的实质是。(3)、求滴加的稀盐酸中溶质质量分数。(要有计算过程。精确到0.01%,下同)34. 中和反应是一类重要的化学反应,某同学利用图1装置研究稀盐酸与氢氧化钠溶液反应的过程,并用pH传感器和温度传感器测量反应过程中相关物理量的变化情况,得到图2和图3。
(1)、a、b、c三溶液,滴入石蕊试液呈红色的是溶液。(2)、从微粒角度分析,此反应的实质是。(3)、求滴加的稀盐酸中溶质质量分数。(要有计算过程。精确到0.01%,下同)34. 中和反应是一类重要的化学反应,某同学利用图1装置研究稀盐酸与氢氧化钠溶液反应的过程,并用pH传感器和温度传感器测量反应过程中相关物理量的变化情况,得到图2和图3。
 (1)、仪器A中溶液的溶质是(填化学式)。(2)、图3中V的数值最接近(填“6”、“12”或“16”)。(3)、请分析图3中温度变化的原因。(4)、下列说法错误的是__________A、图2中b点所示溶液中的溶质是NaCl和NaOH B、取图2中d点所示溶液加热蒸干所得固体为纯净物 C、图2中c→d过程溶液中NaCl的质量不断增加35. Mg(OH)2具有广泛的应用,常用菱镁矿制备,研究人员向一定质量的菱镁矿粉中加入过量的稀硫酸,充分溶解后除杂、过滤,得到只含MgSO4和H2SO4的混合溶液、为确定混合溶液中镁的含量,取4份混合溶液各100g,向每份混合溶液中加入一定质量的4%NaOH溶液,得到实验数据如下表所示:
(1)、仪器A中溶液的溶质是(填化学式)。(2)、图3中V的数值最接近(填“6”、“12”或“16”)。(3)、请分析图3中温度变化的原因。(4)、下列说法错误的是__________A、图2中b点所示溶液中的溶质是NaCl和NaOH B、取图2中d点所示溶液加热蒸干所得固体为纯净物 C、图2中c→d过程溶液中NaCl的质量不断增加35. Mg(OH)2具有广泛的应用,常用菱镁矿制备,研究人员向一定质量的菱镁矿粉中加入过量的稀硫酸,充分溶解后除杂、过滤,得到只含MgSO4和H2SO4的混合溶液、为确定混合溶液中镁的含量,取4份混合溶液各100g,向每份混合溶液中加入一定质量的4%NaOH溶液,得到实验数据如下表所示:实验编号
①
②
③
④
NaOH溶液质量/g
10.0
20.0
30.0
40.0
Mg(OH)2质量/g
0.232
0.522
0.580
0.580
(1)、实验(填实验编号)中碳酸镁完全反应。(2)、 计算100g混合溶液钟MgSO4的质量。(写出计算过程)(3)、分析实验数据,在图中画出加入4%NaOH溶液质量0~30.0g过程中,产生Mg(OH)2沉淀质量对应的变化图,并标记必要的数据。