四川省南充市2021-2022学年高一上学期期末教学质量监测化学试题
试卷更新日期:2022-10-10 类型:期末考试
一、单选题
-
1. 下列各组混合物中,能用分液漏斗进行分离的是( )A、酒精和水 B、碘和四氯化碳 C、水和苯 D、汽油和植物油2. 下列仪器不能用于加热的是 ( )A、试管 B、量筒 C、坩埚 D、烧杯3. 下列各组物质中,所含分子数相同的是( )A、10gH2和10gO2 B、5.6LN2 (标准状况)和 11 g CO2 C、18 g H2O 和 0.5 mol Br2 D、224mLH2和 0.01 molN24. 当光束通过下列分散系时,可产生丁达尔效应的是( )A、NaCl溶液 B、Fe(OH)3悬浊液 C、盐酸 D、稀豆浆5. 下列物质中,不属于电解质的是( )A、蔗糖 B、H2SO4 C、KOH D、H2O6. 下列各组中的离子,能在溶液中大量共存的是( )A、Ca2+、 Ag+、Cl- B、Na+、Mg2+、OH- C、NH、K+、OH- D、Na+、K+、OH-7. 下列电离方程式书写正确的是( )A、KClO3=K++Cl-+3O2− B、Fe(NO3)3 = Fe3++3NO C、NaHCO3 = Na++H++ CO D、Ba(OH)2= Ba2++OH-8. 配制0.1000 mol/L H2SO4溶液250 mL,下列有关说法错误的是( )A、在配制过程中玻璃棒的作用是搅拌和引流 B、用到的仪器有250 mL容量瓶、托盘天平、量筒、烧杯、玻璃棒和胶头滴管 C、浓硫酸稀释后,立即转移到容量瓶进行后续操作,所配溶液浓度偏高 D、定容时,液面位于容量瓶刻度线下1~2cm时,应改用胶头滴管滴加水9. 等质量的两份铝,分别放入足量的盐酸和氢氧化钠溶液中,充分反应后放出的氢气在同温同压下体积之比为( )A、1∶1 B、1∶6 C、2∶3 D、3∶210. 合金种类繁多,应用广泛。下列不属于合金的是( )A、水银 B、黄铜 C、硬铝 D、生铁11. 下列反应中,反应后固体质量减轻的是( )A、铝条放入浓硫酸中 B、漂粉精在空气中长期放置 C、水蒸气通过粉末 D、烧碱在空气中长期放置12. 下列试剂贮存方法错误的是( )A、少量金属钠贮存在煤油中 B、新制氯水避光贮存 C、浓硫酸贮存在铝罐中 D、浓硝酸贮存在无色透明细口瓶中13. 下列反应中,水作氧化剂的是( )A、铁粉与水蒸气 B、Na2O2与水 C、NO2与水 D、氯气与水14. 硅及其化合物广泛应用于生产生活,下列有关说法错误的是( )A、Si可以用作半导体材料 B、互联网通过光纤交换信息,光纤的主要原料是SiO2 C、硅酸钠的溶液俗称水玻璃,常用作木材的阻燃剂 D、玻璃上的精美刻花,是工艺师用盐酸刻蚀形成的15. 自来水可以用氯气消毒、某学生用这种自来水去配制下列物质的溶液,不会产生明显的药品变质问题的是 ①AgNO3 ②FeCl3 ③AlCl3 ④ NaOH ⑤FeCl2 ⑥Na2CO3( )A、①②⑥ B、③④ C、②③ D、④⑤⑥16. 有100毫升NaOH溶液,先向其中逐渐通入一定量的 , 随后向此溶液中逐滴加入4mol/L的盐酸溶液,产生的体积(标况)与所加入盐酸溶液的体积之间的关系如图所示,则NaOH溶液在吸收气体后,所得溶液中存在的溶质的物质的量之比为( )
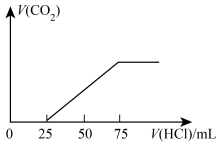 A、1:1 B、2:1 C、3:1 D、无法确定17. 下列各组中的两物质反应时,反应条件(温度、反应物用量比)改变,不会引起产物的种类改变的是( )A、Na和O2 B、Al2(SO4)3溶液和Ba(OH)2溶液 C、Na2O2和CO2 D、Ca(HCO3)2溶液和NaOH溶液18. 下列离子方程式书写正确的是( )A、NaHSO4 溶液和NaHSO3溶液混合:2H++=H2O+SO2↑ B、过量 CO2通入Ca(ClO)2溶液中:ClO-+CO2+H2O= +HClO C、碳酸钙与醋酸反应:CaCO3+2H+ = Ca2++CO2↑ + H2O D、Na 与水反应:Na+H2O = Na++OH-+H2↑19. 在CuO和Fe粉的混合物中,加入一定量的稀硫酸,并微热,当反应停止后,滤出不溶物,并向滤液中插入一枚铁钉,发现铁钉并无任何变化。根据上述现象,确定下面结论正确的是( )A、不溶物一定是Cu B、不溶物一定含铜,但不一定含铁 C、不溶物一定是Fe D、溶液中一定含有Fe2+ , 但不一定含有Cu2+20. 将由Al、CuO、Fe2O3组成的混合物10.0 g放入250 mL某浓度的盐酸中,混合物完全溶解,当再加入250 mL 2.0 mol·L-1的NaOH溶液时,得到的沉淀最多。该盐酸的浓度为( )A、0.5 mol·L-1 B、3.0 mol·L-1 C、2.0 mol·L-1 D、1.0 mol·L-1
A、1:1 B、2:1 C、3:1 D、无法确定17. 下列各组中的两物质反应时,反应条件(温度、反应物用量比)改变,不会引起产物的种类改变的是( )A、Na和O2 B、Al2(SO4)3溶液和Ba(OH)2溶液 C、Na2O2和CO2 D、Ca(HCO3)2溶液和NaOH溶液18. 下列离子方程式书写正确的是( )A、NaHSO4 溶液和NaHSO3溶液混合:2H++=H2O+SO2↑ B、过量 CO2通入Ca(ClO)2溶液中:ClO-+CO2+H2O= +HClO C、碳酸钙与醋酸反应:CaCO3+2H+ = Ca2++CO2↑ + H2O D、Na 与水反应:Na+H2O = Na++OH-+H2↑19. 在CuO和Fe粉的混合物中,加入一定量的稀硫酸,并微热,当反应停止后,滤出不溶物,并向滤液中插入一枚铁钉,发现铁钉并无任何变化。根据上述现象,确定下面结论正确的是( )A、不溶物一定是Cu B、不溶物一定含铜,但不一定含铁 C、不溶物一定是Fe D、溶液中一定含有Fe2+ , 但不一定含有Cu2+20. 将由Al、CuO、Fe2O3组成的混合物10.0 g放入250 mL某浓度的盐酸中,混合物完全溶解,当再加入250 mL 2.0 mol·L-1的NaOH溶液时,得到的沉淀最多。该盐酸的浓度为( )A、0.5 mol·L-1 B、3.0 mol·L-1 C、2.0 mol·L-1 D、1.0 mol·L-1二、填空题
-
21. 化学与我们的生活、生产、环境、资源利用等息息相关。回答下列问题:(1)、大气中下列气体含量的升高会对环境产生一定的影响,用物质的序号填空,过量会导致温室效应加剧的主要物质是 , 会造成酸雨的物质是 , 会导致光化学烟雾的物质是。
①二氧化碳 ②二氧化硫 ③氮氧化物NOx
(2)、电子工业常用质量分数为30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。写出FeCl3溶液与铜反应的离子方程式。(3)、饮用水消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一,漂白粉是常用的消 毒剂,其有效成分是 (填化学式)。Cl2是传统的自来水消毒剂,而ClO2是新型的自来水消毒剂,这两种消毒剂消毒完成后,氯元素均以Cl—形式存在。现要消毒1.00 m3生活污水,分别用Cl2和ClO2来消毒处理,所耗Cl2与ClO2的质量比值为 (保留小数点后2位)。三、综合题
-
22. 碘是人体不可缺少的元素,为防止碘缺乏病,需在精盐中添加一定量的KIO3。某研究性学习小组利用下列反应原理检验某加碘盐中是否含碘:KIO3+5KI+3H2SO4= 3K2SO4+3I2+3H2O(1)、用双线桥表示上述反应中的电子转移情况:。当有0.1 molKIO3参加反应时,转移电子的数目为。(2)、向KI—H2SO4溶液中加入适量碘盐,充分振荡,将生成的碘单质与K2SO4溶液分离, 所需试剂是(填序号),实验操作是 , 所用到的玻璃仪器是 和烧杯。
A.酒精 B.氯化铁溶液 C.四氯化碳 D.淀粉溶液
(3)、通过(2)小题实验,判断食盐中含碘的证据是。23. 绿钒(FeSO4•xH2O)是含有一定量结晶水的硫酸亚铁,在工农业生产中具有 重要的用途。某化学兴趣小组对绿钒的一些性质进行探究。回答下列问题:(1)、在试管中加入少量绿钒样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化,结论是 , 再向试管中通入空气,溶液逐渐变红,原因是。(2)、为测定绿钒中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重, 记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按如图连接好装置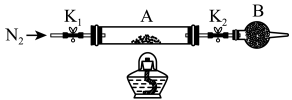
①仪器B的名称是。
②将下列实验操作步骤正确排序(填序号),重复上述操作步骤,直至A恒重,记为m3g。
a.点燃酒精灯,加热 b.打开K1和K2 , 缓缓通入N2 c.关闭K1和K2 d.熄灭酒精灯 e.称量A f.冷却到室温
(3)、根据实验记录,计算绿钒化学式中结品水数目x为(列式表示)。若实验时按a、b次序操作,则得出的x (填“偏大”、“偏小”或“无影响”)。(4)、为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A改用酒精喷灯加热。实验后反应管中残留固体为红色粉末,并将分解产生的气体依次通入右侧C、D装置。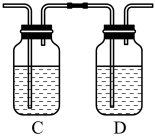
①C中的溶液为BaCl2其作用是 , D中的溶液为 , 可观察到的现象是。
②写出硫酸亚铁高温分解反应的化学方程式。
24. 工业上用铝土矿(主要成分为Al2O3 , 含有少量的Fe2O3、泥沙等杂质)提取 氧化铝作冶炼铝的原料,操作过程如图: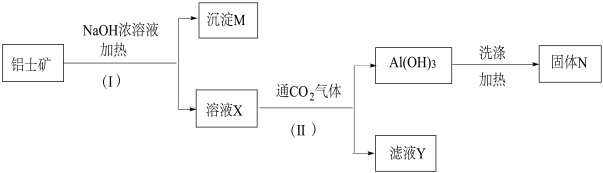 (1)、I和II步骤中分离溶液和沉淀的操作,所用到的玻璃仪器是:漏斗、烧杯、(2)、沉淀M中除含有泥沙外,一定还含有;固体N是。(3)、溶液X中,含铝元素的溶质的化学式为 , 它所属类别为 (填“酸”、“碱"或“盐")。(4)、实验室里常往AlCl3溶液中加入(填“氨水”或“NaOH溶液”)来制取Al(OH)3(5)、铝粉和氧化铁的混合物在高温下反应,放出大量的热,生成的液态铁可用来焊接铁轨。写出化学方程式:。
(1)、I和II步骤中分离溶液和沉淀的操作,所用到的玻璃仪器是:漏斗、烧杯、(2)、沉淀M中除含有泥沙外,一定还含有;固体N是。(3)、溶液X中,含铝元素的溶质的化学式为 , 它所属类别为 (填“酸”、“碱"或“盐")。(4)、实验室里常往AlCl3溶液中加入(填“氨水”或“NaOH溶液”)来制取Al(OH)3(5)、铝粉和氧化铁的混合物在高温下反应,放出大量的热,生成的液态铁可用来焊接铁轨。写出化学方程式:。
-