广东省广州市黄浦区2021-2022学年高一上学期期末考试化学试题
试卷更新日期:2022-10-10 类型:期末考试
一、单选题
-
1. 化学家为社会发展做出了巨大贡献,下列研究成果与化学家对应关系不符的是( )A、侯德榜发明侯氏制碱法,推动了我国纯碱工业的发展 B、屠呦呦提取抗疟药青蒿素,做出卓越贡献获得诺贝尔奖 C、门捷列夫发现元素周期律,使化学的研究变得有规律可循 D、阿伏加德罗提出原子学说,使人们对物质结构的认识发展到一个新阶段2. 化学知识在新冠肺炎疫情防控中发挥着重要作用。下列说法正确的是( )A、可用口服消毒液治疗新冠肺炎 B、用食盐水可以杀灭新型冠状病毒 C、氯气能杀灭新冠病毒,可以用氯气消毒环境 D、勤洗手、戴口罩是防止病毒入侵的有效方法3. 中国文化是宝贵的精神财富,下列语句中不涉及氧化还原反应的是( )A、星星之火可以燎原 B、曾青得铁化为铜 C、粉身碎骨浑不怕,要留清白在人间 D、爆竹声中一岁除,春风送暖入屠苏4. 科学技术的迅猛发展促进了社会的进步。下列科技成果涉及的材料中,主要成分不属于金属材料的是( )
选项
A
B
C
D
科技
成果

C919飞机外壳

“蛟龙”号耐压球壳

宇航服

地铁列车车体
成分
铝锂合金
钛合金
聚酯纤维
不锈钢
A、A B、B C、C D、D5. 我国航天器“天问一号”已于2021年2月到达火星,实现中国在深空探测领域的技术跨越。此次探测由核素提供能量。下列说法正确的是( )A、 原子核内中子数为247 B、原子核外电子数为96 C、247Bk 与247Cm互为同位素 D、、、互为同素异形体6. 下列化合物中,不能通过单质间化合直接制取的是( )A、FeCl2 B、CuCl2 C、HCl D、NaCl7. 某幼儿体检报告单的部分指标如表所示。下列说法错误的是( )某医疗机构临床检验结果报告单
分析项目
检测结果
单位
参考范围
1
钙(Ca)
1.05↓
m mol·L-1
1.55~2.10
2
铁(Fe)
6.05↓
m mol·L-1
7.52~11.82
3
锌(Zn)
112.92
μ mol·L-1
66~120
…
A、报告单中“μ mol·L-1 ”“m mol·L-1”都是物质的量浓度的单位 B、该幼儿钙元素含量偏低,需要补充钙元素,可以服用氢氧化钙溶液 C、该幼儿易患缺铁性贫血,可以通过食用猪肝、猪血等食物补充铁元素 D、补铁时服用维生素C可防止补铁剂中的Fe2+氧化为Fe3+ , 体现了维生素C的还原性8. 元素周期表中某区域的一些元素多用于制造半导体材料,它们是( )A、左下方区域的金属元素 B、右上方区域的非金属元素 C、金属元素和非金属元素分界线附近的元素 D、稀有气体元素9. 下列关于胶体的说法正确的是( )A、属于纯净物 B、一定是液体 C、可以产生丁达尔效应 D、分散质粒子直径小于1nm10. 依据下列实验事实,所得结论正确的是( )选项
实验

铜丝能导电

NaCl固体不导电

NaCl溶液能导电

熔融NaCl能导电
结论
铜是电解质
NaCl固体中不含离子
NaCl在通电条件下发生电离
NaCl是电解质
A、A B、B C、C D、D11. 宏观辨识与微观探析是化学学科核心素养之一 。 下列实验或事实对应离子方程式书写正确的是( )A、铜片放入稀盐酸中: 2H++Cu= Cu2++H2↑ B、Na投入CuSO4水溶液: 2Na+Cu2+ =Cu+2Na+ C、用小苏打治疗胃酸过多: H++HCO =H2O+CO2↑ D、氢氧化钡与稀硫酸反应: Ba2++ SO+ H++OH- =BaSO4↓+H2O12. 食品包裝袋内填充氮气或二氧化碳可以延长食品的保质期。同温、同压下,相同体积的N2和CO2良有相同的( )A、分子数 B、原子数 C、密度 D、质量13. 劳动创造幸福。下列家务劳动与所涉及的化学知识不相符的是( )选项
家务劳动
化学知识
A
将洗净的铁锅晾干
铁在潮湿环境中易生锈
B
用氢氧化钠固体和铝粉制成疏通剂疏通被油脂、毛发、菜渣等堵塞的管道
氢氧化钠具有吸水性
C
用牙膏去除茶杯中的污垢
牙膏中除了有清洁剂成分外还含有二氧化硅或者碳酸钙做摩擦剂
D
用84消毒液对家具和地板消毒
含氯消毒剂具有氧化性
A、A B、B C、C D、D14. 在无色透明溶液中,能大量共存的离子组是( )A、Na+、Ba2+、OH-、 B、K+、Na+、、 C、Cu2+、Zn2+、、Cl- D、Al3+、Ba2+、OH-、15. 我国自主研制的第五代隐形战斗机歼-31使用了高强度、耐高温的钛合金材料。工业上冶炼钛的反应为TiCl4 + 2MgTi + 2MgCl2 , 下列说法正确的( )A、TiCl4是还原剂 B、Mg被氧化 C、TiCl4 中氯元素被氧化 D、每1 mol TiCl4被还原时转移2 mol电子16. 设NA表示阿伏加德罗常数的值,下列叙述正确的是( )A、18g H2O中含有的电子数目为10 NA B、1 mol·L-1CaCl2溶液中,含有的Cl-数目为2 NA C、25℃、101kpa 下,22.4LCl2 含的有分子数目为NA D、常温下,1 mol Na与足量氧气反应成Na2O,转移的电子数目为2 NA17. 为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液.
错误的操作顺序是( )
A、⑤②④①③ B、④②⑤①③ C、②⑤④①③ D、⑤④②①③18. 化学是以实验为基础的科学。下列实验装置或操作,能达到实验目的的是( ) A、用装置甲制取Cl2 B、用装置乙分离NaCl和MgSO4 C、用装置丙蒸干溶液得到NaHCO3固体 D、用装置丁检验Na2O2与H2O反应的气体产物。19. 下列实验得出的推理或结论正确的是( )
A、用装置甲制取Cl2 B、用装置乙分离NaCl和MgSO4 C、用装置丙蒸干溶液得到NaHCO3固体 D、用装置丁检验Na2O2与H2O反应的气体产物。19. 下列实验得出的推理或结论正确的是( )选项
实验操作及现象
推理或结论
A
向某溶液中滴入KSCN,溶液显红色
溶液中一定含有Fe3+
B
向某溶液中加入硝酸银溶液,产生白色沉淀
溶液中一定含有Cl-
C
用铂丝蘸取某溶液在酒精灯外焰上灼烧,火焰呈黄色
溶液中一定不含K+
D
向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的气体
该溶液一定含有
A、A B、B C、C D、D20. 数字化实验将传感器、数据采集器和计算机一起相连,采集实验过程中各种物理量变化的数据并记录和呈现,如图采集的用强光照射盛有氯水的密闭广口瓶;并用传感器测定广口瓶中数据,得到如图曲线。下列说法错误的是( ) A、图(1)说明强光照射下,氯水中H+浓度增加 B、图(2)说明强光照射下,氯水中Cl-浓度增加。 C、图(3)说明强光照射下,氯水中有氧气生成 D、溶液中发生反应的离子方程式为2ClO- 2Cl-+O2↑21. CuCl2是一种可用于生产颜料、木材防腐剂等的化工产品。将铜粉加入稀盐酸中,并持续通入空气,在Fe3+的催化作用下可生成CuCl2(过程如图所示)。下列说法错误的是( )
A、图(1)说明强光照射下,氯水中H+浓度增加 B、图(2)说明强光照射下,氯水中Cl-浓度增加。 C、图(3)说明强光照射下,氯水中有氧气生成 D、溶液中发生反应的离子方程式为2ClO- 2Cl-+O2↑21. CuCl2是一种可用于生产颜料、木材防腐剂等的化工产品。将铜粉加入稀盐酸中,并持续通入空气,在Fe3+的催化作用下可生成CuCl2(过程如图所示)。下列说法错误的是( ) A、Fe3+可循环使用 B、过程I的反应为:2Fe3++Cu=2Fe2++Cu2+ C、过程II中的氧化剂为Fe2+ D、该过程总反应为:2Cu+O2+4H+=2Cu2++2H2O22. 部分含铁物质的分类与相应化合价关系如图所示。下列推断不合理的是( )
A、Fe3+可循环使用 B、过程I的反应为:2Fe3++Cu=2Fe2++Cu2+ C、过程II中的氧化剂为Fe2+ D、该过程总反应为:2Cu+O2+4H+=2Cu2++2H2O22. 部分含铁物质的分类与相应化合价关系如图所示。下列推断不合理的是( )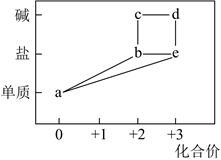
A、 可与 反应生成 B、 既可被氧化,也可被还原 C、可将 加入浓碱液中制得 的胶体 D、可存在 的循环转化关系23. ClO2是一种广谱型的消毒剂,根据世界环保联盟的要求ClO2将逐渐取代Cl2成为生产自来水的消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,在以上反应中NaClO3和Na2SO3的物质的量之比为( )A、1︰1 B、1︰2 C、2︰1 D、2︰3二、填空题
-
24. 实验室需配制850 mL 1.0 mol/L的盐酸。(1)、应选用容量瓶的规格是mL。容量瓶上标有 (填标号) 。
①容积 ②浓度 ③压强 ④温度
(2)、现用10mol/L的浓盐酸来配制,用量筒量取浓盐酸的体积为 , 若量取时俯视刻度线,则所配制溶液的浓度会 (填 “偏高”、“偏低” 或“不变”)。三、综合题
-
25. 元素周期律是重要的化学学习工具。随着原子序数变化,8种短周期元素(用字母表示)原子半径的相对大小、最高正化合价或最低负化合价的变化如图所示。
 (1)、b在元素周期表中的位置是周期 族。 8种元素中金属性最强的是 ( 用元素符号表示,下同),与d处于同一主族的是。(2)、b和c的最高价氧化物的水化物中,酸性较强的是 (用化学式表示) 。(3)、d和f形成的化合物为(用化学式表示),该化合物在熔融状态下能导电,属于化合物(填“离子”或“共价”)。d、e的单质在加热条件下反应生成的化合物中存在的化学键有。(4)、e和a可以形成化合物,该物质与水反应生成一种气体,该气体可能是。(5)、能说明h的非金属性比碘元素强的反应事实是(写一条)。26. 铁泥是钢铁厂废弃物,经分析其成分如下表:
(1)、b在元素周期表中的位置是周期 族。 8种元素中金属性最强的是 ( 用元素符号表示,下同),与d处于同一主族的是。(2)、b和c的最高价氧化物的水化物中,酸性较强的是 (用化学式表示) 。(3)、d和f形成的化合物为(用化学式表示),该化合物在熔融状态下能导电,属于化合物(填“离子”或“共价”)。d、e的单质在加热条件下反应生成的化合物中存在的化学键有。(4)、e和a可以形成化合物,该物质与水反应生成一种气体,该气体可能是。(5)、能说明h的非金属性比碘元素强的反应事实是(写一条)。26. 铁泥是钢铁厂废弃物,经分析其成分如下表:成分
Fe3O4
Fe2O3
FeO
Fe
水分
杂质
质量分数%
74.25
7.28
3.56
3.67
8.12
3.12
已知杂质不溶于酸。
综合利用废弃物,对资源利用和环境保护具有现实意义,铁泥常用于制备铁红,实验室模拟其工艺流程如下:
 (1)、酸浸过程中Fe2O3与硫酸的反应离子方程式为。(2)、转化过程中发生反应的离子方程式为。检验转化是否完全所用的试剂是。 从经济环保角度考虑,“转化” 中可替代H2O2的物质是。(3)、沉铁后洗涤滤渣2,检验滤渣2是否洗涤干净的方法是:取少量最后一次的洗涤液于试管中, , 则已经洗涤干净。(4)、煆烧步骤的化学反应方程式为。27. 舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体“氯气”。(1)、实验室沿用舍勒的方法制取Cl2的化学方程式为 。(2)、实验室制取干燥Cl2时,净化与收集Cl2所需装置的接口连接顺序为 。
(1)、酸浸过程中Fe2O3与硫酸的反应离子方程式为。(2)、转化过程中发生反应的离子方程式为。检验转化是否完全所用的试剂是。 从经济环保角度考虑,“转化” 中可替代H2O2的物质是。(3)、沉铁后洗涤滤渣2,检验滤渣2是否洗涤干净的方法是:取少量最后一次的洗涤液于试管中, , 则已经洗涤干净。(4)、煆烧步骤的化学反应方程式为。27. 舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体“氯气”。(1)、实验室沿用舍勒的方法制取Cl2的化学方程式为 。(2)、实验室制取干燥Cl2时,净化与收集Cl2所需装置的接口连接顺序为 。 (3)、用NaOH吸收尾气时生成NaClO。
(3)、用NaOH吸收尾气时生成NaClO。①NaClO中Cl元素的化合价为。从物质类别来看, NaClO 属于。
②某小组欲探究NaClO溶液的酸碱性、氧化性和漂白性,可供选择的用品有: NaClO 溶液、盐酸、酚酞、有色布条、pH计。请完成以下实验报告。
实验
编号
实验操作
实验现象
结论
离子方程式
1
用pH计测NaClO溶液的pH
常温下 ,测得pH>7
/
2
向NaClO 溶液中加适量盐酸
NaClO有氧化性
3
NaClO有漂白性
/
③讨论:实验1不能用酚酞进行检验,原因是。
(4)、实验结束,离开实验室之前,下列做法正确的是____ (填标号) 。A.废弃药品直接倒入水池冲走A、实验用品放回原处 B、清洁实验仪器,打扫实验室卫生 C、关闭水电、门窗
-