浙江省温州市2021-2022学年高二上学期期末教学质量统一检测化学试题
试卷更新日期:2022-10-10 类型:期末考试
一、单选题
-
1. 下列物质属于弱电解质的是( )A、K2SO4 B、NaOH C、NH3·H2O D、HClO42. 下列物质因发生水解而使溶液呈酸性的是:( )A、Ca(OH)2 B、AlCl3 C、NaHSO4 D、KNO33. 下列名称及其对应的仪器错误的是( )

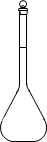
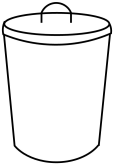
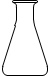
A.
 具支试管
具支试管B.烧瓶
C.坩埚
D.锥形瓶
A、A B、B C、C D、D4. 下列描述不能用勒夏特列原理解释的是( )A、工业制备硫酸时采用高温常压氧化二氧化硫 B、实验室用排饱和食盐水的方法收集Cl2 C、工业合成氨时将氨液化分离 D、打开密封的可乐瓶,会有气泡往上冒5. 下列说法错误的是( )A、利用原子光谱上的特征谱线来鉴定元素,称为光谱分析 B、核外电子的概率密度分布被称为电子云 C、等离子体和离子液体都具有良好的导电性 D、用X射线衍射摄取石英玻璃和水晶的粉末得到的图谱是相同的6. 下列化学用语错误的是( )A、基态Cu的价层电子排布式3d94s2 B、H2O的VSEPR模型 C、Fe3+价层电子轨道表示式
C、Fe3+价层电子轨道表示式  D、CH2O的空间充填模型
D、CH2O的空间充填模型 7. 反应A+B→C分两步进行:①A+B→X (ΔH<0),②X→C(ΔH>0),E1表示反应①的活化能,E2表示反应②的活化能。下列图示正确的是( )A、
7. 反应A+B→C分两步进行:①A+B→X (ΔH<0),②X→C(ΔH>0),E1表示反应①的活化能,E2表示反应②的活化能。下列图示正确的是( )A、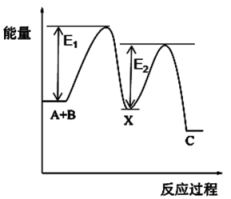 B、
B、 C、
C、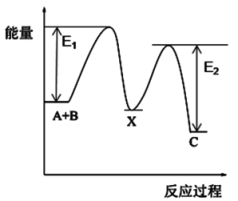 D、
D、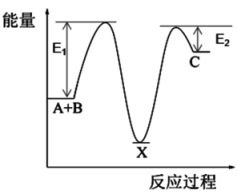 8. 下列结构属于晶胞且对应的化学式错误的是 (图中:●— X,○— Y)( )
8. 下列结构属于晶胞且对应的化学式错误的是 (图中:●— X,○— Y)( )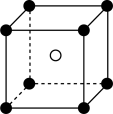



A.XY
B.XY2
C.XY3
D.X2Y
A、A B、B C、C D、D9. 已知反应:2MnO+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,在室温下迅速混合反应液,2min内测得c(MnO)从0.1mol/L减少到0.02mol/L(反应过程中忽略溶液体积的变化),下列说法正确的是( )A、υ(MnO)=0.04 mol∙L−1∙s−1 B、υ(Mn2+)=0.02 mol∙L−1∙min−1 C、υ(H2C2O4)=0.1 mol∙L−1∙min−1 D、2min内产生的CO2为8.96L10. 向Na2CO3溶液中滴加盐酸,发生如下转化,下列说法正确的是( )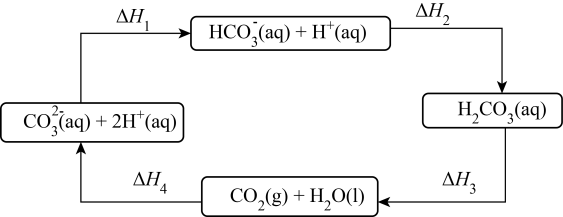 A、ΔH4=ΔH1+ΔH2+ΔH3 B、CO(aq)+2H+(aq)=H2CO3(aq)ΔH=ΔH1-ΔH2 C、HCO电离时吸热,则ΔH1>0 D、ΔH2<ΔH311. 汽车尾气(含CO、NO与SO2等)是城市空气的主要污染源之一,治理的办法是在汽车排气管上安装催化转化器,其反应原理是:2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH<0。下列说法正确的是( )A、该反应是△S>0 B、该反应使用合适的催化剂就可自发 C、该反应低温下能自发进行 D、提高空气燃料比,一定可以减少NO、CO的排放12. 下列关于共价键的描述正确的是( )A、两个原子的单电子若自旋方向相同,则两两配对可形成共价键 B、原子轨道具有一定的伸展方向,所形成的共价键都具有方向性 C、两个原子的p轨道不仅能形成σ键,也能形成π键 D、气体单质中一定存在σ键,可能存在π键13. 已知A、B、C、D、E、F六种元素在元素周期表中的位置如图,下列说法正确的是( )
A、ΔH4=ΔH1+ΔH2+ΔH3 B、CO(aq)+2H+(aq)=H2CO3(aq)ΔH=ΔH1-ΔH2 C、HCO电离时吸热,则ΔH1>0 D、ΔH2<ΔH311. 汽车尾气(含CO、NO与SO2等)是城市空气的主要污染源之一,治理的办法是在汽车排气管上安装催化转化器,其反应原理是:2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH<0。下列说法正确的是( )A、该反应是△S>0 B、该反应使用合适的催化剂就可自发 C、该反应低温下能自发进行 D、提高空气燃料比,一定可以减少NO、CO的排放12. 下列关于共价键的描述正确的是( )A、两个原子的单电子若自旋方向相同,则两两配对可形成共价键 B、原子轨道具有一定的伸展方向,所形成的共价键都具有方向性 C、两个原子的p轨道不仅能形成σ键,也能形成π键 D、气体单质中一定存在σ键,可能存在π键13. 已知A、B、C、D、E、F六种元素在元素周期表中的位置如图,下列说法正确的是( ) A、离子半径:A<C B、最高价氧化物对应的水化物的碱性:C<D C、B元素对应的氢化物熔沸点高是因为含有很强的共价键 D、E形成的单质属于共价晶体,其熔点高,硬度大14. 已知A、B、C、D、E、F六种元素在元素周期表中的位置如图,下列说法错误的是( )
A、离子半径:A<C B、最高价氧化物对应的水化物的碱性:C<D C、B元素对应的氢化物熔沸点高是因为含有很强的共价键 D、E形成的单质属于共价晶体,其熔点高,硬度大14. 已知A、B、C、D、E、F六种元素在元素周期表中的位置如图,下列说法错误的是( ) A、元素的电负性:A<B B、元素的第一电离能:C<D C、E元素原子最高能级的不同轨道都有电子 D、F元素原子最外层只有一种自旋方向的电子15. 鲍林提出杂化轨道理论能解释分子的空间结构,下列关于粒子的描述正确的是( )
A、元素的电负性:A<B B、元素的第一电离能:C<D C、E元素原子最高能级的不同轨道都有电子 D、F元素原子最外层只有一种自旋方向的电子15. 鲍林提出杂化轨道理论能解释分子的空间结构,下列关于粒子的描述正确的是( )选项
粒子
空间结构
解释
A
SO2
V形
S原子采取sp2杂化
B
BF3
三角锥形
B原子采取sp3杂化
C
C2H4
平面三角形
C原子采取sp2杂化
D
ClO
四面体形
Cl原子采取sp3杂化
A、A B、B C、C D、D16. 下列离子方程式书写错误的是( )A、钢铁发生吸氧腐蚀的总反应:2Fe + O2 + 2H2O = 2Fe(OH)2 B、用铁作阳极电解饱和食盐水:2Cl-+ 2H2O 2OH- + Cl2↑ + H2↑ C、向多元弱酸H3PO4中加入过量烧碱:H3PO4 + 3OH- = PO+ 3H2O D、向ZnS沉淀中滴加CuSO4溶液可得到CuS沉淀:Cu2+(aq) + ZnS(s) CuS(s) + Zn2+(aq)17. 在1100℃,一定容积的密闭容器中发生反应:FeO(s)+CO(g)⇌Fe(s)+CO2(g) △H=a kJ/mol(a >0),该温度下K=0.263,下列有关该反应的说法正确的是( )A、若生成1 mol Fe,则吸收的热量小于a kJ B、若升高温度,则正反应速率加快,逆反应速率加快,化学平衡逆向移动 C、若容器内压强不随时间变化,则可以判断该反应已达到化学平衡状态 D、达到化学平衡状态时,若c(CO)=0.100 mol/L,则c(CO2)=0.0263 mol/L18. 2019年的诺贝尔化学奖授予锂离子电池研究的三位科学家。下图是一种锂离子电池的工作原理示意图,其负极材料为嵌锂石墨,正极材料为LiCoO2 , 其总反应可表示为:LixCy+Li1−xCoO2=LiCoO2+Cy。下列说法错误的是( ) A、放电时锂离子由a极脱嵌,移向b极 B、充电时b极的反应式为:LiCoO2−xe-=Li1−xCoO2+xLi+ C、充电时,a极接正极,发生还原反应 D、使用LiPF6的碳酸酯溶液作电解液是为了避免使用水溶剂会与金属锂反应19. 类比推理是化学中常用的思维方法,下列推理正确的是( )A、CCl4的熔沸点小于SiCl4 , 则NCl3的熔沸点小于PCl3 B、CH3CH2OH在水中的溶解度很大,则1−戊醇在水中的溶解度也很大 C、N≡N由于键能大而结构稳定,则C≡C键能也大结构也很稳定 D、AgNO3溶液和过量NaOH反应先生成白色沉淀,然后转变为灰色,则AgNO3溶液和过量NH3·H2O反应现象也相同20. 常温下,0.10mol/L的一元酸HA,下列事实不能证明该酸为弱酸的是( )A、0.10mol/L的NaA溶液中 =104 B、往该酸溶液中加入碳酸钠固体,发现有CO2生成 C、往该酸溶液中滴加同浓度NaOH溶液呈中性时,酸和碱溶液的体积关系:VNaOH< VHA D、若测得该酸溶液pH=a,加蒸馏水稀释该溶液至10倍,测得pH=b,b<a+121. 乙二胺与CuCl2可形成配离子[Cu(H2NCH2CH2NH2)2]2+(如图所示),下列有关说法错误的是( )
A、放电时锂离子由a极脱嵌,移向b极 B、充电时b极的反应式为:LiCoO2−xe-=Li1−xCoO2+xLi+ C、充电时,a极接正极,发生还原反应 D、使用LiPF6的碳酸酯溶液作电解液是为了避免使用水溶剂会与金属锂反应19. 类比推理是化学中常用的思维方法,下列推理正确的是( )A、CCl4的熔沸点小于SiCl4 , 则NCl3的熔沸点小于PCl3 B、CH3CH2OH在水中的溶解度很大,则1−戊醇在水中的溶解度也很大 C、N≡N由于键能大而结构稳定,则C≡C键能也大结构也很稳定 D、AgNO3溶液和过量NaOH反应先生成白色沉淀,然后转变为灰色,则AgNO3溶液和过量NH3·H2O反应现象也相同20. 常温下,0.10mol/L的一元酸HA,下列事实不能证明该酸为弱酸的是( )A、0.10mol/L的NaA溶液中 =104 B、往该酸溶液中加入碳酸钠固体,发现有CO2生成 C、往该酸溶液中滴加同浓度NaOH溶液呈中性时,酸和碱溶液的体积关系:VNaOH< VHA D、若测得该酸溶液pH=a,加蒸馏水稀释该溶液至10倍,测得pH=b,b<a+121. 乙二胺与CuCl2可形成配离子[Cu(H2NCH2CH2NH2)2]2+(如图所示),下列有关说法错误的是( ) A、该配离子中心离子是Cu2+ , 配位数为2 B、该配离子中既有极性键又有非极性键 C、乙二胺分子中H—N—H的键角小于H—C—H的键角 D、乙二胺分子沸点高于ClCH2CH2Cl22. 次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数α[α(X)= , X为HClO或ClO−]与pH的关系如图所示。下列说法正确的是( )
A、该配离子中心离子是Cu2+ , 配位数为2 B、该配离子中既有极性键又有非极性键 C、乙二胺分子中H—N—H的键角小于H—C—H的键角 D、乙二胺分子沸点高于ClCH2CH2Cl22. 次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数α[α(X)= , X为HClO或ClO−]与pH的关系如图所示。下列说法正确的是( ) A、对氯水加热,可使α(HClO)增大,漂白和杀菌作用更好 B、NaClO的水解常数:pKh=6.5 C、将等物质的量的NaClO和HClO混合物溶于水,所得的溶液中离子浓度大小顺序为:c(Na+)>c(ClO−)> c(H+) > c(OH-) D、在含HClO和ClO−的溶液中,随着pH的变化,则有:c(ClO−)+c(OH-)=c(H+)23. 常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)⇌Ni(CO)4 (g) △H<0 平衡常数为K
A、对氯水加热,可使α(HClO)增大,漂白和杀菌作用更好 B、NaClO的水解常数:pKh=6.5 C、将等物质的量的NaClO和HClO混合物溶于水,所得的溶液中离子浓度大小顺序为:c(Na+)>c(ClO−)> c(H+) > c(OH-) D、在含HClO和ClO−的溶液中,随着pH的变化,则有:c(ClO−)+c(OH-)=c(H+)23. 常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)⇌Ni(CO)4 (g) △H<0 平衡常数为K
已知:①230℃时,该反应的正反应平衡常数K远小于逆反应平衡常数K’②Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
下列判断正确的是( )
A、增加c(CO),平衡向正向移动,反应的平衡常数K增大 B、该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO) C、混合气体加热到230℃,Ni(CO)4分解率较低 D、温度T1若在30℃、50℃、80℃之间选择,应选50℃24. 以NA表示阿伏加德罗常数的值,下列说法正确的是( ) A、18 g冰(如图1)中含氢键数目为4NA B、88 g干冰(如图2)中含有0.5NA个晶胞结构单元 C、25℃,1L pH=4的0.1 mol∙L−1 K2Cr2O7溶液中Cr2O离子数为0.1NA D、100 mL 0.1 mol∙L−1的NaOH水溶液中含有氧原子数为0.01NA25. 下列方案设计、现象和结论都正确的是( )
A、18 g冰(如图1)中含氢键数目为4NA B、88 g干冰(如图2)中含有0.5NA个晶胞结构单元 C、25℃,1L pH=4的0.1 mol∙L−1 K2Cr2O7溶液中Cr2O离子数为0.1NA D、100 mL 0.1 mol∙L−1的NaOH水溶液中含有氧原子数为0.01NA25. 下列方案设计、现象和结论都正确的是( )目的
方案设计
现象与结论
A
验证压强对化学平衡的影响
先将注射器充满NO2气体,然后将活塞往里推压缩体积
观察到注射器内气体颜色加深,证明加压平衡朝生成NO2气体的方向移动
B
铜的电解精炼
待精炼的铜和纯铜连接外加直流电源的阳极和阴极,用硫酸铜溶液作电解质电解
阳极上铜逐渐溶解,阴极上铜逐渐析出,硫酸铜溶液浓度保持不变
C
制备[Cu(NH3)4]SO4·H2O晶体
向4mL 0.1mol/LCuSO4溶液中滴加氨水,先形成难溶物,并继续滴加沉淀溶解,然后蒸发溶剂析出晶体
反应过程中,NH3的N给出孤对电子,Cu2+接受电子对,形成了稳定的配位键[Cu(NH3)4]2+
D
除去锅炉水垢中的CaSO4
先用碳酸钠溶液浸泡水垢,然后再用盐酸除去
利用Ksp(CaSO4)> Ksp(CaCO3),实现沉淀的转化
A、A B、B C、C D、D二、填空题
-
26. 按要求回答以下问题:(1)、已知MgCl2水解时会生成中间产物碱式氯化镁Mg(OH)Cl(白色,不溶于水),写出该反应的离子方程式;(2)、由以下数据可知:
羧酸
pKa
乙酸(CH3COOH)
4.76
三氯乙酸(CCl3COOH)
0.65
酸性比较:乙酸三氯乙酸(填“>”、“<”或“=”),并说明原因:;
(3)、向碘的四氯化碳溶液中加入一定量 KI水溶液,振荡后,四氯化碳层紫红色变浅,水层溶液显黄色,请从平衡和结构的角度解释产生该现象的原因:;27. 2021年12月09日,中国太空课堂介绍了空间站利用CO2与H2的反应,将航天员呼出的CO2转化为H2O,然后通过电解H2O得到O2 , 从而实现O2的再生。已知:① CO2(g)+4H2(g) = CH4(g)+2H2O(l) △H1 = -252.9 kJ/mol
②2H2O(l) = 2H2(g)+O2(g) △H2 = +571.6 kJ/mol
③ H2O(l) = H2O(g) △H3 = +44.0 kJ/mol
回答下列问题:
(1)、写出甲烷的燃烧热的热化学方程式(2)、已知O—H、H—H的键能分别为462.8 kJ/mol、436 kJ/mol,则O=O的键能kJ/mol(写出计算过程)三、综合题
-
28. 用广谱高效的二氧化氯(ClO2)替代液氯进行消毒,可避免产生对人体健康有害的有机氯代物。(1)、工业上,ClO2常用NaClO3和Na2SO3溶液混合并加硫酸酸化后反应制得,写出该反应的离子方程式(2)、化学小组欲对用ClO2消毒过的自来水进行氯元素含量的测定(假设ClO2全部转化为Cl—),进行如下实验:向20.00mL水样中加几滴K2CrO4溶液作指示剂(利用Ag+和CrO反应生成砖红色沉淀指示滴定终点),用0.001000 mol∙L−1 AgNO3溶液滴定。
①下列操作顺序是:()→()→()→ A→C→()→()(用序号字母填写)
A.移取20.00 mL待测水样注入洁净的锥形瓶中,并加入2~3滴K2Cr2O7试液
B.重复实验2次
C.把锥形瓶放在滴定管的下面,垫上白纸
D.在清水洗涤后,用标准溶液润洗滴定管2~3次
E.取标准液注入滴定管至刻度线0以上2~3cm,并固定在铁架台上
F.用标准液滴定至溶液出现砖红色沉淀时,停止滴定,并记下滴定管液面的刻度V2
G.排气泡后,记下读数V1
②盛装上述待测液和标准液需要用到的滴定管分别为和 (填“甲”或“乙”)

③下列操作或误差判断正确的是
A.滴定过程中,眼睛始终注视锥形瓶中溶液颜色的变化
B.锥形瓶清洗后需要用待测水样润洗2~3次
C.滴定完成后,俯视滴定管读数,会造成滴定结果偏高
D.若滴定结束发现滴定管中出现气泡,则使结果偏低
④实验数据如下表:
实验次数
滴定前读数/mL
滴定前读数/mL
1
0.10
12.22
2
1.25
13.37
3
0.82
14.52
则:该水样中Cl-物质的量浓度是mol/L
29. 2021年7月,习近平总书记要求将碳达峰、碳中和落实情况纳入中央生态环境治理督察,实现无害化处理是环境治理的一个重要的方法。已知:反应Ⅰ N2O(g) + CO(g) N2(g) + CO2(g) ΔH<0
(1)、N2O和CO在Fe+作用下发生的反应分两步进行:第一步:Fe+ + N2O → FeO+ + N2
第二步:FeO++ CO → Fe+ + CO2
反应过程的能量变化如图所示:

①决定总反应速率的是(填“第一步”或“第二步)
②下列有关说法正确的是
A.Fe+改变反应历程,也改变了反应的ΔH
B.升高温度,CO2的体积分数减小
C.FeO+是中间产物,也可叫作催化剂
D.第二步反应中有极性共价键的断裂和形成
(2)、已知净反应速率(Δv):Δv=v(正) _ v(逆) (v(正)、v(逆)分别为正、逆反应速率)。①关于反应Ⅰ在不同温度下,达到平衡时有:Δv (500 K) Δv (550 K)(填“>”、“<”或“=”)
②反应Ⅰ的平衡常数为K1 , 请在图中画出pK(pK=—lgK1)随温度(T)的变化趋势
 (3)、草酸钙CaC2O4是陶瓷上釉时的重要原料之一,已知草酸钙在500℃时会发生如下的分解反应:反应Ⅱ CaC2O4 (s)CaCO3(s) + CO(g) 平衡常数K2=e,向1L密闭容器中加入足量的CaC2O4固体,再充入一定量的N2O气体,起始压强为b,发生反应Ⅰ、Ⅱ后达到平衡时总压强为c。则500℃时反应Ⅰ的平衡常数K1=。(用e,b,c来表示)30. 锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:(1)、基态Zn原子中不同运动状态的电子种,其价层电子轨道表示式为;Zn元素位于元素周期表的区。(2)、Zn与Cu的第一电离能的比较:ZnCu(填“>”、“<”或“=”),理由是。(3)、Zn2+形成的某种化合物M是常见的补锌剂,其结构如图所示,M中含有的σ键与π键的数目比为。
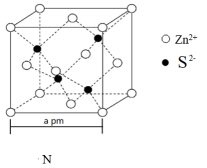
(3)、草酸钙CaC2O4是陶瓷上釉时的重要原料之一,已知草酸钙在500℃时会发生如下的分解反应:反应Ⅱ CaC2O4 (s)CaCO3(s) + CO(g) 平衡常数K2=e,向1L密闭容器中加入足量的CaC2O4固体,再充入一定量的N2O气体,起始压强为b,发生反应Ⅰ、Ⅱ后达到平衡时总压强为c。则500℃时反应Ⅰ的平衡常数K1=。(用e,b,c来表示)30. 锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:(1)、基态Zn原子中不同运动状态的电子种,其价层电子轨道表示式为;Zn元素位于元素周期表的区。(2)、Zn与Cu的第一电离能的比较:ZnCu(填“>”、“<”或“=”),理由是。(3)、Zn2+形成的某种化合物M是常见的补锌剂,其结构如图所示,M中含有的σ键与π键的数目比为。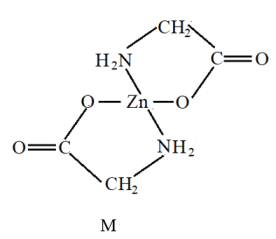 (4)、Zn与S形成的化合物N,其晶胞结构如图所示。每个Zn2+周围等距离且紧邻的Zn2+有个;若晶胞边长为a pm,则ZnS晶体的密度为g·cm-3(只需列出用含a、NA的计算式)。
(4)、Zn与S形成的化合物N,其晶胞结构如图所示。每个Zn2+周围等距离且紧邻的Zn2+有个;若晶胞边长为a pm,则ZnS晶体的密度为g·cm-3(只需列出用含a、NA的计算式)。