四川省宜宾市2021-2022学年高二上学期理科期末考试化学试题
试卷更新日期:2022-10-10 类型:期末考试
一、单选题
-
1. 化学与生产、生活、社会密切相关。下列有关说法中错误的是( )A、自来水厂可用明矾进行杀菌消毒 B、将CO2转化为乙醇有利于减少碳排放 C、太阳能电池感光板所用主要材料为晶体硅 D、食品放入冰箱中变质速率减慢2. 锗元素在元素周期表中的信息如图所示。下列有关锗元素的说法错误的是( )
 A、属于金属元素 B、位于第四周期IVA族 C、原子核外有32个电子 D、相对原子质量为72.63g/mol3. 下列区别晶体和非晶体最可靠的方法是( )A、观察形状 B、光谱仪测定 C、X射线衍射法 D、质谱仪测定4. 配位化合物[Cu(NH3)4]SO4中,不含有的化学键是( )A、离子键 B、极性键 C、非极性键 D、配位键5. 下列化学用语表达正确的是( )A、H2O2电子式: B、硅原子最外层电子的电子排布图:
A、属于金属元素 B、位于第四周期IVA族 C、原子核外有32个电子 D、相对原子质量为72.63g/mol3. 下列区别晶体和非晶体最可靠的方法是( )A、观察形状 B、光谱仪测定 C、X射线衍射法 D、质谱仪测定4. 配位化合物[Cu(NH3)4]SO4中,不含有的化学键是( )A、离子键 B、极性键 C、非极性键 D、配位键5. 下列化学用语表达正确的是( )A、H2O2电子式: B、硅原子最外层电子的电子排布图: C、钾原子最外层电子占据的能级符号:N
D、氯原子的结构示意图:
C、钾原子最外层电子占据的能级符号:N
D、氯原子的结构示意图: 6. 下列有关元素性质的说法中,错误的是( )A、电负性:C>H B、阴离子半径: C、第一电离能:O>N D、金属性:Na>Li7. 有关晶体或晶胞结构如下图所示。下列说法错误的是( )
6. 下列有关元素性质的说法中,错误的是( )A、电负性:C>H B、阴离子半径: C、第一电离能:O>N D、金属性:Na>Li7. 有关晶体或晶胞结构如下图所示。下列说法错误的是( )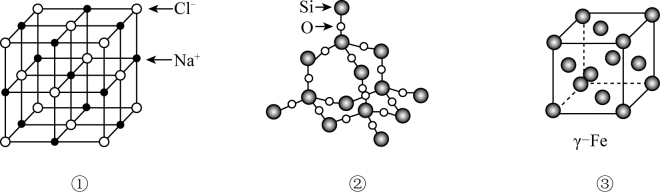 A、晶胞①中Na+的配位数为8 B、晶体②中Si和Si-O个数比为1:4 C、晶胞③中原子堆积方式为面心立方最密堆积 D、三种晶体中微粒间作用力均不相同8. 700℃,恒容密闭容器中发生反应:。下列不能说明该反应已达到平衡状态的是( )A、v(NO)逆=2v(CO2)正 B、气体密度不再改变 C、压强不再改变 D、气体平均摩尔质量不再改变9. 下列有关物质性质的说法错误的是( )A、酸性:HClO4>H2SO4 B、沸点:NH3>PH3 C、范德华力:HBr>HCl D、水中的溶解性:I2>NH310. 将等物质的量的X和Y投入某密闭容器中发生反应: , 达平衡后,改变某一条件,引起的变化正确的是( )
A、晶胞①中Na+的配位数为8 B、晶体②中Si和Si-O个数比为1:4 C、晶胞③中原子堆积方式为面心立方最密堆积 D、三种晶体中微粒间作用力均不相同8. 700℃,恒容密闭容器中发生反应:。下列不能说明该反应已达到平衡状态的是( )A、v(NO)逆=2v(CO2)正 B、气体密度不再改变 C、压强不再改变 D、气体平均摩尔质量不再改变9. 下列有关物质性质的说法错误的是( )A、酸性:HClO4>H2SO4 B、沸点:NH3>PH3 C、范德华力:HBr>HCl D、水中的溶解性:I2>NH310. 将等物质的量的X和Y投入某密闭容器中发生反应: , 达平衡后,改变某一条件,引起的变化正确的是( )条件改变
引发变化
A
加入合适催化剂
活化分子百分数增大
B
缩小容器体积
X的浓度不变
C
加入Y
平衡正向移动
D
升高温度
X的转化率增大
A、A B、B C、C D、D11. 下列关于晶体性质的比较中,错误的是( )A、熔点:SiO2>CO2 B、硬度:金刚石>晶体硅 C、延展性:Fe>Au D、晶格能:MgO>Na2O12. 将同浓度、同体积的盐酸与醋酸分别与足量的镁条反应(忽略镁条表面积差异),测得恒容密闭容器中压强随时间的变化曲线如下图所示。下列说法正确的是( ) A、曲线①表示盐酸与镁条的反应 B、开始时,盐酸与醋酸c(H+)相等 C、0~100s,醋酸的c(H+)下降更快 D、较长时间后,容器内压强基本相等13. W、X、Y、Z为原子序数依次增大的短周期主族元素,W、Y、Z位于不同周期,X的一种核素常用于检测文物的年代,Z在短周期主族元素中原子半径最大,W、X、Y的最外层电子数之和等于Z的核外电子总数。下列说法正确的是( )A、原子半径:X>Y>W B、Y最高正价为+6价 C、简单氢化物的稳定性:X>Y D、Y与Z只能形成一种化合物14. 设NA为阿伏加德罗常数的值。下列说法正确的是( )A、3.65gH35Cl中含质子数目为1.8NA B、3.6gH2O中含电子数目为2NA C、1L1mol/LFeCl3溶液中Fe3+数目为NA D、1molN2与足量H2反应生成NH3分子数为2NA15. 常温下,向10mL0.05mol/LNaHCO3溶液中滴加0.05mol/LNaOH溶液,测得溶液的pH随着加入NaOH溶液体积的变化如下图所示。下列说法正确的是( )
A、曲线①表示盐酸与镁条的反应 B、开始时,盐酸与醋酸c(H+)相等 C、0~100s,醋酸的c(H+)下降更快 D、较长时间后,容器内压强基本相等13. W、X、Y、Z为原子序数依次增大的短周期主族元素,W、Y、Z位于不同周期,X的一种核素常用于检测文物的年代,Z在短周期主族元素中原子半径最大,W、X、Y的最外层电子数之和等于Z的核外电子总数。下列说法正确的是( )A、原子半径:X>Y>W B、Y最高正价为+6价 C、简单氢化物的稳定性:X>Y D、Y与Z只能形成一种化合物14. 设NA为阿伏加德罗常数的值。下列说法正确的是( )A、3.65gH35Cl中含质子数目为1.8NA B、3.6gH2O中含电子数目为2NA C、1L1mol/LFeCl3溶液中Fe3+数目为NA D、1molN2与足量H2反应生成NH3分子数为2NA15. 常温下,向10mL0.05mol/LNaHCO3溶液中滴加0.05mol/LNaOH溶液,测得溶液的pH随着加入NaOH溶液体积的变化如下图所示。下列说法正确的是( ) A、a点:溶液中的水解程度小于电离程度 B、b点: C、b→c过程中: D、c点:16. 七彩神仙鱼在pH为6.2~6.8的环境中能迅速生长,pH≤6则难以存活。常温下,若1000L某湖水含有0.5molH2SO4。下列说法正确的是( )A、当前湖水的环境适宜七彩神仙鱼生长 B、当前湖水中,水电离的 C、若将该湖水稀释103倍,湖水环境不利于七彩神仙鱼生长 D、若将该湖水稀释107倍,湖水pH变为1017. 由下列实验操作和现象能得出相应结论的是( )
A、a点:溶液中的水解程度小于电离程度 B、b点: C、b→c过程中: D、c点:16. 七彩神仙鱼在pH为6.2~6.8的环境中能迅速生长,pH≤6则难以存活。常温下,若1000L某湖水含有0.5molH2SO4。下列说法正确的是( )A、当前湖水的环境适宜七彩神仙鱼生长 B、当前湖水中,水电离的 C、若将该湖水稀释103倍,湖水环境不利于七彩神仙鱼生长 D、若将该湖水稀释107倍,湖水pH变为1017. 由下列实验操作和现象能得出相应结论的是( )操作
现象
结论
A
向醋酸溶液中滴加Na2CO3溶液
有气泡产生
醋酸是弱酸
B
充满NO2的密闭玻璃球浸泡在热水中
玻璃球中红棕色加深的
的△H<0
C
FeCl3溶液加入到浑浊的天然淡水中
静置后水变澄清
Fe3+具有吸附性
D
取1 mL0.1 mol/LMgCl2溶液,向其中滴加1滴2 mol/LNaOH溶液,再滴加2滴0.1 mol/LFeCl3溶液
先出现白色沉淀,后部分转变成红褐色
溶解度:Fe(OH)3>Mg(OH)2
A、A B、B C、C D、D18. 下列有关离子方程式的书写正确的是( )A、向酸性KMnO4溶液中滴加H2C2O4溶液: B、向FeI2溶液中通入少量Cl2: C、向AgCl悬浊液中滴入Na2S溶液: D、向FeCl3溶液滴入KSCN溶液:Fe3++3SCN-Fe(SCN)3↓19. 25℃时,向高铁酸钾(K2FeO4)水溶液中加酸过程中,平衡体系中含Fe微粒的分布系数δ[如]随pH的变化曲线如下图所示。下列说法正确的是( ) A、高铁酸为三元酸 B、pH=2时, C、向K2FeO4水溶液中加入KOH,水解程度增大 D、的平衡常数20. 某温度下,向10mL0.1mol/LCuCl2溶液中滴加0.1mol/LNa2S溶液,滴加过程中,与Na2S溶液体积关系如下图所示。下列说法错误的是( )
A、高铁酸为三元酸 B、pH=2时, C、向K2FeO4水溶液中加入KOH,水解程度增大 D、的平衡常数20. 某温度下,向10mL0.1mol/LCuCl2溶液中滴加0.1mol/LNa2S溶液,滴加过程中,与Na2S溶液体积关系如下图所示。下列说法错误的是( ) A、该温度下,Ksp(CuS)的数量级为 B、曲线上各点满足: C、相同条件下,若改为0.2mol/LCuCl2溶液,反应终点由b移向a D、相同条件下,若改为0.2mol/LZnCl2溶液,反应终点由b向c方向移动
A、该温度下,Ksp(CuS)的数量级为 B、曲线上各点满足: C、相同条件下,若改为0.2mol/LCuCl2溶液,反应终点由b移向a D、相同条件下,若改为0.2mol/LZnCl2溶液,反应终点由b向c方向移动二、综合题
-
21. 第VA族元素氮、磷、砷的化合物用途广泛。回答下列问题:(1)、基态磷原子的电子排布式为 , 基态砷原子核外有个未成对电子。(2)、配离子[Cr(NH3)3(H2O)2Cl]2+中,提供孤电子对的原子有 , 中心离子的配位数为。(3)、中N原子的杂化轨道类型为 , 其立体构型名称为 , 与其互为等电子体的分子为 (写出一种即可)。(4)、无机含氧酸分子中含一个非羟基氧是中强酸,如H3PO4为中强酸,其结构简式为
 ;则同为中强酸的H3PO2的结构简式为。 (5)、某种由N与Ti形成的化合物,其晶胞结构如下图。阿伏加德罗常数的值为NA , 晶胞中Ti原子与N原子的最近距离为anm,晶胞的密度为g/cm3(写出表达式即可)。
;则同为中强酸的H3PO2的结构简式为。 (5)、某种由N与Ti形成的化合物,其晶胞结构如下图。阿伏加德罗常数的值为NA , 晶胞中Ti原子与N原子的最近距离为anm,晶胞的密度为g/cm3(写出表达式即可)。 22. 某实验小组利用下图装置制备Na2S2O3(夹持装置略去)。
22. 某实验小组利用下图装置制备Na2S2O3(夹持装置略去)。
已知:。
回答下列问题:
(1)、仪器a的名称为。(2)、开始时,将分液漏斗中的液体放入仪器a,放液的正确操作是。(3)、装置A中发生反应的化学方程式是。(4)、装置C中NaOH溶液的作用是。(5)、该装置存在缺陷,提出改进措施(答出一点即可)。23. 用CO2制备甲醇的反应原理为:。该反应进程可通过如下图所示的两步反应实现。
回答下列问题:
(1)、反应I的化学方程式是。(2)、由图可知,反应(填“I”或“II”)为慢反应。(3)、反应II: △H0(填“>”“<”或“=”)。(4)、在容积可变的密闭容器中投入0.5 mol CO和1 mol H2 , 发生反应: , 测得平衡时CH3OH的物质的量随温度、压强变化如下图所示。
①P总1P总2(填“>”“<”或“=”),判断理由是。
②若P总1=0.25 MPa,则500 K时该反应的平衡常数KP=。
③下列措施中,能够同时增大反应速率和提高CO转化率的是(填字母序号)。
A.使用高效催化剂 B.降低反应温度
C.增大体系压强 D.不断将CH3OH从反应体系中分离出来
(5)、最新科技报道,还可用CO2高效合成乙酸,其反应途径如下图所示,该反应总的化学方程式为。 24. 常温时,向体积均为V0、浓度均为1mol/L的HClO2和HBF4两种酸溶液中分别加水,稀释至体积为V,稀释过程中溶液pH随()的变化如下图所示。
24. 常温时,向体积均为V0、浓度均为1mol/L的HClO2和HBF4两种酸溶液中分别加水,稀释至体积为V,稀释过程中溶液pH随()的变化如下图所示。
回答下列问题:
(1)、HBF4为酸(填“强”或“弱”)。(2)、HClO2的电离方程式为。(3)、b→c过程中,HBF4溶液被稀释了倍。(4)、中和等体积、pH均为3的这两种酸溶液,消耗NaOH的物质的量较多的是(写出化学式)。(5)、依据a点,Ka(HClO2)=(结果保留两位有效数字)。25. 三氧化二钴(Co2O3)是重要的化工原料。以含钴废料(主要成分为Co2O3 , 含有少量MnO2、NiO、Fe3O4)为原料制备Co2O3的流程如下图:
已知:“滤液1”中含有的阳离子有H+、Co2+、Fe3+、Ni2+。
(1)、“滤渣1”的主要成分是(写化学式)。(2)、“酸浸”时,H2O2可将Co2O3还原为Co2+ , 离子方程式是。(3)、加有机萃取剂的目的是为了除去(填离子符号)。(4)、“调pH”时,常温下,为保证Fe3+完全沉淀,需调节“滤液1”的pH最小值为。 (已知:Ksp[Fe(OH)3]=1.0×10-38 , 当溶液中时,认为沉淀完全)(5)、由“滤液2”可得到的主要副产品是(写化学式)。(6)、“沉钴”过程中,生成Co2(OH)2CO3的离子方程式是。