四川省乐山市2021-2022学年高二上学期期末教学质量检测化学试题
试卷更新日期:2022-10-10 类型:期末考试
一、单选题
-
1. 下列各能层中不包含p能级的是( )A、K B、L C、M D、N2. 下列分子的VSEPR模型与其空间立体构型一致的是( )A、 B、 C、 D、3. 在分子中,键采用的成键轨道是( )A、 B、 C、 D、4. 在核电荷数为24的Cr的价层电子排布中,处于基态的是( )A、
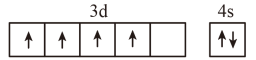 B、
B、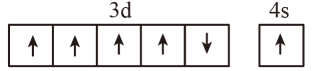 C、
C、 D、
D、 5. 下表所列物质晶体的类型全部正确的一组是( )
5. 下表所列物质晶体的类型全部正确的一组是( )原子晶体
离子晶体
分子晶体
A
二氧化硅
硫酸
He
B
碳酸氢铵
C
金刚石
烧碱
白磷
D
铜
KOH
碘晶体
A、A B、B C、C D、D6. 徐光宪在《分子共和国》一书中介绍了许多分子,如、、、CO等。下列有关说法错误的是( )A、为非极性分子 B、的结构式为: C、分子中键的键角为120°
D、CO与互为等电子体
7. 下列示意图或图示正确的是( )A、的分子模型示意图
C、分子中键的键角为120°
D、CO与互为等电子体
7. 下列示意图或图示正确的是( )A、的分子模型示意图 B、键电子云模型
B、键电子云模型 C、砷原子结构示意图
C、砷原子结构示意图 D、Na晶体堆积方式
D、Na晶体堆积方式 8. 下列曲线表示碱金属元素或其单质性质随核电荷数的变化趋势,错误的是( )A、
8. 下列曲线表示碱金属元素或其单质性质随核电荷数的变化趋势,错误的是( )A、 B、
B、 C、
C、 D、
D、 9. 对下列实验事实的理论解释错误的是( )
9. 对下列实验事实的理论解释错误的是( )选项
实验事实
理论解释
A
碘单质在苯中溶解度比在水中大
苯和都是非极性分子,而是极性分子
B
Be单质能溶于KOH溶液
Be和Al在周期表中是对角线关系,性质相似
C
稳定性:HF>HI
非金属性:F>I
D
的分解温度高于
的式量比大
A、A B、B C、C D、D10. W、X、Y、Z为四种短周期主族元素且只有一种是金属元素。它们在元素周期表中的相对位置如表所示。下列说法正确的是( )X
W
Y
Z
A、X、Y、Z中Y单质与氢气化合最容易 B、W的最高价氧化物对应水化物是一种弱碱 C、元素Y和Z在自然界中均存在游离态 D、氢化物的沸点X一定小于Y11. 下列诗句或谚语中包含吸热反应过程的是( )A、野火烧不尽,春风吹又生 B、春蚕到死丝方尽,蜡炬成灰泪始干 C、爆竹声中一岁除,春风送暖入屠苏 D、千锤万凿出深山,烈火焚烧若等闲12. 催化剂又称触媒,下列关于催化剂的说法正确的是( )A、催化剂能加快反应速率是因为能改变反应热 B、对可逆反应使用合适的催化剂能同等程度改变正、逆反应速率 C、催化剂反应前后的质量和性质不变 D、催化剂通过参与化学反应并改变化学反应路径来起催化作用,但反应的活化能不变13. 下列热化学方程式书写正确的是(的绝对值均正确)( )A、 (燃烧热) B、 C、 (中和热) D、 (反应热)14. 反应 , 经2min,A的浓度减少了。下列反应速率的表示正确的是( )A、2min末,用A表示的反应速率是 B、2min内,用B表示的反应速率是 C、2min内,用C表示的反应速率是 D、2min内,用B和C表示的反应速率之比为2∶315. 由反应物X分别转化为Y和Z的能量变化如图所示。下列说法正确的是( ) A、X→Y反应的 B、X→Z反应的 C、X→Y反应在任意条件下都能自发进行 D、相同条件下X→Y反应比X→Z反应更难发生16. 在36g碳不完全燃烧所得气体中,CO占体积,占体积,且 ; 。与这些碳完全燃烧相比,损失的热量是( )A、221kJ B、283kJ C、566kJ D、345kJ17. 下列说法正确的是( )A、中和热测定实验时,如果没有环形玻璃搅拌棒,可用环形铜质搅拌棒代替 B、向酸性溶液中加入草酸,溶液褪色速率先慢后快 C、重铬酸钾溶液中滴加氢氧化钠,溶液由黄色变橙色 D、将装有和混合液的试管放入冷水中,溶液不会变浑浊18. 已知下列反应: ;
A、X→Y反应的 B、X→Z反应的 C、X→Y反应在任意条件下都能自发进行 D、相同条件下X→Y反应比X→Z反应更难发生16. 在36g碳不完全燃烧所得气体中,CO占体积,占体积,且 ; 。与这些碳完全燃烧相比,损失的热量是( )A、221kJ B、283kJ C、566kJ D、345kJ17. 下列说法正确的是( )A、中和热测定实验时,如果没有环形玻璃搅拌棒,可用环形铜质搅拌棒代替 B、向酸性溶液中加入草酸,溶液褪色速率先慢后快 C、重铬酸钾溶液中滴加氢氧化钠,溶液由黄色变橙色 D、将装有和混合液的试管放入冷水中,溶液不会变浑浊18. 已知下列反应: ;;
则反应的平衡常数可以表示为( )
A、 B、 C、 D、19. 某温度下,在密闭容器中发生如下反应: , 若开始时充入2mol C气体,达到平衡时,混合气体的压强比起始时增大了10%;若开始时只充入2mol A和1mol B的混合气体,达到平衡时A的转化率为( )A、20% B、40% C、60% D、80%20. 已知反应2NO2⇌N2O4 升温时颜色加深。现将一定量的NO2充入注射器中后封口,图1和图2是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小),下列说法正确的是( ) A、d 点:v(正)>v(逆) B、b点的操作是拉伸注射器 C、c点与a点相比,c(NO2)增大,c(N2O4)也增大 D、若不忽略体系温度变化,且没有能量损失,则T(b)=T(c)
A、d 点:v(正)>v(逆) B、b点的操作是拉伸注射器 C、c点与a点相比,c(NO2)增大,c(N2O4)也增大 D、若不忽略体系温度变化,且没有能量损失,则T(b)=T(c)二、综合题
-
21. 回答下列问题:(1)、下列化合物含有手性碳的是____。A、 B、
 C、
D、
(2)、图一~图三是几种物质的微观结构图:
C、
D、
(2)、图一~图三是几种物质的微观结构图:
①图一是 , 其晶体类型为。
②图二是的微观结构,其中Si原子与键的数目之比为 , 最小的环上有个原子。
③图三为碘酸和高碘酸的结构图,请比较二者酸性强弱:。(选填“>”“<”或“=”)。
(3)、下列过程中,化学反应速率的增大对人类有益的是____。A、金属的腐蚀 B、塑料的老化 C、食物的腐败 D、氨的合成(4)、冰化成水的过程中,其焓变、熵变正确的是____。A、 B、 C、 D、22. 碳能形成多种单质及化合物如金刚石、T−碳、甲醛、甲醇……等。回答下列问题:(1)、甲醛()中C原子的杂化方式为 , 分子的立体构型为。(2)、1个甲醛分子中含有个σ键个π键。(3)、甲醛在催化作用下加氢可得甲醇。甲醛与甲醇相比,的沸点高,主要原因是。(4)、科研团队通过皮秒激光照射悬浮在甲醇溶液中的多臂碳纳米管合成T−碳,T−碳的晶体结构可以看成金刚石晶体中每个碳原子被一个由四个碳原子组成的正四面体结构单元取代(如图所示)。
①一个T−碳晶胞中含有个碳原子。
②T−碳的密度非常小,约为金刚石的一半。试计算T−碳晶胞的边长和金刚石晶胞的边长之比为。
23. 锰是钢的一种重要添加剂,支撑“中国天眼”FAST的角钢塔架中就含有锰。回答下列问题:(1)、Mn元素位于元素周期表的区,价层电子排布式为。(2)、金属锰有多种晶型,其中锰(面心立方)晶胞俯视图为____(选填编号)。A、 B、
B、 C、
C、 D、
D、 (3)、第三电离能(选填“>”或“<”),原因是。(4)、能形成配离子为八面体的配合物。已知含1mol该配合物与足量溶液反应可生成 , 则配合物中 , 。(5)、硫化锰是一种重要的半导体材料,其中具有稳定的岩盐矿结构,晶胞结构如图所示。若晶胞参数为 , 为阿伏加德罗常数的值,晶胞的密度是。(列出计算式)
(3)、第三电离能(选填“>”或“<”),原因是。(4)、能形成配离子为八面体的配合物。已知含1mol该配合物与足量溶液反应可生成 , 则配合物中 , 。(5)、硫化锰是一种重要的半导体材料,其中具有稳定的岩盐矿结构,晶胞结构如图所示。若晶胞参数为 , 为阿伏加德罗常数的值,晶胞的密度是。(列出计算式) 24. 氢能是一种清洁能源,下列反应是目前大规模制取氢气的方法之一: , 在容积为2L的刚性容器中充入和模拟上述反应,不同温度下反应的平衡常数K随温度变化如图所示,回答下列问题:
24. 氢能是一种清洁能源,下列反应是目前大规模制取氢气的方法之一: , 在容积为2L的刚性容器中充入和模拟上述反应,不同温度下反应的平衡常数K随温度变化如图所示,回答下列问题: (1)、该反应的0(选填“>”或“<”),判断理由是。(2)、该反应的浓度平衡常数的表达式为。(3)、判断该反应一定达到化学平衡状态的依据是____(填字母)。A、 B、容器内气体的压强不随时间而变化 C、CO的物质的量不随时间而变化 D、平衡常数K不变(4)、下列有利于提高平衡时CO转化率的措施有____(填字母)。A、使用催化剂 B、增大压强 C、适当降低温度 D、提高CO与的投料比(5)、时,反应经2min后达平衡,则2min内用表示的反应速率。达平衡后,若再向体系中充入、、和 , 反应向(选填“正反应方向”或“逆反应方向”)进行。25. 为实现“碳中和”目标,必须做好汽车尾气治理。在汽车尾气系统中装一个催化转化器,可有效降低、和CO的排放。
(1)、该反应的0(选填“>”或“<”),判断理由是。(2)、该反应的浓度平衡常数的表达式为。(3)、判断该反应一定达到化学平衡状态的依据是____(填字母)。A、 B、容器内气体的压强不随时间而变化 C、CO的物质的量不随时间而变化 D、平衡常数K不变(4)、下列有利于提高平衡时CO转化率的措施有____(填字母)。A、使用催化剂 B、增大压强 C、适当降低温度 D、提高CO与的投料比(5)、时,反应经2min后达平衡,则2min内用表示的反应速率。达平衡后,若再向体系中充入、、和 , 反应向(选填“正反应方向”或“逆反应方向”)进行。25. 为实现“碳中和”目标,必须做好汽车尾气治理。在汽车尾气系统中装一个催化转化器,可有效降低、和CO的排放。已知:①CO的燃烧热为
②
回答下列问题:
(1)、的电子式为 , 与CO相比熔沸点较高的是。(2)、反应的。(3)、恒温条件下,和发生反应 , 测得平衡时NO与的物质的量浓度与平衡总压的关系如图所示:
①A、C两点的浓度平衡常数关系:(选填“>”“<”或“=”)。
②A、B、C三点中,NO的转化率最大的是点。
③B点时,该反应的压强平衡常数(是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)