四川省成都市2021-2022学年高二上学期期末考试化学试题
试卷更新日期:2022-10-10 类型:期末考试
一、单选题
-
1. 能源是国民经济和社会发展的重要物质基础,下列属于二次能源的是( )A、煤炭 B、地热 C、电力 D、风能2. 下列过程在一定条件下能自发进行但不能用熵增解释的是( )A、花香四溢 B、冰块融化 C、Na2CO3·10H2O风化 D、水蒸气冷凝3. 向稀氨水中分别加入以下物质,水的电离平衡会正向移动的是( )A、NH4Cl B、浓氨水 C、NaOH D、Na2SO44. 下列溶液显酸性,解释其原因的化学用语错误的是( )A、碳酸溶液:H2CO3⇌2H++ B、硫酸溶液:H2SO4=2H++ C、硫酸氢钠溶液:NaHSO4=Na++H++ D、NH4Cl溶液:+H2O⇌NH3∙H2O+H+5. 已知:反应HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l) △H=-57.3 kJ/mol。现分别取50 mL0.50 mol/L醋酸与50 mL0.55 mol/LNaOH溶液进行中和反应,用如图实验装置测定该反应的中和热△H,下列叙述正确的是( )
 A、图中装置缺少铜丝搅拌棒 B、为了让反应充分进行,NaOH分三次倒入 C、该实验测定的反应热△H>-57.3 kJ/mol D、用50 mL0.50 mol/LNaOH溶液更准确6. 以下应用与盐类水解无关的是( )A、用热碱去除废铁屑表面油污 B、配制Na2S溶液时需将Na2S溶于NaOH浓溶液 C、用硫酸铝溶液和碳酸氢钠溶液混合灭火 D、用FeCl3溶液刻蚀铜制电路板7. H-H键键能为436 kJ/mol,下列关于反应的能量变化叙述正确的是( )A、1 mol H-H断裂放出热量436 kJ B、a值由键能决定,与状态无关 C、光照和点燃条件下a的数值不同 D、使用催化剂不能改变△H8. 常温下,浓度均为的醋酸和盐酸溶液在水中的电离示意图如下图所示,下列描述错误的是( )
A、图中装置缺少铜丝搅拌棒 B、为了让反应充分进行,NaOH分三次倒入 C、该实验测定的反应热△H>-57.3 kJ/mol D、用50 mL0.50 mol/LNaOH溶液更准确6. 以下应用与盐类水解无关的是( )A、用热碱去除废铁屑表面油污 B、配制Na2S溶液时需将Na2S溶于NaOH浓溶液 C、用硫酸铝溶液和碳酸氢钠溶液混合灭火 D、用FeCl3溶液刻蚀铜制电路板7. H-H键键能为436 kJ/mol,下列关于反应的能量变化叙述正确的是( )A、1 mol H-H断裂放出热量436 kJ B、a值由键能决定,与状态无关 C、光照和点燃条件下a的数值不同 D、使用催化剂不能改变△H8. 常温下,浓度均为的醋酸和盐酸溶液在水中的电离示意图如下图所示,下列描述错误的是( )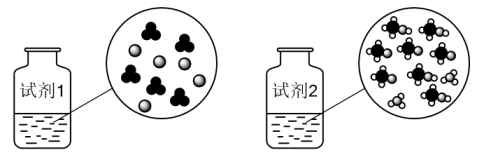 A、
A、 代表
B、冰醋酸是强电解质
C、:试剂试剂2
D、中和等体积两份溶液,耗碱量相同
9. 已知热化学反应方程式:
代表
B、冰醋酸是强电解质
C、:试剂试剂2
D、中和等体积两份溶液,耗碱量相同
9. 已知热化学反应方程式:①
②
下列说法错误的是( )
A、反应①: B、CO的燃烧热是283.0 kJ/mol C、C生成CO需要吸热 D、盖斯定律可间接获得不方便测量的反应热10. 冰醋酸中乙酸分子间通过氢键结合为二聚体(如下图)。常温下,向冰醋酸中逐滴加入蒸馏水的过程中存在平衡:。下列关于该过程的描述错误的是( ) A、乙酸二聚体逐渐减少 B、可能先增加后减少 C、电导率与溶液中离子浓度有关 D、水的电离程度逐渐增大11. 实验探究浓度、温度、催化剂对化学反应速率的影响。下列实验设计不恰当的是( )
A、乙酸二聚体逐渐减少 B、可能先增加后减少 C、电导率与溶液中离子浓度有关 D、水的电离程度逐渐增大11. 实验探究浓度、温度、催化剂对化学反应速率的影响。下列实验设计不恰当的是( )目的
实验设计
A
探究浓度对反应速率的影响
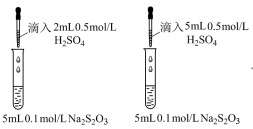
B
探究温度对反应速率的影响
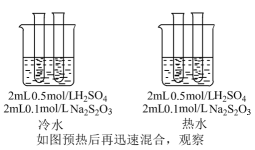
C
探究温度对反应速率的影响
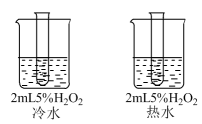
D
探究催化剂对反应速率的影响
 A、A B、B C、C D、D12. 已知 , 用如图针筒装入一定量的和并进行如下实验。下列说法正确的是( )
A、A B、B C、C D、D12. 已知 , 用如图针筒装入一定量的和并进行如下实验。下列说法正确的是( ) A、初态到末态颜色变浅,平衡正向移动 B、平均摩尔质量:末态大于初态 C、:初态比末态2倍稍大 D、初态到末态减小13. 一定温度下,向密闭容器中充入8 molX(g)和2 molY(g),其物质的量随时间的变化如图所示。下列说法正确的是( )
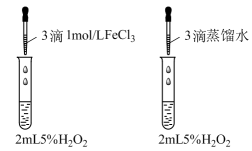
A、初态到末态颜色变浅,平衡正向移动 B、平均摩尔质量:末态大于初态 C、:初态比末态2倍稍大 D、初态到末态减小13. 一定温度下,向密闭容器中充入8 molX(g)和2 molY(g),其物质的量随时间的变化如图所示。下列说法正确的是( ) A、发生的反应为 B、25 min改变条件重新达平衡后Y的体积分数变大 C、25 min时改变的条件可能是加压 D、25 min改变条件后,Kc变小14. 滴定分析法是一种精度很高的定量分析法。以酚酞为指示剂,用标准溶液滴定某未知浓度的盐酸溶液,下列说法错误的是( )A、用酸式滴定管盛装待测液 B、装液之前需润洗碱式滴定管 C、指示剂多加不影响测定结果 D、滴定终点时,溶液颜色由无色变为粉红色15. 某小组进行如下实验证明Ksp[Mg(OH)2]>Ksp[Cu(OH)2]。下列相关叙述错误的是( )
A、发生的反应为 B、25 min改变条件重新达平衡后Y的体积分数变大 C、25 min时改变的条件可能是加压 D、25 min改变条件后,Kc变小14. 滴定分析法是一种精度很高的定量分析法。以酚酞为指示剂,用标准溶液滴定某未知浓度的盐酸溶液,下列说法错误的是( )A、用酸式滴定管盛装待测液 B、装液之前需润洗碱式滴定管 C、指示剂多加不影响测定结果 D、滴定终点时,溶液颜色由无色变为粉红色15. 某小组进行如下实验证明Ksp[Mg(OH)2]>Ksp[Cu(OH)2]。下列相关叙述错误的是( )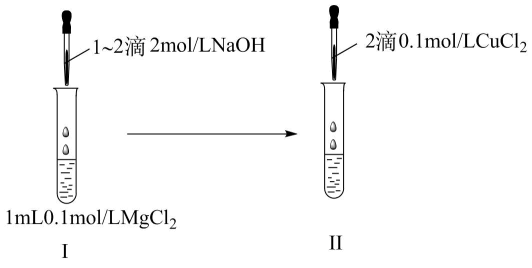 A、试管Ⅰ中出现白色沉淀,试管Ⅱ沉淀转为蓝色 B、试管Ⅱ反应:Mg(OH)2(s)+Cu2+(aq)Cu(OH)2(s)+Mg2+(aq) C、试管Ⅰ反应后上层清液中有c(Mg2+)·c2(OH-)=Ksp[Mg(OH)2] D、向试管Ⅰ中滴加过量NaOH溶液不影响结论16. 研究化学反应历程有利于调控化学反应速率。已知反应的反应进程和能量变化图如下:
A、试管Ⅰ中出现白色沉淀,试管Ⅱ沉淀转为蓝色 B、试管Ⅱ反应:Mg(OH)2(s)+Cu2+(aq)Cu(OH)2(s)+Mg2+(aq) C、试管Ⅰ反应后上层清液中有c(Mg2+)·c2(OH-)=Ksp[Mg(OH)2] D、向试管Ⅰ中滴加过量NaOH溶液不影响结论16. 研究化学反应历程有利于调控化学反应速率。已知反应的反应进程和能量变化图如下:
ⅰ: 活化能
ⅱ: 活化能
活化能 , 下列叙述错误的是( )
A、反应ⅰ的 B、较小,则反应ⅰ平衡转化率小 C、反应ⅱ是决速步骤 D、分离NO2的瞬间对反应ⅱ的正反应速率没有影响17. Fe3+与SCN-的配位平衡是研究化学热力学原理的重要载体。向5 mL0.005 mol/LFeCl3溶液中加入5 mL0.01 mol/LKSCN溶液,溶液变红,t秒时测得溶液中c(Fe3+)=0.001 mol/L,待稳定后将溶液均分于两支试管中,完成下列实验。试管
操作
现象
Ⅰ
滴入1 mol/LKSCN溶液4滴
溶液红色加深
Ⅱ
加入饱和FeCl3溶液4滴
溶液红色加深
下列说法正确的是( )
A、离子方程式: B、t时间内,反应平均速率 C、试管Ⅰ溶液颜色加深说明该反应是可逆反应 D、将试管Ⅱ饱和FeCl3溶液换为KCl固体,现象相同18. 为不溶性固体,可用作白色颜料和阻燃剂,在实验室可利用的水解反应制取。为了得到较多的 , 操作时要将缓慢加入大量水中,反应后期还要加入少量氨水,下列叙述错误的是( )A、水解总反应可表示为: B、适当加热可使胶态聚沉,便于分离 C、大量的水和氨水都能促进水解 D、反应后可直接通过结晶得到固体19. 已知时,向溶液中逐滴加入的盐酸,滴入过程中,溶液中、分布系数【如的分布系数:】与的变化关系如图所示。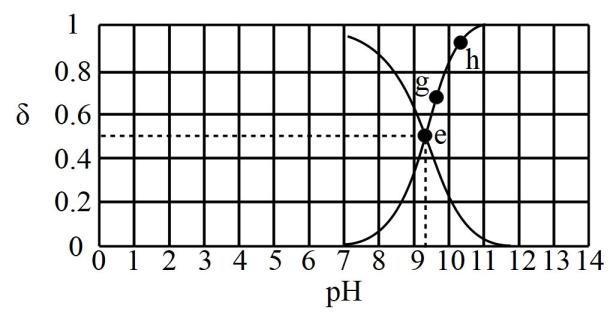
下列叙述错误的是( )
A、水的电离程度: B、的数量级是 C、时, D、时,20. 硫化沉淀法处理酸性电镀废水中工艺如下,已知 , , 可溶于过量的溶液中。相关叙述错误的是( ) A、加入调同时避免生成 B、该过程需要控制不能碱性过强 C、加入混凝剂可提高的沉降速度 D、若电镀废水中含有 , 可直接加入将其全部转化为除去
A、加入调同时避免生成 B、该过程需要控制不能碱性过强 C、加入混凝剂可提高的沉降速度 D、若电镀废水中含有 , 可直接加入将其全部转化为除去二、填空题
-
21. 在实验室探究温度对盐溶液和水的pH的影响,测得0.1 mol/LCuSO4溶液、0.1 mol/L Na2SO3溶液以及H2O的pH随温度变化的曲线如图所示。
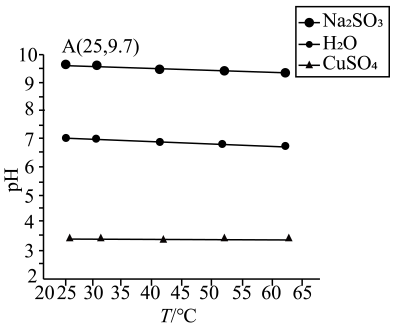
回答下列问题:
(1)、温度升高H2O的pH减小,c(H+)c(OH-)(填“>”、“<”或“=”)。(2)、加热 CuSO4溶液pH变小,试结合化学用语解释原因。(3)、常温时向Na2SO3溶液滴加2滴酚酞,现象是;恢复至室温与加热前相比Kw(填“增大”、“减小”或“不变”);计算25℃时,H2SO3的Ka2的值为(忽略水的电离及的二级水解)。(4)、向加热前后的Na2SO3溶液中滴加盐酸酸化的BaCl2溶液,发现加热后的溶液中产生的白色沉淀更多。试以此分析Na2SO3溶液pH随温度升高而降低的原因:①;②温度升高Kw增大。22. 天然水加热时产生水垢.天然水中含与 , 热分解产物有、。回答下列问题:(1)、加热的化学方程式为;持续加热,沉淀可转换为 , 说明更难溶。(2)、浓缩海水得粗盐水中主要含有、、等离子.粗盐水精制食盐过程中,按除杂顺序写出除杂试剂的化学式为、、 , 过滤取滤液,加过量盐酸酸化后,蒸发结晶纯化。(3)、工业上通常用除去天然水中 , 已知某天然水中开始沉淀的为9.6,则溶液中的初始浓度是。(4)、工业上制备轻质氧化镁流程如下.轻质氧化镁相比重质氧化镁质量更轻,更加疏松多孔。
①水解过程加热的作用是;
②不用重质而用轻质酸溶制备的原因是。
三、综合题
-
23. 高炉炼铁过程存在的主要反应为:
①
②
法国科学家勒夏特列经过深入的研究,发现反应②是一个可逆反应,自上而下发生在高炉中有焦炭的地方。回答下列问题:
(1)、高炉炼铁采用的冶炼方法是(填“湿法炼铁”或“热还原法”)。(2)、反应②达到平衡的标志是____(填序号)。A、 B、恒容体系中,压强不发生改变 C、测定 D、碳的质量不再改变(3)、在一定温度下,向某体积可变的恒压(压强为)密闭容器中充入与足量碳发生上述反应②,平衡体系中气体体积分数与温度关系如下图所示。
①反应0(填“>”、“<”或“=”);该反应在(填“高温”或“低温”)下自发进行。
②时的分压为;
③时,该反应的平衡常数(以分压表示,分压=总压×物质的量分数)。
24. 烯烃是化工生产的重要原料,低碳烷烃脱氢制低碳烯烃对提高化石能源利用率有着重要作用.乙烷脱氢的反应为:反应Ⅰ(1)、有关物质的燃烧热如下表。则。物质
燃烧热/()
(2)、在一定温度下,有利于提高平衡转化率的措施是(写一条).(3)、研究发现,向反应的恒容体系中充入一定量的发生反应:。相同条件下,充入和未充入时的平衡转化率()随温度变化曲线如下图。
①向恒容体系下充入的 , 达到A点,反应Ⅰ的平均反应速率;
②图中C点与B点相同充料,则此时C点v正v逆(填“>”、“<”或“=”);B点的v正C点的v逆(填“>”、“<”或“=”)。
③向反应中加入制备乙烯具有明显优势,其原因是。
25. 天然石灰石是生产水泥的重要原材料之一。对石灰石中CaCO3含量的测定常用KMnO4化还原滴定。简化流程如下:
回答下列问题:
(1)、“溶解”时为增大浸出效率,可采取的措施是(一条即可)。(2)、加入稀盐酸溶解后,煮沸的目的是。(3)、“过滤”后还需用稀(NH4)2C2O4溶液洗涤沉淀三次,再用蒸馏水快速洗涤。结合 , 解释用稀(NH4)2C2O4溶液洗涤的原因。(4)、“滴定”:用一定浓度的稀硫酸将沉淀多次溶解(CaSO4微溶于水,保证CaC2O4完全转化成H2C2O4),获得的H2C2O4溶液用c mol/L KMnO4标准溶液滴定。平行滴定三次,消耗KMnO4溶液的平均体积为V mL。①滴定时需要用到的玻璃仪器有酸式滴定管、胶头滴管、烧杯、;
②滴定终点的现象为;
③上述沉淀未洗净就滴定,结果可能(用“偏大”、“偏小”、“不变”填空);
④样品中的钙含量为%(列表达式即可。已知:样品质量m g,通常以CaO的质量分数表示钙含量)。