浙教版科学九年级上学期 第二单元 物质鉴别、推断 提升练习(2)
试卷更新日期:2022-10-05 类型:同步测试
一、单选题
-
1. 为了检验汽油中是否含有少量的水,可往汽油中加入少量的( )A、胆矾 B、无水CuSO4 C、CaO D、CaCO32. “五水共治”大大美化了河道环境某学校实验室排出的废水中含有Ag+、Ba2+”和NO3-三种离子。该校实验小组设计实验从该废水中回收银,并得到副产品碳酸钡固体,操作步骤和实验结果如下

已知滤液B中只含有一种溶质,则下列说法不正确的是( )
A、蓝色沉淀是Cu(OH)2 B、乙一定是氢氧化钡 C、若丙是K2CO3 , 滤液C结晶后可以作为化学肥料 D、若得到19.7g碳酸钡,则证明原废水中含有13.7g钡3. 下列物质间的转化,通过一步化学反应不能实现的是( )A、Cu(OH)2→CuCl2 B、H2SO4→HCl C、NaNO3→Na2CO3 D、CaCl2→CaCO34. 只用水这种试剂不能将下列各组固体物质鉴别出来的是( )A、KNO3和NH4NO3 B、CaCO3和Ca(NO3)2 C、NaOH和NaCl D、K2SO4和NaNO35. 通过观察和实验等方法,人们找到物质变化的证据。化学实验常常伴随着产生气泡、产生沉淀、溶液颜色变化等现象。以下几组实验能通过实验现象鉴别试管中的四种物质的是( )A、 B、
B、 C、
C、 D、
D、 6. 某同学在学习了物质的化的现律后,绘制了可以通过一步反应制取ZnSO4的思维导图,其中所选的物质错误的是( )
6. 某同学在学习了物质的化的现律后,绘制了可以通过一步反应制取ZnSO4的思维导图,其中所选的物质错误的是( ) A、①-Zn B、②-ZnCl2 C、③-H2SO4 D、④-Zn(OH)27. 下列实验操作能达到实验目的是( )
A、①-Zn B、②-ZnCl2 C、③-H2SO4 D、④-Zn(OH)27. 下列实验操作能达到实验目的是( )选项
实验目的
实验操作
A
检验溶液中含铵根离子
取样,加入氢氧化钠,微热,闻气味
B
除去CO2气体中少量HCl气体
通过NaOH溶液
C
检验废水中是否含有
滴加BaCl2溶液
D
鉴别溶液:NaCl、Na2CO3、HCl、KNO3
将组内物质相互混合,观察现象
A、A B、B C、C D、D8. 一定条件下,下列物质的转化均可一步实现的是( )A、Fe→Fe2O3→FeSO4 B、Fe→FeSO4→CuSO4 C、NaNO3→NaOH→Na2CO3 D、Ca(OH)2→CaCO3→CaCl29. 在某溶液中先滴加HCl无现象,再滴加BaCl2溶液有白色沉淀产生,该溶液中( )A、可能含有 B、一定含有 C、可能含有Ag+或 D、一定含有Ag+和10. 现有甲、乙、丙、丁四瓶失去标签的无色溶液,只知道它们是稀盐酸、CaCl2溶液、Na2CO3溶液、AgNO3溶液,按下表中实验顺序两两混合进行实验,现象如表所述.第5次实验是把乙和丁混合,将出现的现象是(提示:反应中生成的Ag2CO3难溶于水)( )实验顺序
1
2
3
4
5
溶液编号
甲+乙
甲+丙
丙+丁
乙+丙
乙+丁
实验现象
有气体产生
有沉淀生成
有沉淀生成
无明显现象
A、有气体产生 B、有沉淀生成 C、无明显现象 D、不能确定11. 一包不纯的Na2CO3固体,杂质可能是CaCl2、NaCl、NaHCO3中的一种或几种。现取该样品溶于水得到澄清溶液;另取样品10.6g,加入100g稀盐酸恰好完全反应,产生气体4g,则下列判断不正确的是( )A、加水得澄清溶液,样品中一定没有CaCl2 B、样品中一定含有NaCl,可能含有NaHCO3 C、样品中杂质可能只含有NaCl D、所加的稀盐酸溶质质量分数大于7.3%12. 下列各组稀溶液中,利用组内物质相互反应就能加以鉴别的是 ( )A、Na2CO3、H2SO4、HCl、KNO3 B、Na2SO4、Na2CO3、BaCl2、HNO3 C、CuSO4、KOH、NaCl、NaOH D、NaNO3、MgCl2、KCl、Ba(OH)213. 某溶液中的溶质有NaOH、HCl、H2SO4和MgCl2中的一种或几种,向该溶液中滴加Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液质量的关系如图所示,下列说法正确的是( ) A、HCl和H2SO4一定存在 B、NaOH、H2SO4和MgCl2一定不存在 C、HCl和MgCl2一定存在 D、HCl一定存在NaOH、H2SO4一定不存在,MgCl2可能存在14. 由 C、H、O、Fe 四种元素组成的常见的物质间有如下图所示的关系,其中甲、乙、丙是单质,X、Y 是化合物。图中“—”表示相连的物质两两之间可以发生反应,“→”表示由某一物质可制得另一物质。以下判断错误的是( )
A、HCl和H2SO4一定存在 B、NaOH、H2SO4和MgCl2一定不存在 C、HCl和MgCl2一定存在 D、HCl一定存在NaOH、H2SO4一定不存在,MgCl2可能存在14. 由 C、H、O、Fe 四种元素组成的常见的物质间有如下图所示的关系,其中甲、乙、丙是单质,X、Y 是化合物。图中“—”表示相连的物质两两之间可以发生反应,“→”表示由某一物质可制得另一物质。以下判断错误的是( ) A、甲、乙是非金属单质 B、物质 X 一定是H2O C、物质Y一定是氧化物 D、甲与丙反应能生成 X15. 某 NaCl样品中可能混有CuCl2、MgCl2、BaCl2中的一种或几种物质。取该样品11.7g溶于适量水中,得到无色溶液,然后向其中加入足量的硝酸银溶液,得到30.7g白色沉淀,则该样品组成的下列推断中,正确的是( )A、一定有MgCl2 , 可能有CuCl2 B、一定有MgCl2 , 没有BaCl2 C、一定有MgCl2 , 可能有BaCl2 D、一定有 MgCl2、BaCl2
A、甲、乙是非金属单质 B、物质 X 一定是H2O C、物质Y一定是氧化物 D、甲与丙反应能生成 X15. 某 NaCl样品中可能混有CuCl2、MgCl2、BaCl2中的一种或几种物质。取该样品11.7g溶于适量水中,得到无色溶液,然后向其中加入足量的硝酸银溶液,得到30.7g白色沉淀,则该样品组成的下列推断中,正确的是( )A、一定有MgCl2 , 可能有CuCl2 B、一定有MgCl2 , 没有BaCl2 C、一定有MgCl2 , 可能有BaCl2 D、一定有 MgCl2、BaCl2二、填空题
-
16. 某无色溶液中可能含有Na+ , H+ , Cl-和 ,现在想要检测两种阴离子是否存在,请你帮助完成实验:(1)、取适量溶液,先向其中滴加足量的溶液,若有白色沉淀生成,则证明有 存在;(2)、再取上层清液加溶液,又出现白色沉淀,则可证明有Cl-存在。17. 已知甲、乙、丙分属于不同类别的物质。其中甲在农业上常用来降低土壤的酸性,乙难溶于水,丙是氧化物。它们之间有如图的转化关系(图中→表示一步反应,部分反应物、生成物及反应条件已略),则:
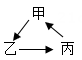 (1)、写出乙物质的化学式。(2)、丙→甲的反应是反应(选填“吸热”或“放热”)18. 实验室的某一废液中含有CuCl2、FeCl和AlCl3三种溶质。小科设计了如下流程来回收AlCl3和有关金属。根据以下实验过程和现象回答问题:
(1)、写出乙物质的化学式。(2)、丙→甲的反应是反应(选填“吸热”或“放热”)18. 实验室的某一废液中含有CuCl2、FeCl和AlCl3三种溶质。小科设计了如下流程来回收AlCl3和有关金属。根据以下实验过程和现象回答问题:
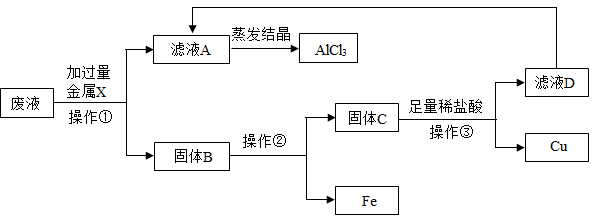 (1)、金属X为(填化学式),操作①需要的玻璃仪器有(写出两种)。(2)、固体B中含金属(填化学式),操作②为 。19. 现有一包不纯的K2CO3固体,可能含有Fe(NO3)3、CaCO3、KCl、BaCl2、Na2SO4、Na2CO3中的一种或几种。某科学小组做了如下实验:(1)、取固体试样溶于足量水,得无色溶液A,则原固体一定不含。(2)、向溶液A中加入足量Ba(NO3)2溶液,过滤得白色固体B和无色滤液C.加入Ba(NO3)2溶液时一定发生反应的化学方程式是。(3)、向固体B中加入足量稀HNO3 , 固体完全溶解,取少量滤液C,先滴加过量稀HNO3 , 再滴加AgNO3溶液,出现白色沉淀,通过以上实验可知,原固体中仍无法确定的物质是。20. 有一包固体粉末可能含有NaOH、NaCl、CuCl2、Mg(OH)2、CaCO3中的一种或多种,为探究其成分,某同学取样进行了如下图所示实验:
(1)、金属X为(填化学式),操作①需要的玻璃仪器有(写出两种)。(2)、固体B中含金属(填化学式),操作②为 。19. 现有一包不纯的K2CO3固体,可能含有Fe(NO3)3、CaCO3、KCl、BaCl2、Na2SO4、Na2CO3中的一种或几种。某科学小组做了如下实验:(1)、取固体试样溶于足量水,得无色溶液A,则原固体一定不含。(2)、向溶液A中加入足量Ba(NO3)2溶液,过滤得白色固体B和无色滤液C.加入Ba(NO3)2溶液时一定发生反应的化学方程式是。(3)、向固体B中加入足量稀HNO3 , 固体完全溶解,取少量滤液C,先滴加过量稀HNO3 , 再滴加AgNO3溶液,出现白色沉淀,通过以上实验可知,原固体中仍无法确定的物质是。20. 有一包固体粉末可能含有NaOH、NaCl、CuCl2、Mg(OH)2、CaCO3中的一种或多种,为探究其成分,某同学取样进行了如下图所示实验: (1)、反应生成无色气体的化学方程式为(2)、原固体粉末中不能确定是否含有的物质是。21. 有一包白色固体可能含Na₂CO3、Na₂SO4、KCl、Ba(NO3)2、NaOH中的一种或几种。某科学兴趣小组为探究其成分做了以下实验:
(1)、反应生成无色气体的化学方程式为(2)、原固体粉末中不能确定是否含有的物质是。21. 有一包白色固体可能含Na₂CO3、Na₂SO4、KCl、Ba(NO3)2、NaOH中的一种或几种。某科学兴趣小组为探究其成分做了以下实验:I.取少量固体于烧杯中,逐渐加水并不断搅拌,烧杯内固体的质量随加入水的质量的变化如图甲所示:
Ⅱ.取少量B点时的清液于试管中,滴加酚酞溶液,酚酞溶液不变色;
III.继续向烧杯中滴加稀硝酸并不断搅拌,烧杯内固体的质量随加入稀硝酸的质量的变化如图乙所示。
试回答下列问题:
 (1)、BC段可观察到的现象。(2)、原白色固体中一定含有。(3)、D点时溶液中一定含有的溶质是(填化学式)。
(1)、BC段可观察到的现象。(2)、原白色固体中一定含有。(3)、D点时溶液中一定含有的溶质是(填化学式)。三、实验探究题
-
22. 有一包白色固体粉末,可能含有硫酸铜、氯化钡、硫酸钠、碳酸钠、氯化钠中的一种或几种,某同学对其组成进行了探究,过程如下:
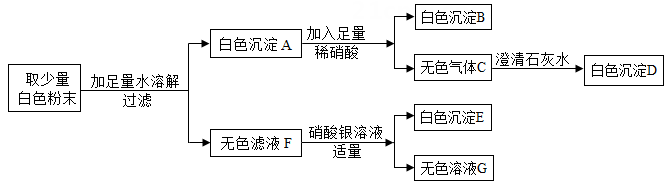 (1)、沉淀B的化学式是(2)、原混合物中可能含有的物质是(3)、写出由C生成D的反应化学方程式23. 某同学在实验室中以碳酸钡原料(含少量SiO2 , SiO2不参与反应)制备高纯碳酸钡的流程如图:
(1)、沉淀B的化学式是(2)、原混合物中可能含有的物质是(3)、写出由C生成D的反应化学方程式23. 某同学在实验室中以碳酸钡原料(含少量SiO2 , SiO2不参与反应)制备高纯碳酸钡的流程如图:
 (1)、试剂x应选用(填字母)。
(1)、试剂x应选用(填字母)。a.稀硫酸
b.盐酸
(2)、操作1、操作2用到的玻璃仪器有 、烧杯、玻璃棒等。(3)、滤液Y中的溶质除有:KOH、K2CO3以外肯定含有的是(填化学式)24. 某固体混合物中可能含有氢氧化钠、硝酸钠、氯化钠、硫酸钠、碳酸钠。为了研究该混合物的成分,某同学按下列流程进行了实验(各步均恰好完全反应):根据流程图回答问题:
 (1)、反应④的化学方程式为。(2)、根据实验现象推断该混合物中一定含有的物质是( 填化学式)。(3)、该同学为了进一步确定固体混合物的组成,取样品20.9g (其中含钠元素质量为6.9g),按上述流程图进行实验,产生11.65g白色沉淀A,产生2.2g气体W。通过计算,确定该混合物中还含有的物质是(填化学式),其质量为g。25. 一包白色粉末,由CuSO4、CaCO3、BaCl2、Na2SO4和NaOH中的两种或两种以上的物质混合而成。为探究其组成,进行如下实验:(1)、取少量白色粉末,加入足量的水,充分搅拌后过滤,得到白色沉淀和无色滤液。则原白色粉末中一定不含有。(2)、取(1)滤出的白色沉淀,加入足量的盐酸,沉淀全部溶解,并产生无色气体。根据上述实验,如果原白色粉末中含有Na2SO4 , 则白色粉末的组成是 或者 .(3)、为进一步确定原白色粉末中是否同时含有BaCl2和NaOH,在(1)的滤液中加入一种能一次性鉴别出来的试剂,这种试剂可能是。
(1)、反应④的化学方程式为。(2)、根据实验现象推断该混合物中一定含有的物质是( 填化学式)。(3)、该同学为了进一步确定固体混合物的组成,取样品20.9g (其中含钠元素质量为6.9g),按上述流程图进行实验,产生11.65g白色沉淀A,产生2.2g气体W。通过计算,确定该混合物中还含有的物质是(填化学式),其质量为g。25. 一包白色粉末,由CuSO4、CaCO3、BaCl2、Na2SO4和NaOH中的两种或两种以上的物质混合而成。为探究其组成,进行如下实验:(1)、取少量白色粉末,加入足量的水,充分搅拌后过滤,得到白色沉淀和无色滤液。则原白色粉末中一定不含有。(2)、取(1)滤出的白色沉淀,加入足量的盐酸,沉淀全部溶解,并产生无色气体。根据上述实验,如果原白色粉末中含有Na2SO4 , 则白色粉末的组成是 或者 .(3)、为进一步确定原白色粉末中是否同时含有BaCl2和NaOH,在(1)的滤液中加入一种能一次性鉴别出来的试剂,这种试剂可能是。A.CO2 B.H2SO4 C.CuSO4 D.FeCl3
26. 有一包固体物质,可能含有硫酸钠、碳酸钠、氯化钙、氯化钾、氯化铁和氢氧化钠中的一种或几种。为探究其组成,进行如下图实验: (1)、取少量固体按图甲实验,根据步骤①可知固体中一定不含有。(2)、取白色沉淀B于烧杯中并逐滴加入稀硝酸,烧杯中的沉淀质量随滴加稀硝酸质量的变化如图乙所示。则可确定原固体中一定含有、。(3)、取无色溶液C向其中通入二氧化碳气体,产生白色沉淀,无色溶液C中一定含有的离子是_____。A、NO3-、OH-、Na+ B、Ba2+、 NO3- C、NO3-、OH-、Ba2+ D、Ba2+、NO3-、OH-、Na+27. 某CuO粉末中混有少量Cu2O,现有一课外活动小组利用下图所示装置测定其中Cu2O的含量,请根据图示内容回答下列问题:
(1)、取少量固体按图甲实验,根据步骤①可知固体中一定不含有。(2)、取白色沉淀B于烧杯中并逐滴加入稀硝酸,烧杯中的沉淀质量随滴加稀硝酸质量的变化如图乙所示。则可确定原固体中一定含有、。(3)、取无色溶液C向其中通入二氧化碳气体,产生白色沉淀,无色溶液C中一定含有的离子是_____。A、NO3-、OH-、Na+ B、Ba2+、 NO3- C、NO3-、OH-、Ba2+ D、Ba2+、NO3-、OH-、Na+27. 某CuO粉末中混有少量Cu2O,现有一课外活动小组利用下图所示装置测定其中Cu2O的含量,请根据图示内容回答下列问题:
 (1)、X是常见还原性气体CO、H2中的一种,请根据组合装置判断x的化学式为;(2)、已知反应前CuO和Cu2O的总质量为m1g完全反应后U型管内物质的质量增加了m2g(损失忽略不计),则原混合物中Cu2O的质量为克。(3)、E装置的作用是。
(1)、X是常见还原性气体CO、H2中的一种,请根据组合装置判断x的化学式为;(2)、已知反应前CuO和Cu2O的总质量为m1g完全反应后U型管内物质的质量增加了m2g(损失忽略不计),则原混合物中Cu2O的质量为克。(3)、E装置的作用是。