江苏省扬州市广陵区2021-2022学年九年级上学期期中化学试题
试卷更新日期:2022-09-28 类型:期中考试
一、单选题
-
1. 2021 年诺贝尔化学奖授予两位化学家,表彰他们在“不对称有机催化”上做出的贡献,该研究可用于新药研发、电池储能等领域。说明化学已渗透到我们的生活,下列对化学学科的认识错误的是( )A、化学为人类研制了新材料 B、化学的发展导致了生态环境的恶化 C、化学为人类提供了新能源 D、化学已成为生命科学的重要基础2. 下列变化属于化学变化的是( )A、干冰汽化 B、水结成冰 C、矿石粉碎 D、食物腐烂3. 下列物质的性质中属于化学性质的是( )A、挥发性 B、延展性 C、可燃性 D、导电性4. 自然界中植物的光合作用需要消耗空气中的( )A、氮气 B、氧气 C、二氧化碳 D、稀有气体5. 下列物质由分子构成的是( )A、干冰 B、金刚石 C、氯化钠 D、铜导线6. 能用酒精灯直接加热的仪器是( )A、烧杯 B、量筒 C、漏斗 D、燃烧匙7. 宏观辨识与微观探析是化学学科核心素养之一、下表中对宏观事实的微观解释,不合理的是( )
选项
事实
解释
A
湿衣服在阳光下比在阴凉处干得快
温度越高,分子运动速率越快
B
氧气和液氧都能支持燃烧
同种分子化学性质相同
C
热胀冷缩
分子的大小随温度升降而改变
D
水在通电条件下,可分解为氧气和氢气
化学反应中分子是可分的
A、A B、B C、C D、D8. 下列实验操作正确的是( )A、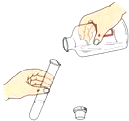 倾倒液体
B、
倾倒液体
B、 量取液体
C、
量取液体
C、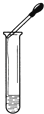 滴加液体
D、
滴加液体
D、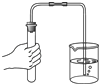 检查装置气密性
9. 下列变化过程中不属于缓慢氧化的是( )A、石蜡燃烧 B、动植物的呼吸 C、铁生锈 D、米饭变馊10. 关于物质燃烧的现象描述错误的是( )A、磷在空气中燃烧,反应剧烈,产生大量白雾 B、木炭燃烧产生使澄清石灰水变浑浊的气体 C、镁带在空气中燃烧,发出耀眼的白光,生成白色固体 D、硫在氧气中燃烧,火焰呈蓝紫色,生成有刺激性气味的气体11. 有关如图实验的说法正确的是( )
检查装置气密性
9. 下列变化过程中不属于缓慢氧化的是( )A、石蜡燃烧 B、动植物的呼吸 C、铁生锈 D、米饭变馊10. 关于物质燃烧的现象描述错误的是( )A、磷在空气中燃烧,反应剧烈,产生大量白雾 B、木炭燃烧产生使澄清石灰水变浑浊的气体 C、镁带在空气中燃烧,发出耀眼的白光,生成白色固体 D、硫在氧气中燃烧,火焰呈蓝紫色,生成有刺激性气味的气体11. 有关如图实验的说法正确的是( ) A、点燃氢气前不用检验纯度 B、干冷烧杯内壁无明显变化 C、b管气体能使带火星木条复燃 D、两个实验均可证明水的组成12. 生活中用到的下列物质,属于纯净物的是( )A、75%的消毒酒精 B、加碘食盐 C、冰水混合物 D、调味用的食醋13. 葡萄糖酸锌(C12H22O14Zn)口服液可在人体摄入锌不足时服用,其中属于微量元素的是( )A、氢元素 B、氧元素 C、锌元素 D、碳元素14. 翡翠的主要成分是硬玉【NaAl(SiO3)2】。其中Si的化合价为( )A、+1 B、-2 C、+3 D、+415. 北大生命科学学院蒋教授研究组发现,锰离子是细胞内天然免疫激活剂。在元素周期表中锰元素的信息如图所示,下列有关锰的说法错误的是 ( )
A、点燃氢气前不用检验纯度 B、干冷烧杯内壁无明显变化 C、b管气体能使带火星木条复燃 D、两个实验均可证明水的组成12. 生活中用到的下列物质,属于纯净物的是( )A、75%的消毒酒精 B、加碘食盐 C、冰水混合物 D、调味用的食醋13. 葡萄糖酸锌(C12H22O14Zn)口服液可在人体摄入锌不足时服用,其中属于微量元素的是( )A、氢元素 B、氧元素 C、锌元素 D、碳元素14. 翡翠的主要成分是硬玉【NaAl(SiO3)2】。其中Si的化合价为( )A、+1 B、-2 C、+3 D、+415. 北大生命科学学院蒋教授研究组发现,锰离子是细胞内天然免疫激活剂。在元素周期表中锰元素的信息如图所示,下列有关锰的说法错误的是 ( ) A、原子序数为 25 B、属于金属元素 C、相对原子质量为 54.94g D、原子核内质子数为 2516. 将 CO2气体通入紫色石蕊试液中,再加热溶液,溶液的颜色变化过程为( )A、紫色—红色—无色 B、紫色—蓝色—无色 C、紫色—无色—无色 D、紫色—红色—紫色17. 如图,过氧化氢在催化剂二氧化锰的作用下,迅速分解放出大量氧气.下列现象正确的是( )
A、原子序数为 25 B、属于金属元素 C、相对原子质量为 54.94g D、原子核内质子数为 2516. 将 CO2气体通入紫色石蕊试液中,再加热溶液,溶液的颜色变化过程为( )A、紫色—红色—无色 B、紫色—蓝色—无色 C、紫色—无色—无色 D、紫色—红色—紫色17. 如图,过氧化氢在催化剂二氧化锰的作用下,迅速分解放出大量氧气.下列现象正确的是( )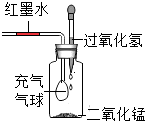 A、气球胀大,红墨水左移 B、气球缩小,红墨水右移 C、气球胀大,红墨水右移 D、气球缩小,红墨水左移18. 元素周期表中,同周期元素的结构和性质呈现一定的规律性变化。下表列出的是第三周期元素的原子半径及主要化合价(部分信息未列出)。下列有关说法错误的是 ( )
A、气球胀大,红墨水左移 B、气球缩小,红墨水右移 C、气球胀大,红墨水右移 D、气球缩小,红墨水左移18. 元素周期表中,同周期元素的结构和性质呈现一定的规律性变化。下表列出的是第三周期元素的原子半径及主要化合价(部分信息未列出)。下列有关说法错误的是 ( )元素
Na
Mg
①
Si
P
②
Cl
原子的最外层电子数
1
2
3
4
5
6
7
原子半径/10-10m
1.86
1.60
1.43
③
1.10
1.02
0.994
最高正化合价
最低负化合价
+1
+2
④
+4
-4
+5
-3
⑤
+7
-1
A、⑤处的最高正化合价是+6,最低负化合价是-2 B、③处的数值介于 1.10~1.43 之间 C、第三周期元素(Na~Cl)的最高正化合价数等于其原子的最外层电子数 D、①和②形成的化合物中①显+2 价,②显-2 价,形成的化合物的化学式为 AlO19. 如图为某同学设计的制取 CO2 的发生装置中,不能起到“能控制反应发生和停止”效果的是(提示:铜不与盐酸反应)( )A、 B、
B、 C、
C、 D、
D、 20. 合成氨工业生产中所用的 α-Fe 催化剂主要成分是 FeO、Fe2O3 , 当催化剂中 FeO 与 Fe2O3的质量之比为 9:20 时,其催化活性最高,此时 FeO 与 Fe2O3 混合物中铁的质量分数为( )A、31.0% B、45.0% C、72.4% D、74.5%
20. 合成氨工业生产中所用的 α-Fe 催化剂主要成分是 FeO、Fe2O3 , 当催化剂中 FeO 与 Fe2O3的质量之比为 9:20 时,其催化活性最高,此时 FeO 与 Fe2O3 混合物中铁的质量分数为( )A、31.0% B、45.0% C、72.4% D、74.5%二、填空题
-
21. 用化学用语填空(1)、钙元素俗称人体中的“钢筋”,2 个钙离子 ;(2)、金属镁燃烧会生成氧化镁,写出氧化镁中镁元素的化合价 ;(3)、人体中缺碘,易得甲状腺疾病,5 个碘原子 ;(4)、能供给呼吸的气体 ;(5)、“铜绿”加热分解产生的黑色固体 ;(6)、相对分子质量最小的氧化物化学式为 ;(7)、太阳中最丰富的元素是 ;(8)、石英砂可制造光导纤维,石英砂的主要成分是二氧化硅,其化学式为 。22. 空气是由多种气体组成的(1)、从分类角度:空气属于 (填“混合物”或“纯净物”)。(2)、从微观角度:若用“
 ”表示氮原子,“
”表示氮原子,“ ”表示氧原子。
”表示氧原子。 
①则用“
 ”可表示的微粒是 。(填化学式)
”可表示的微粒是 。(填化学式) ②同温同压下,气体的体积比等于其分子数目比。若空气中 1%的其它成分忽略不计,上图中可表示空气微观模型的是 (填字母)。
(3)、早在 18 世纪 70 年代,就有众多的科学家研究空气的成分,如瑞典科学家舍勒、英国化学家普里斯特利、法国化学家拉瓦锡等,其中第一次明确提出空气是由氧气和氮气组成结论的是 。(4)、工业上获取大量的氧气是根据空气中氧气(-183℃)和氮气(-196℃)沸点不同,采用 的方法,其操作步骤为:先将空气除尘净化,除去其中的 ,然后加压降温使空气液化,再通过控制温度将液态 先蒸发出来。(5)、夏天,从冰箱中取出的啤酒瓶外壁出现了液滴,证明空气中含有 ;石灰水长期露置在空气中,液面上会出现白色固体物质,说明空气中含有 ,白色固体物质是 (填“化学式”)。23. 物质世界丰富多彩。金刚石与石墨都是由碳元素组成的,从物质的分类角度说,金刚石与石墨都属于 (填“单质”或“化合物”)。金刚石是自然界最坚硬的矿物质,可用于 ;而石墨则比较柔软,可用于 。由此可见,物质的性质决定于其 。24. 水是一种宝贵的自然资源,它有许多性质和用途,但硬水中含有较多可溶性钙、镁化合物,硬水会给生活和生产带来许多麻烦。请回答下列问题。(1)、除去水中的难溶性物质,常用的方法是 。(2)、生活中为降低水的硬度,可采用的方法是 。(3)、用 可区分硬水和软水。三、综合题
-
25. 科学探究是学习化学的重要方式,假设与验证是探究过程中的重要环节。为了 探究“铁丝可以在纯净的氧气中燃烧”,同学们将一根火柴梗系入一段螺旋状“铁丝”(可能是纯铁丝或含碳杂质的铁丝)末端,用镊子夹住“铁丝”,然后在酒精灯上点燃火柴,将“铁丝”由集气瓶口向下慢慢伸入,观察现象:(1)、铁丝绕成螺旋状的目的是 ;铁丝末端系一根火柴的作用是 。(2)、甲同学只发现“铁丝”红热一下,就没有观察到其他现象,请你分析铁丝没有燃烧的可能原因是 。(3)、铁丝在纯净的氧气中燃烧,用化学式表示其反应 。(4)、乙同学发现“铁丝”在纯净氧气中燃烧起来,实验结束后该同学整理仪器时发现集气瓶底炸裂,原因可能是 。(5)、丙同学对铁丝在氧气中燃烧为什么会火星四射进行探究。下表是他将纯镁条和不同含碳量的铁丝(镁条和铁丝直径均为 0.4mm)放入氧气中燃烧时的实验现象的记录。请你分析完成表:
物质
镁条
含碳0.05%的铁丝
含碳 0.2%的铁丝
含碳 0.6%的铁丝
燃烧时的现象
剧烈燃烧,发出耀眼白光,无火星
剧烈燃烧极少火星
剧烈燃烧少量火星
通过以上实验,说明铁丝燃烧时是否出现火星与 有关。
26. 下图所示为实验室常用的实验装置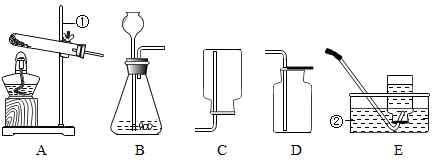
据此回答下列问题:
(1)、写出带标号仪器的名称:① ;② 。(2)、实验室用 A 装置制取 O2 , 应选用 (填“高锰酸钾”或“氯酸钾”),用化学 式表示其反应 。(3)、实验室用 B 装置制取 CO2 , 用化学式表示其反应 。实验前需要检查装置气密性,方法是:连接好装置,在右侧连接一只注射器,向长颈漏斗中加水至 ,缓缓推动注射器活塞,若 ,则说明装置气密性良好。实验室收集 CO2 , 适宜选用装置 。(4)、F装置可用来测量生成的CO2气体的体积,在水面上放一层植物油的目的是 ,植物油上方原有的空气对实验 的结果 (填“有”或“没有”)明显影响。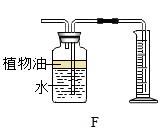 (5)、【查阅资料】
(5)、【查阅资料】1加热熟石灰和氯化铵的固体混合物生成氨气。
2氨气是一种具有刺激性气味的无色气体,密度比空气小,极易溶于水。
3湿润的红色石蕊试纸遇到氨气变蓝色。
制取氨气的装置应与实验室用 (填“高锰酸钾”或“双氧水”) 制氧气的装置相同,氨气的化学式 。若用右图装置收集氨气,进气口应为 端(填“m”或“n”),检验氨气是否集满的方法是 。
 27. 某校兴趣小组对空气中氧气的体积含量测定展开了探究。(1)、(一)【实验改进】如图是甲同学对“空气中氧气体积分数测定”实验的改进装置。主要操作是:在实际容积为 150mL的集气瓶里,先加入50mL的水,右侧的量筒(量程100mL)内加入50mL水。再按图连接好仪器,按下灼热的玻璃棒,红磷立即被点燃。
27. 某校兴趣小组对空气中氧气的体积含量测定展开了探究。(1)、(一)【实验改进】如图是甲同学对“空气中氧气体积分数测定”实验的改进装置。主要操作是:在实际容积为 150mL的集气瓶里,先加入50mL的水,右侧的量筒(量程100mL)内加入50mL水。再按图连接好仪器,按下灼热的玻璃棒,红磷立即被点燃。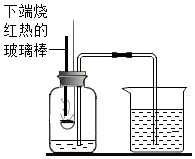
红磷燃烧的产物是 ;(填化学式)
(2)、红磷从燃烧到熄灭冷却的过程中,集气瓶内水面的变化 ;(3)、集气瓶里预先装进的 50mL 水,在实验过程中所起到的作用有 (填写序号)a.加快集气瓶冷却
b.气管末端形成液封,防气体逸出
c.缓冲集气瓶内气压的骤然升高
(4)、燃烧结束并充分冷却后,打开止水夹,待量筒内水面不再下降时,且调节到集气瓶和 量筒中液面相平,记录量筒内水的体积为 33.6mL。 甲同学实验测得氧气约占空气总体积的 (用百分数表示)。(5)、(二)【拓展研究】乙同学发现甲同学实验测得的精确度不高,为提高测定的精确度,在网站查阅了相关资料,改用“暖宝宝”对实验进行创新改进。【查阅资料】
1“暖宝宝”能耗尽容器中的氧气。
2“暖宝宝”的主要成分为铁粉、炭粉和少量氯化钠。
3“暖宝宝”发热的主要原理是铁粉与氧气、水共同作用生成氢氧化铁(铁的生锈)。
暖宝宝中少量氯化钠作用是 ;
(6)、暖宝宝发热原理,用化学式表示其反应 ,该反应 能转化为热能。(7)、实验步骤:乙同学实验的改进装置如图。主要操作是:在实际容积为 150mL 的集气瓶里,先加入 50mL 的水,右侧连接着装有 50mL 空气的注射器。(注射器活塞与内壁摩擦非常小,可忽略不计)
重复 3 次上述实验及数据如下表。
试验次数
1
2
3
注射器剩余气体读数
18.7mL
18.9mL
18.8mL
得出结论:根据表格中的实验数据计算,可知空气中氧气含量为 (用百分数表示)
四、计算题
-
28. 将3.2g某物质R放入足量的氧气中完全燃烧,生成CO2与H2O,并使生成的气体全部通入如图所示的装置中(提示:浓硫酸只吸收水,氢氧化钠溶液吸收二氧化碳。假定气体全部被吸收,外界空气对实验无影响)。

实验中测得有关数据如下:
实验前
实验后
浓硫酸的质量
301.3g
304.9g
NaOH 的质量
213.0g
217.4g
根据实验数据完成下列各题(写出每一步的计算过程):
(1)、实验结束后生成物中水的质量为 g,二氧化碳的质量为 g;(2)、生成的水中氢元素的质量为 g,二氧化碳中碳元素的质量为 g;(3)、R中碳元素与氢元素的质量比为 ;据此分析推理:组成物质R的元素是 。