福建省龙岩市上杭县城区四校2019-2020学年九年级上学期期中化学试题
试卷更新日期:2022-09-28 类型:期中考试
一、单选题
-
1. 自然界中存在氧循环和碳循环,其中能将二氧化碳转化为氧气的是( )A、钢铁的锈蚀 B、植物的光合作用 C、动植物的呼吸 D、化石燃料的燃烧2. 下列物质的用途中,主要利用其物理性质的是( )
A、氢气用于填充气球 B、红磷燃烧测空气中氧气含量 C、氮气用于食品防腐 D、氧气供给呼吸3. 下列图示实验操作中正确的是( )
A、 向试管中滴加液体
B、
向试管中滴加液体
B、 给试管中液体加热
C、
给试管中液体加热
C、 称量一定质量的食盐
D、
称量一定质量的食盐
D、 检查装置的气密性
4. 下列化学用语书写正确的是( )A、碳酸钾:KCO3 B、镁离子:Mg2- C、2个氢原子:H2 D、二氧化硫中硫元素显+4价:5. 下列物质在氧气中燃烧,对其实验现象的描述错误的是( )A、红磷:剧烈燃烧,产生大量的白烟 B、蜡烛:剧烈燃烧,发出白光 C、镁条:发出耀眼白光,生成白色固体 D、细铁丝:火星四射,生成白色固体6. 如图为载人航天器工作仓中气体成分的微观示意图,已知在同温同压下,气体的体积之比等于分子个数之比,下列说法不合理的是( )
检查装置的气密性
4. 下列化学用语书写正确的是( )A、碳酸钾:KCO3 B、镁离子:Mg2- C、2个氢原子:H2 D、二氧化硫中硫元素显+4价:5. 下列物质在氧气中燃烧,对其实验现象的描述错误的是( )A、红磷:剧烈燃烧,产生大量的白烟 B、蜡烛:剧烈燃烧,发出白光 C、镁条:发出耀眼白光,生成白色固体 D、细铁丝:火星四射,生成白色固体6. 如图为载人航天器工作仓中气体成分的微观示意图,已知在同温同压下,气体的体积之比等于分子个数之比,下列说法不合理的是( )
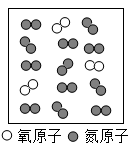 A、1个氧分子是由2个氧原子构成的 B、氧分子和氮分子能均匀混合,是因为航天器处于失重状态 C、航天器工作仓内氮气与氧气的体积比与地表空气接近 D、航天器工作仓中充氮气可避免发生火灾后燃烧过于剧烈7. A、B、C三只小烧杯内依次盛有一定体积的浓氨水、酚酞溶液、酚酞溶液,按图所示进行探究活动,不能得到的结论是( )
A、1个氧分子是由2个氧原子构成的 B、氧分子和氮分子能均匀混合,是因为航天器处于失重状态 C、航天器工作仓内氮气与氧气的体积比与地表空气接近 D、航天器工作仓中充氮气可避免发生火灾后燃烧过于剧烈7. A、B、C三只小烧杯内依次盛有一定体积的浓氨水、酚酞溶液、酚酞溶液,按图所示进行探究活动,不能得到的结论是( )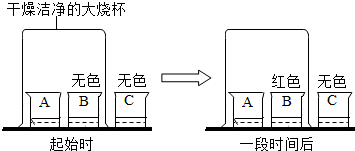 A、氨分子是不断运动的 B、氨分子溶于水,形成的氨水使酚酞溶液变红 C、水分子是不断运动的 D、空气不能使酚酞溶液变红8. 稀土元素铕(Eu)是激光及原子能应用的重要的材料。已知氯化铕的化学式为EuCl3 , 则氧化铕的化学式为()A、EuO B、Eu2O3 C、Eu3O2 D、EuO39. 推理是一种重要的化学思维方法,以下推理合理的是( )
A、氨分子是不断运动的 B、氨分子溶于水,形成的氨水使酚酞溶液变红 C、水分子是不断运动的 D、空气不能使酚酞溶液变红8. 稀土元素铕(Eu)是激光及原子能应用的重要的材料。已知氯化铕的化学式为EuCl3 , 则氧化铕的化学式为()A、EuO B、Eu2O3 C、Eu3O2 D、EuO39. 推理是一种重要的化学思维方法,以下推理合理的是( )
A、离子都是带电的粒子,所以带电的粒子一定是离子 B、氧气是由氧元素组成的,所以制取氧气的反应物中一定含氧元素 C、单质是由一种元素组成的,所以一种元素只能组成一种单质 D、化合物都是由不同元素组成的,所以由不同种元素组成的物质一定是化合物10. 埃博拉病毒是当今世界上最凶险的病毒之一,最近科学家研制出一种能抗击该病毒的药物,其化学式为C5H4N3O2F。下列有关这种药物的说法,正确的是( )A、C5H4N3O2F中含有1个氧分子 B、碳、氢元素的质量比是5∶4 C、1个C5H4N3O2F的分子由15个原子构成 D、该药物是由多种元素组成的混合物二、填空题
-
11. 化学与生产、生活密切相关。(1)、为预防老年人患骨质疏松症,常食用乳制品等食物,补充人体需要的(填元素符号)。(2)、空气中体积含量最多的气体是(填化学式),它可用于果蔬食品的保护气。(3)、将“嫦娥一号”送上太空的火箭推力巨大,因为它所使用的燃料是液氢、助燃剂是液氧,则液氢燃烧的反应文字表达式为。属于反应类型。(4)、2010年,我国因为能耗大且寿命短而全面禁止使用白炽灯。为了提高白炽灯的使用寿命,往往在灯泡内添加了红磷,其反应原理的文字表达式是。12. 2019年是俄国化学家门捷列夫发明元素周期表150周年,联合国将今年定为“国际化学元素周期表年”。元素周期表揭示了化学元素间的内在联系,使其构成一个完整体系。(1)、下图为氯元素在周期表中的部分信息和氯原子及镁原子的结构示意图。

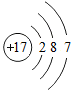
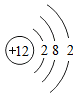
写出图中①代表的元素符号 , 镁属于(填“金属”或“非金属”)元素。
(2)、由氯和镁两种元素组成化合物氯化镁的化学式为。(3)、下列微粒结构示意图中,属于阴离子的是____(填序号)。A、 B、
B、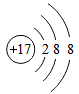 C、
C、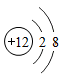 (4)、已知原子的核外电子层数与元素所在周期表中周期的序数相同,则镁元素在元素周期表中排在第周期。13. 2016年签订生效的气候变化协定《巴黎协定》要求:2030年全球CO2排放量要比2014年减少20%。根据要求回答问题:(1)、大量排放CO2 , 会造成的环境问题是。(2)、要实现减排目标,需要化学吸收、富氧燃烧等“碳捕集技术”。
(4)、已知原子的核外电子层数与元素所在周期表中周期的序数相同,则镁元素在元素周期表中排在第周期。13. 2016年签订生效的气候变化协定《巴黎协定》要求:2030年全球CO2排放量要比2014年减少20%。根据要求回答问题:(1)、大量排放CO2 , 会造成的环境问题是。(2)、要实现减排目标,需要化学吸收、富氧燃烧等“碳捕集技术”。①化学吸收就是利用化学试剂吸收CO2。表示该技术的一个化学反应文字表达式为;
②富氧燃烧是指用高浓度氧气替代空气进行燃烧反应,排出高浓度的CO2。木炭在氧气中燃烧的现象是。
(3)、CO2也是人类生存不可缺少的物质。举一例说明CO2在人类生产或生活中的应用。答:。14. 绿水青山就是金山银山,化学让水变得更洁净。(1)、如图是电解水的实验装置图,请根据你所了解的知识填空: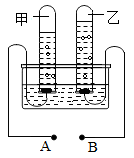
①装置图中A为极;
②乙试管中得到的气体是 , 可用来检验;
③甲管与乙管中产生的气体体积比是;
④该实验中为了增加水的导电性往往要在水中加入。
(2)、小明同学力争做个环保小模范。他想把家里的生活污水进行处理再利用,他家的生活污水中含有碎菜叶、鱼鳞片、塑料薄膜片、泥沙等并有一股臭味。请你帮他解决下述问题:①他想除去污水的腥臭味,可用(填物质名称)吸附。
②他想除去碎菜叶、鱼鳞、塑料、泥沙等,化学上可采用操作除去。垃圾分类可分为:可回收垃圾、厨余垃圾、有害垃圾、其它垃圾。碎菜叶、鱼鳞属于垃圾。
③他处理后的生活污水,可用于。
④生活中常用来区分硬水和软水,生活中可用的方法来降低水的硬度。
15. 科学家受光合作用启发,利用阳光将水、二氧化碳转化成氧气和异丙醇(C3H8O)燃料,构建了一个安全、高效的人工光合作用系统,统称为“人工树叶”如图。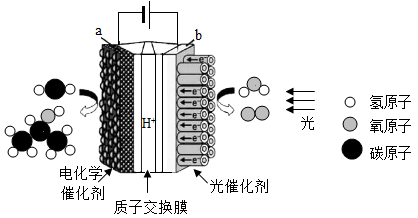 (1)、人工光合作用系统发生的是变化(填物理或化学)。(2)、该反应中反应物和生成物共有种化合物。(3)、异丙醇中碳、氧、氢元素质量比是。(4)、若异丙醇完全燃烧,生成物是。
(1)、人工光合作用系统发生的是变化(填物理或化学)。(2)、该反应中反应物和生成物共有种化合物。(3)、异丙醇中碳、氧、氢元素质量比是。(4)、若异丙醇完全燃烧,生成物是。三、综合题
-
16. 结合下列实验装置图回答问题:
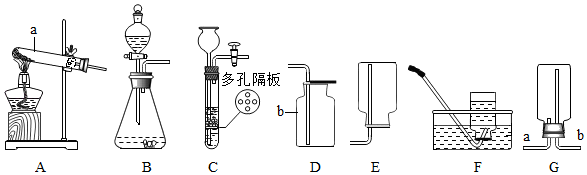 (1)、写出标有序号的仪器名称:a:;b。(2)、实验室选用A装置来制取氧气,发生的符号表达式为。若用F装置收集氧气,当 , 说明已经集满。(3)、实验室选用B装置来制取氧气,若反应很剧烈,据此提出实验安全注意事项是。(填序号)
(1)、写出标有序号的仪器名称:a:;b。(2)、实验室选用A装置来制取氧气,发生的符号表达式为。若用F装置收集氧气,当 , 说明已经集满。(3)、实验室选用B装置来制取氧气,若反应很剧烈,据此提出实验安全注意事项是。(填序号)①控制滴液速度 ②用小体积的锥形瓶 ③加热反应物④降低反应物浓度
(4)、实验室利用装置C可制备CO2 , 其反应的符号表达式为:。装置C气密性检查的方法是:。(5)、实验室常用加热硫酸铵和熟石灰两种固体混合物来制取氨气。氨气极易溶于水,且密度比空气小,获取氨气的组合装置应用(从装置A~F中选择)。若使用图G所示装置收集氨气,则气体应从(填“a”或“b”)通入。17. 科学探究和控制化学反应条件有重要意义。(1)、甲同学在实验时误把CuO粉末当成MnO2放入双氧水中,发现也有大量气泡产生,他意识到这个不正确后,联想到MnO2可作为H2O2分解的催化剂,那么CuO能否作为H2O2分解的催化剂呢?【提出猜想】CuO能作为H2O2分解的催化剂。
【实验验证】甲同学依次设计了三个实验:
实验一:取一定量的H2O2溶液于试管中,观察到有极少量气泡产生,伸入带火星的木条,没有复燃。说明H2O2溶液常温下缓慢分解。
实验二:在实验一的试管中加入WgCuO粉末,有大量气泡产生,然后伸入带火星的木条,木条复燃。说明CuO(选填“能”或“不能”)加快H2O2的分解。
实验三:待反应结束后,将试管里的不溶物滤出,并洗涤、干燥、称量,固体质量仍为Wg。说明CuO在该化学反应前后不变。
(2)、【实验结论】甲同学认为,CuO粉末可以作为H2O2分解的催化剂。写出该反应的文字表达式。(3)、【反思评价】乙同学认为要证明甲同学的结论正确,仅做这三个实验还不充分,需要再补充一个探究实验。即验证反应前后CuO的是否改变。(4)、【拓展应用】为探究影响H2O2溶液分解速率的因素,丙同学选择了A和B两种催化剂进行了以下对比实验:用足量等体积H2O2溶液制取并收集一瓶O2所需的时间(分钟)
编号
浓度
催化剂
30%H2O2
15%H2O2
5%H2O2
1
5gA
0.2
0.8
2.0
2
xgB
7.0
9.0
16.0
表中x的值应为。
实验结论:①在相同条件下使用作催化剂,双氧水分解得更快;
②。
(5)、乙同学通过查阅资料得知,双氧水在70℃以上会较快分解产生氧气,为了验证加热双氧水也可以制取氧气,同学们用如图示装置进行实验,实验装置已确定气密性良好。实验中观察到试管内产生气泡,但将带火星的木条放在导管口没有复燃,他经过思考分析,可能的原因是反应生成的氧气中混有大量的 , 于是对实验装置进行了改进,结果得出了正确的结论。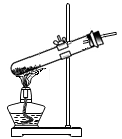
乙同学怎样改进才能检验出氧气生成?。
四、计算题
-
18. 尿素是一种常用的化肥,化学式为CO(NH2)2 , 请填空:(1)、尿素分子中氮原子与氢原子的个数比为;(2)、120g的尿素与g硝酸铵(NH4NO3)的氮元素相等。(3)、某种尿素产品的含氮量为46.2%,该产品是纯净物还是混合物?请写出计算过程。