浙教版科学 九上 净化、除杂类流程图练习
试卷更新日期:2022-09-28 类型:复习试卷
一、单选题
-
1. 某废液中只含有Fe(NO3)2、Cu(NO3)2、Ba(NO3)2三种溶质。为了旧收金属、保护环境,小金同学设计了如图方案(所加试剂均过量)。下列判断不正确的是( )
 A、固体a是混台物 B、溶液B中的含有的盐是Ba(NO3)2和NaNO3 C、X可能是Na2CO3 D、若回收到6.4g固体a,则加入的铁屑质量为5.6g2. 为除去粗盐中含有的氯化镁、硫酸钠、氯化钙等杂质,应加入过量的氢氧化钠、氯化钡、碳酸钠等物质,将杂质转化为沉淀。过滤去除沉淀后,再向滤液中加入适量的盐酸得到精盐水。实验操作过程如图所示:
A、固体a是混台物 B、溶液B中的含有的盐是Ba(NO3)2和NaNO3 C、X可能是Na2CO3 D、若回收到6.4g固体a,则加入的铁屑质量为5.6g2. 为除去粗盐中含有的氯化镁、硫酸钠、氯化钙等杂质,应加入过量的氢氧化钠、氯化钡、碳酸钠等物质,将杂质转化为沉淀。过滤去除沉淀后,再向滤液中加入适量的盐酸得到精盐水。实验操作过程如图所示:
下列说法错误的是( )
A、实验操作步骤也可以是①③④②⑤⑥ B、操作⑥中,加入盐酸的目的是除去过量的氢氧化钠和碳酸钠,将滤液的pH调为7 C、在实验操作过程中,氯化钡和碳酸钠溶液的添加顺序可以颠倒 D、操作⑤得到的沉淀中共有四种物质3. 为了探究实验室中久置的氢氧化钠固体的变质情况,同学们进行如右图所示的实验。下列分析和结论正确的是( ) A、若D为气体,则加入甲溶液的目的是证明样品已变质 B、若D为白色固体,则溶液A是Na2CO3溶液 C、若D为白色固体,且溶液C为红色,则样品一定是部分变质 D、若Ⅱ、Ⅲ均有明显现象,则说明样品一定完全变质
A、若D为气体,则加入甲溶液的目的是证明样品已变质 B、若D为白色固体,则溶液A是Na2CO3溶液 C、若D为白色固体,且溶液C为红色,则样品一定是部分变质 D、若Ⅱ、Ⅲ均有明显现象,则说明样品一定完全变质二、填空题
-
4. 已知:(1)向氯化铝溶液中滴加氢氧化钠溶液,有白色沉淀[Al(OH)3]生成.当继续滴加氢氧化钠溶液时,白色沉淀逐渐减少,直至消失,生成一种可溶性盐.此反应的化学方程式是:Al(OH)3+NaOH﹣﹣NaAlO2(偏铝酸钠)+2H2O;(2)氢氧化铁固体不溶于氢氧化钠溶液.现欲除去氯化铁溶液中混有的少量氯化铝杂质,得到较为纯净的氯化铁溶液,某同学设计了如下提纯方案:

试回答:
(1)、B溶液的名称是;(2)、滤液中的溶质有、、 . (填化学式)5. 为了除去NaCl溶液中含有少量的MgCl2、CaCl2和Na2SO4等杂质,某小组同学选用Na2CO3溶液、稀盐酸、Ba(OH)2溶液三种试剂,按一定的顺序进行如图所示的实验。

回答下列问题:
(1)、实验Ⅰ中加入试剂A除去的杂质是 ;(2)、滤液②中除Na+和Cl﹣外,还含有的离子是(填离子符号);(3)、实验Ⅲ中发生的中和反应的化学方程式是。6. 为了除去NaCl溶液中含有少量的MgCl2、CaCl2和Na2SO4等杂质,某小组同学选用Na2CO3溶液、稀盐酸、Ba(OH)2溶液三种试剂,按一定的顺序进行如图所示的实验。

回答下列问题:
(1)、实验Ⅰ中加入试剂A除去的杂质是 ;(2)、滤液②中除Na+和Cl﹣外,还含有的离子是(填离子符号);(3)、实验Ⅲ中发生的中和反应的化学方程式是。7. 通过海水晒制可得粗盐,粗盐中除NaCl外,还含有MgCl2、CaCl2、MgSO4以及泥沙等杂质。以下是一种由粗盐制备精盐的实验方案流程图:

分析该流程图,回答下列问题:
(1)、试剂X为(填写化学式)。(2)、加适量HCl溶液的目的是。(3)、操作Y。(4)、选择除杂的试剂不能用KOH代替NaOH溶液,理由是。8. 实验室的某一废液中含有Cu(NO3)2、NaNO3和AgNO3三种溶质。小科同学设计了如下实验方案来分离、回收废液中的金属铜和银。根据以下实验过程和现象回答问题: (1)、加入适量铜粉后,废液中发生反应的化学方程式是。(2)、滤液D中的溶质有。9. 下列两种方案体现了物质除杂的不同思路:
(1)、加入适量铜粉后,废液中发生反应的化学方程式是。(2)、滤液D中的溶质有。9. 下列两种方案体现了物质除杂的不同思路:思路一:将杂质直接转化为所需物质;
思路二:将所需物质转化为中间物质,再将中间物质转化为所需物质。
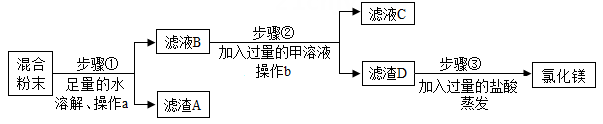 (1)、运用思路一:除去氯化镁粉末中混有的少量氯化钡,先加足量的水溶解,再向溶液中加入适量的溶液,过滤、蒸发,即得氯化镁固体。(2)、运用思路二:除去氯化镁粉末中混有的少量氯化钡、氯化钠和硫酸钾。根据流程回答以下问题。
(1)、运用思路一:除去氯化镁粉末中混有的少量氯化钡,先加足量的水溶解,再向溶液中加入适量的溶液,过滤、蒸发,即得氯化镁固体。(2)、运用思路二:除去氯化镁粉末中混有的少量氯化钡、氯化钠和硫酸钾。根据流程回答以下问题。步骤①中反应的化学方程式是 , 滤液B中一定含有的溶质是;
步骤②中加入的甲溶液是(填化学式)溶液。
10. 氯化钠是日常生活中的必需品,某氯化钠样品中除含氯化钠外,还含有少量的 CaCl2 和MgCl2 以及不溶性杂质。以下是提纯该样品的操作流程图。

请回答下列问题:
(1)、操作 X 的名称是。(2)、Y 溶液中溶质的化学式是。(3)、上述操作流程中共发生个复分解反应。11. 某混合溶液可能含 Na2SO4、Na2CO3、NaOH 中的一种或几种溶质,为验证其组成进行如图实验: (1)、混合溶液的溶质中一定有 , 产生该气体的反应的化学方程式为;(2)、按该加入试剂的顺序,不能验证所有的物质,原因是 , 改变上述三步中所 用三种试剂的滴加顺序,就能验证所有物质的有无,则这三种试剂滴加的顺序依次为(填写序号)。12. 硅(Si)是太阳能电池和电脑芯片不可缺少的材料。利用石英砂(主要成分为SiO2)生产高纯硅(Si)的流程图如下(整个制备过程必须达到无水、无氧气)。据图回答下列问题。(提示:Si+3HCl===SiHCl3+H2↑)
(1)、混合溶液的溶质中一定有 , 产生该气体的反应的化学方程式为;(2)、按该加入试剂的顺序,不能验证所有的物质,原因是 , 改变上述三步中所 用三种试剂的滴加顺序,就能验证所有物质的有无,则这三种试剂滴加的顺序依次为(填写序号)。12. 硅(Si)是太阳能电池和电脑芯片不可缺少的材料。利用石英砂(主要成分为SiO2)生产高纯硅(Si)的流程图如下(整个制备过程必须达到无水、无氧气)。据图回答下列问题。(提示:Si+3HCl===SiHCl3+H2↑) (1)、三氯硅烷(SiHCl3)是由种元素组成的物质。(2)、在H2和SiHCl3反应的过程中若混入O2 , 可能引起的后果是。(3)、以上生产高纯硅的流程中,可循环使用的物质是。13. 金属镁质轻、强度高,现在广泛应用于航空、航天、汽车制造等行业,金属镁工业被称为二十一世纪的朝阳产业。据科学实验测定每升海水约含1.27克镁。现在世界镁产量的60%都从海水中含镁的盐类物质里提取,下列生产镁的过程框图中A、B、C均代表一种主要生成物。
(1)、三氯硅烷(SiHCl3)是由种元素组成的物质。(2)、在H2和SiHCl3反应的过程中若混入O2 , 可能引起的后果是。(3)、以上生产高纯硅的流程中,可循环使用的物质是。13. 金属镁质轻、强度高,现在广泛应用于航空、航天、汽车制造等行业,金属镁工业被称为二十一世纪的朝阳产业。据科学实验测定每升海水约含1.27克镁。现在世界镁产量的60%都从海水中含镁的盐类物质里提取,下列生产镁的过程框图中A、B、C均代表一种主要生成物。 (1)、用化学式表示B的组成:。(2)、生产过程中属于复分解反应的有(用序号表示)。
(1)、用化学式表示B的组成:。(2)、生产过程中属于复分解反应的有(用序号表示)。三、实验探究题
-
14. 一种制备氢氧化镁的生产流程如图所示,MgCl2 和 NaOH 按恰好完全反应的比例加料。
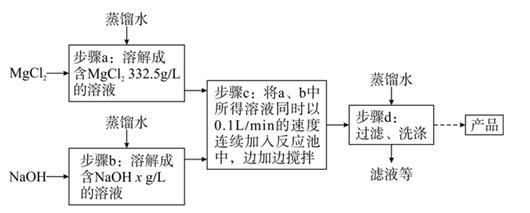 (1)、写出步骤 c 中发生反应的化学方程式:。(2)、x=。(3)、过滤得到的粗产品还要经过洗涤,洗涤时主要除去的杂质是。15. 实验室有一包粉末状物质。可能是氯化钠、硫酸钠、碳酸钠、氯化铁中的一种或几种组成,为了确定原粉末的成分,兴趣小组的同学,按图所示进行试验:
(1)、写出步骤 c 中发生反应的化学方程式:。(2)、x=。(3)、过滤得到的粗产品还要经过洗涤,洗涤时主要除去的杂质是。15. 实验室有一包粉末状物质。可能是氯化钠、硫酸钠、碳酸钠、氯化铁中的一种或几种组成,为了确定原粉末的成分,兴趣小组的同学,按图所示进行试验: (1)、该粉末中一定不含有的物质是 , 操作Ⅰ的名称是 , 白色沉淀是。(2)、加入试剂A要过量的原因是。
(1)、该粉末中一定不含有的物质是 , 操作Ⅰ的名称是 , 白色沉淀是。(2)、加入试剂A要过量的原因是。四、解答题
-
16. 某化学兴趣小组欲分离KCl和BaCl2的混合溶液,得到都含单一溶质的两种溶液。他们设计了如图所示的实验流程:

供选试剂:K2SO4溶液、Na2CO3溶液、K2CO3溶液、盐酸、稀硫酸。
(1)、步骤①中,分离A、B的实验使用的试剂是。(2)、沉淀 B 表面残留少量滤液,需用蒸馏水多次洗涤,为了检验沉淀 B 是否洗涤干净, 可向步骤②的最后一次洗涤液中加入的试剂是 (双选,填序号)。A、氢氧化钠溶液 B、氯化钙溶液 C、氯化钠溶液 D、硝酸银和稀硝酸混合溶液(3)、步骤③中,发生反应的化学方程式为。(4)、要达到预期的目的,还需要改进的方法为。17. 酸、碱、盐在生产和生活中有广泛的应用。(1)、焙制糕点所用发酵粉中含有碳酸氢钠,其俗名为 (填字母)。A、纯碱 B、烧碱 C、苏打 D、小苏打(2)、如图甲是氢氧化钠溶液与硫酸反应时溶液pH变化的示意图。
①根据图示判断,该实验是将(选填“氢氧化钠溶液”或“硫酸”)滴加到另一种溶液中。
②滴入溶液体积为V2 mL时,溶液中的溶质为。
(3)、为除去粗盐水中的可溶性杂质MgSO4、CaCl2 , 某科学小组设计了如图乙方案:
①过滤用到的玻璃仪器有烧杯、玻璃棒和。
②写出加入Ba(OH)2溶液时反应的化学方程式:。(提示:微溶物不形成沉淀)
③溶液X中含有哪些杂质?。请设计实验加以证明:。(简要写出实验步骤和现象)
(4)、为测定某石灰石样品中碳酸钙的质量分数,称取10g石灰石(杂质不参加反应)放入烧杯中,加入100g稀盐酸,二者恰好完全反应,反应后烧杯中剩余物质的总质量为106.7g(气体的溶解忽略不计)。请计算该样品中碳酸钙的质量分数。18. 氯化钡是一种可溶性重金属盐,广泛应用于化工领域。用毒重石(主要成分为BaCO3)制备氯化钡晶体的部分工艺流程如下图: (1)、本流程中“浓缩”“结晶”属于变化。(2)、滤液2中可利用的物质除水外,还有(填化学式)。(3)、下列措施中,能提高原料的利用率和氯化钡晶体产量的有(选填序号)。
(1)、本流程中“浓缩”“结晶”属于变化。(2)、滤液2中可利用的物质除水外,还有(填化学式)。(3)、下列措施中,能提高原料的利用率和氯化钡晶体产量的有(选填序号)。①将毒重石进行粉碎 ②加入足量的稀盐酸 ③将滤液2通入到滤液1中
19. 兴趣小组的同学从实验室中收集一桶含有FeSO4、CuSO4的废液。他们想从中回收金属铜和硫酸亚铁晶体,设计了如下方案:
小杨、小陈同学在步骤I中提出X能否改用锌的问题上产生了分歧。请你也参与他们的讨论,表明论点,并说明理由。
20. 图甲中A是一种常见的酸,它能与黑色固体B反应,B质量为8克,将NaOH溶液渐渐加入到C中,生成蓝色沉淀E的质量与加入NaOH溶液的质量关系如图乙所示,在D中加入Ba(NO3)2溶液能生成一种不溶于稀硝酸的白色沉淀。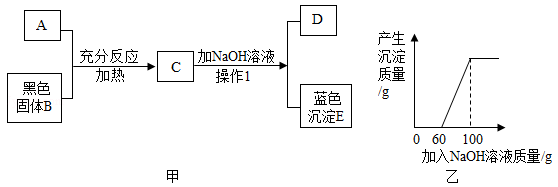 (1)、A溶液中溶质的化学式为;(2)、操作1的名称是;(3)、NaOH溶液中溶质的质量分数是多少?(4)、C溶液中加入NaOH溶液至恰好完全反应时,所得溶液溶质的质量是多少?
(1)、A溶液中溶质的化学式为;(2)、操作1的名称是;(3)、NaOH溶液中溶质的质量分数是多少?(4)、C溶液中加入NaOH溶液至恰好完全反应时,所得溶液溶质的质量是多少?