浙江省Z20名校新高考研究联盟2022-2023学年高三上学期第一次联考化学试题
试卷更新日期:2022-09-26 类型:开学考试
一、单选题
-
1. 下列关于物质的分类错误的是( )A、尿素—有机物 B、云—气溶胶 C、纤维素—纯净物 D、硝酸—共价化合物2. 下列物质属于强电解质的是( )A、Na2CO3 B、Mg(OH)2 C、HCOOH D、CH3CH2OH3. 下列仪器及对应名称错误的是( )
 A、图甲球形冷凝管 B、图乙坩埚 C、图丙圆底烧瓶 D、图丁分液漏斗4. 下列物质对应的化学式正确的是( )A、硬脂酸:C17H33COOH B、芒硝:Na2SO4•10H2O C、碱石灰:Ca(OH)2 D、氯仿:CCl45. 下列表示正确的是( )A、基态Fe的电子排布式:[Ar]3d6 B、氯乙烷的结构简式:ClCH2CH2Cl C、1-丁醇的键线式:
A、图甲球形冷凝管 B、图乙坩埚 C、图丙圆底烧瓶 D、图丁分液漏斗4. 下列物质对应的化学式正确的是( )A、硬脂酸:C17H33COOH B、芒硝:Na2SO4•10H2O C、碱石灰:Ca(OH)2 D、氯仿:CCl45. 下列表示正确的是( )A、基态Fe的电子排布式:[Ar]3d6 B、氯乙烷的结构简式:ClCH2CH2Cl C、1-丁醇的键线式: D、NH3的VSEPR模型:
D、NH3的VSEPR模型: 6. 下列说法错误的是( )A、
6. 下列说法错误的是( )A、 与
与 是同系物
B、HCOOCH3与CH3OCHO是同种物质
C、碳纳米管和石墨烯是同素异形体
D、异戊烷和2,2-二甲基丙烷是同分异构体
7. 工业制硅第二步反应为SiHCl3+H2Si+3HCl,下列说法错误的是( )A、SiHCl3中的Si呈+4价,分子空间结构为四面体形 B、该反应中SiHCl3既是氧化剂又是还原剂 C、该反应说明在该温度下氢气的还原性强于硅单质 D、当1 mol H2完全反应时,该反应转移2 mol电子8. 下列说法错误的是( )A、海水提溴过程中鼓入热空气的目的是除去多余的氯气 B、接触法制硫酸,用98.3%H2SO4吸收SO3 , 而不是用水吸收 C、将Cl2通入冷的石灰乳中,可制得有效成分为Ca(ClO)2的漂白粉 D、合成氨反应的原料气必须经过净化,目的是防止混有的杂质使催化剂“中毒”9. 下列离子方程式错误的是( )A、硫酸亚铁溶液与碳酸氢钠溶液混合并通入空气:4Fe2++8HCO+2H2O+O2=4Fe(OH)3↓+8CO2↑ B、向Ba(OH)2溶液中滴加少量NaHCO3溶液:Ba2++2OH-+2HCO=BaCO3↓+CO+2H2O C、氯化银沉淀溶于氨水:AgCl+2NH3=[Ag(NH3)2]++Cl- D、用硫酸铜溶液吸收H2S气体:Cu2++H2S=CuS↓+2H+10. 下列“类比”结果正确的是( )A、Cl2、Br2、I2的沸点逐渐升高,则H2、N2、O2的沸点也逐渐升高 B、CH3CHO与H2可发生加成反应,则相同条件下CH3COOH也可以与H2发生加成反应 C、向Na2CO3中加入少量水,伴随放热现象,则向NaHCO3中加入少量水,也伴随放热现象 D、乙醇与足量酸性高锰酸钾溶液反应生成乙酸,则乙二醇与足量酸性高锰酸钾溶液反应生成乙二酸11. 前20号主族元素W、X、Y、Z的原子序数依次增大,且都不在同一周期.X原子的最高能级中未成对电子数是成对电子对数的2倍,Y的第一电离能高于其在周期表内的相邻元素,Z元素的焰色为砖红色,R2+的一种配合物在人体内起运输氧气的作用。下列说法中正确的是( )A、高温条件下,W单质能置换Z的氧化物中的Z B、R在周期表的位置是第四周期VIIIB族 C、存在某种Y的氧化物的熔点高于Z的氧化物的熔点 D、X元素对应的单质一定是非极性分子12. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、60gSiO2中的Si-O共价键的数目为2NA B、1molI中心原子上的价层电子对数目为2NA C、1mol苯乙醛分子中含π键的数目为4NA D、25℃时,1L pH =12的氨水中含有OH-数目为0.01NA13. 关于紫草素(如图),下列说法正确的是( )
是同系物
B、HCOOCH3与CH3OCHO是同种物质
C、碳纳米管和石墨烯是同素异形体
D、异戊烷和2,2-二甲基丙烷是同分异构体
7. 工业制硅第二步反应为SiHCl3+H2Si+3HCl,下列说法错误的是( )A、SiHCl3中的Si呈+4价,分子空间结构为四面体形 B、该反应中SiHCl3既是氧化剂又是还原剂 C、该反应说明在该温度下氢气的还原性强于硅单质 D、当1 mol H2完全反应时,该反应转移2 mol电子8. 下列说法错误的是( )A、海水提溴过程中鼓入热空气的目的是除去多余的氯气 B、接触法制硫酸,用98.3%H2SO4吸收SO3 , 而不是用水吸收 C、将Cl2通入冷的石灰乳中,可制得有效成分为Ca(ClO)2的漂白粉 D、合成氨反应的原料气必须经过净化,目的是防止混有的杂质使催化剂“中毒”9. 下列离子方程式错误的是( )A、硫酸亚铁溶液与碳酸氢钠溶液混合并通入空气:4Fe2++8HCO+2H2O+O2=4Fe(OH)3↓+8CO2↑ B、向Ba(OH)2溶液中滴加少量NaHCO3溶液:Ba2++2OH-+2HCO=BaCO3↓+CO+2H2O C、氯化银沉淀溶于氨水:AgCl+2NH3=[Ag(NH3)2]++Cl- D、用硫酸铜溶液吸收H2S气体:Cu2++H2S=CuS↓+2H+10. 下列“类比”结果正确的是( )A、Cl2、Br2、I2的沸点逐渐升高,则H2、N2、O2的沸点也逐渐升高 B、CH3CHO与H2可发生加成反应,则相同条件下CH3COOH也可以与H2发生加成反应 C、向Na2CO3中加入少量水,伴随放热现象,则向NaHCO3中加入少量水,也伴随放热现象 D、乙醇与足量酸性高锰酸钾溶液反应生成乙酸,则乙二醇与足量酸性高锰酸钾溶液反应生成乙二酸11. 前20号主族元素W、X、Y、Z的原子序数依次增大,且都不在同一周期.X原子的最高能级中未成对电子数是成对电子对数的2倍,Y的第一电离能高于其在周期表内的相邻元素,Z元素的焰色为砖红色,R2+的一种配合物在人体内起运输氧气的作用。下列说法中正确的是( )A、高温条件下,W单质能置换Z的氧化物中的Z B、R在周期表的位置是第四周期VIIIB族 C、存在某种Y的氧化物的熔点高于Z的氧化物的熔点 D、X元素对应的单质一定是非极性分子12. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、60gSiO2中的Si-O共价键的数目为2NA B、1molI中心原子上的价层电子对数目为2NA C、1mol苯乙醛分子中含π键的数目为4NA D、25℃时,1L pH =12的氨水中含有OH-数目为0.01NA13. 关于紫草素(如图),下列说法正确的是( ) A、分子中最多有11个碳原子共平面 B、该物质能使酸性KMnO4溶液褪色,且产物之一为丙酮 C、1mol该物质与足量浓溴水反应,最多可消耗3molBr2 D、1mol该物质分别与足量Na、NaOH溶液和NaHCO3溶液反应,最多可消耗Na、NaOH、NaHCO3之比为3∶2∶214. 下列说法正确的是( )
A、分子中最多有11个碳原子共平面 B、该物质能使酸性KMnO4溶液褪色,且产物之一为丙酮 C、1mol该物质与足量浓溴水反应,最多可消耗3molBr2 D、1mol该物质分别与足量Na、NaOH溶液和NaHCO3溶液反应,最多可消耗Na、NaOH、NaHCO3之比为3∶2∶214. 下列说法正确的是( ) A、一种由M原子(顶角和面心)和N原子(棱的中心和体心)构成的气态团簇分子结构如图①所示,它的化学式为MN B、若图①为NaCl晶胞,则Na+周围紧邻的Na+数目是12个,Na+周围紧邻的Cl-数目是8个 C、H2S和H2O分子结构相似,但在H2S晶体中一个H2S分子的配位数为12,而冰中H2O的配位数为4,是因为共价键具有饱和性和方向性 D、磷化硼(BP)晶体结构(如图②)与金刚石相似,都是共价晶体,由晶胞结构可知B和P原子均满足8电子稳定结构15. 下列说法正确的是( )A、淀粉、纤维素、油脂都是天然高分子,都能水解生成葡萄糖 B、蛋白质受某些因素影响,其空间结构发生变化(一级结构不变),引起其理化和生物活性变化,此时蛋白质发生变性 C、在较高压力和温度,引发剂作用下乙烯发生加聚反应得到含有较少支链的聚乙烯 D、“杯酚”分离C60和C70 , 细胞和细胞器的双分子膜,分别体现了超分子的自组装和分子识别的特征16. 丙烯酸是非常重要的化工原料之一,可用甘油催化转化如下:甘油(C3H8O3)→丙烯醛(C3H4O)→丙烯酸(C3H4O2)。
A、一种由M原子(顶角和面心)和N原子(棱的中心和体心)构成的气态团簇分子结构如图①所示,它的化学式为MN B、若图①为NaCl晶胞,则Na+周围紧邻的Na+数目是12个,Na+周围紧邻的Cl-数目是8个 C、H2S和H2O分子结构相似,但在H2S晶体中一个H2S分子的配位数为12,而冰中H2O的配位数为4,是因为共价键具有饱和性和方向性 D、磷化硼(BP)晶体结构(如图②)与金刚石相似,都是共价晶体,由晶胞结构可知B和P原子均满足8电子稳定结构15. 下列说法正确的是( )A、淀粉、纤维素、油脂都是天然高分子,都能水解生成葡萄糖 B、蛋白质受某些因素影响,其空间结构发生变化(一级结构不变),引起其理化和生物活性变化,此时蛋白质发生变性 C、在较高压力和温度,引发剂作用下乙烯发生加聚反应得到含有较少支链的聚乙烯 D、“杯酚”分离C60和C70 , 细胞和细胞器的双分子膜,分别体现了超分子的自组装和分子识别的特征16. 丙烯酸是非常重要的化工原料之一,可用甘油催化转化如下:甘油(C3H8O3)→丙烯醛(C3H4O)→丙烯酸(C3H4O2)。已知:反应I:C3H8O3(g)C3H4O(g)+2H2O(g) △H1>0 Ea1(活化能)
反应II:2C3H4O(g)+O2(g)2C3H4O2(g) △H2<0 Ea2(活化能)
甘油常压沸点为290℃,工业生产选择反应温度为300℃常压下进行。下列说法错误的是( )
A、当H2O的体积分数保持不变,说明反应达到平衡状态 B、固体催化剂一定时,增加其表面积可提高化学反应速率,增大甘油的平衡转化率 C、丙烯醛有毒,为了工业生产安全可选择能大幅降低Ea2且对Ea1几乎无影响的催化剂 D、若改变条件增大反应II的平衡常数,反应II一定向正反应方向移动,且平衡移动过程中逆反应速率先减小后增加17. 下列说法一定正确的是( )A、将NaCl溶液从常温加热至80℃,溶液的pH<7,所以呈酸性 B、相同温度下,中和等pH的氨水、NaOH溶液,所需HCl的物质的量前者更多 C、相同温度下,pH相等的NaHSO4 , H3PO4溶液中,水电离的H+浓度相等 D、相同温度下,1L 0.02mol·L-1NaCl溶液和2L 0.01mol·L-1NaCN溶液的离子总数相等18. 下列说法正确的是( )A、NH3比PH3稳定,是因为NH3分子间可以形成氢键,而PH3分子间不能形成氢键 B、相同条件下,NH3(g)比PH3(g)易液化,主要原因是N-H键的极性比P-H键的极性强 C、P原子间难形成三键而N原子间可以,是因为P的原子半径大于N,难形成p-pπ键 D、NH3的键角比PH3的键角小,因为N、P中心原子杂化方式相同,都有一对孤对电子,N的电负性比P大,NH3中N周围电子云密度大,孤对电子对成键电子对斥力大19. 设计如图装置回收金属钴。保持细菌所在环境pH稳定,借助其降解乙酸盐生成CO2 , 将废旧锂离子电池的正极材料LiCoO2(s)转化为Co2+ , 工作时保持厌氧环境,并定时将乙室溶液转移至甲室。已知电极材料均为石墨材质,右侧装置为原电池。下列说法错误的是( ) A、装置工作时,甲室溶液pH逐渐减小 B、装置工作一段时间后,乙室应补充盐酸 C、负极的电极反应式为:CH3COO--8e-+7OH-=2CO2+5H2O D、若甲室Co2+减少amg,乙室Co2+增加1.5amg,则此时己进行过溶液转移20. 已知:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1。向3个恒容密闭容器中分别投入物质的量比为3:4的CO2和H2 , H2的物质的量浓度(mol·L-1)随时间(min)变化如表(T表示温度),下列说法正确的是( )
A、装置工作时,甲室溶液pH逐渐减小 B、装置工作一段时间后,乙室应补充盐酸 C、负极的电极反应式为:CH3COO--8e-+7OH-=2CO2+5H2O D、若甲室Co2+减少amg,乙室Co2+增加1.5amg,则此时己进行过溶液转移20. 已知:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1。向3个恒容密闭容器中分别投入物质的量比为3:4的CO2和H2 , H2的物质的量浓度(mol·L-1)随时间(min)变化如表(T表示温度),下列说法正确的是( )甲
乙
丙
体积L
2
4
4
温度K
T1
T2
T3
起始n(H2)/mol
8.0
8.0
20.0
 A、甲容器在0~8min内CO2的平均反应速率为0.125mol·L-1·min-1 , 且放出49kJ热量 B、甲容器第10min后,保持恒温,再充入1molCO2(g)和3molH2O(g),则v正<v逆 C、根据上述图表信息,可以推出T1>T2 D、对比甲组和丙组,在0~4min内,能说明H2的平均反应速率随温度升高而增大21. 关于化合物(NH4)2Cr2O7的性质,下列推测合理的是( )A、(NH4)2Cr2O7固体受热分解产物可能为CrO3、NH3、N2和H2O B、在(NH4)2Cr2O7溶液中滴加足量浓KOH溶液时只发生离子反应:NH+OH-=NH3↑+H2O C、若一定条件下(NH4)2Cr2O7溶液与H2O2反应生成CrO5(Cr为+6价),推测CrO5可能具有分子稳定性差,易分解的性质 D、用浓盐酸酸化(NH4)2Cr2O7溶液,会使平衡Cr2O+H2O2CrO+2H+逆向移动,溶液由黄色(或橙黄色)变为橙色22. 丙烷与卤素自由基发生的反应及其相应的反应焓变如下:
A、甲容器在0~8min内CO2的平均反应速率为0.125mol·L-1·min-1 , 且放出49kJ热量 B、甲容器第10min后,保持恒温,再充入1molCO2(g)和3molH2O(g),则v正<v逆 C、根据上述图表信息,可以推出T1>T2 D、对比甲组和丙组,在0~4min内,能说明H2的平均反应速率随温度升高而增大21. 关于化合物(NH4)2Cr2O7的性质,下列推测合理的是( )A、(NH4)2Cr2O7固体受热分解产物可能为CrO3、NH3、N2和H2O B、在(NH4)2Cr2O7溶液中滴加足量浓KOH溶液时只发生离子反应:NH+OH-=NH3↑+H2O C、若一定条件下(NH4)2Cr2O7溶液与H2O2反应生成CrO5(Cr为+6价),推测CrO5可能具有分子稳定性差,易分解的性质 D、用浓盐酸酸化(NH4)2Cr2O7溶液,会使平衡Cr2O+H2O2CrO+2H+逆向移动,溶液由黄色(或橙黄色)变为橙色22. 丙烷与卤素自由基发生的反应及其相应的反应焓变如下:CH3CH2CH3(g)+Cl•(g)→CH3HCH3(g)+HCl(g) △H1=-34kJ·mol-1(1)
CH3CH2CH3(g)+Cl•(g)→CH3CH2H2(g)+HCl(g) △H2=-22kJ·mol-1(2)
CH3CH2CH3(g)+Br•(g)→CH3CH2H2(g)+HBr(g) △H2=+44kJ·mol-1(3)
下列说法错误的是( )
A、CH3HCH3比CH3CH2H2稳定 B、当温度升高,反应(1)和(2)的v正均升高,反应(3)的v正降低 C、丙烷和Cl2在光照下发生取代反应生成的二氯丙烷最多有4种 D、已知Cl-Cl的键能为243kJ·mol-1 , C-Cl的键能为327kJ·mol-1 , 则CH3CH2CH3(g)+Cl2(g)→CH3CHClCH3(g)+HCl(g) △H=-118kJ·mol-123. 25℃时,以NaOH溶液调节0.1mol·L-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示[已知δ(X)]。下列说法错误的是( ) A、二元弱酸H2A的pKa1=1.2(已知:pKa=-lgKa) B、20.0mL0.1mol·L-1的H2A溶液与30.0mL0.1mol·L-1NaOH溶液混合,混合液的pH=4.2 C、往H2A溶液中滴加NaOH溶液的过程中,一定存在:c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-) D、在0.1mol·L-1NaHA溶液中,各离子浓度大小关系:c(Na+)>c(HA-)>c(A2-)>c(OH-)24. 某催化剂催化烯烃醛基化的过程如图。下列说法错误的是( )
A、二元弱酸H2A的pKa1=1.2(已知:pKa=-lgKa) B、20.0mL0.1mol·L-1的H2A溶液与30.0mL0.1mol·L-1NaOH溶液混合,混合液的pH=4.2 C、往H2A溶液中滴加NaOH溶液的过程中,一定存在:c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-) D、在0.1mol·L-1NaHA溶液中,各离子浓度大小关系:c(Na+)>c(HA-)>c(A2-)>c(OH-)24. 某催化剂催化烯烃醛基化的过程如图。下列说法错误的是( ) A、配合物HCo(CO)3的配体CO中提供孤对电子的是C原子 B、烯制备醛的总反应:RCH=CH2+H2+CO RCH2CH2CHO C、如图循环转化过程中既存在π、σ及配位键的断裂,也存在π、σ及配位键的形成 D、可以用溴的四氯化碳溶液鉴别制得的产物RCH2CH2CHO中是否含有未完全转化RCH=CH225. 下列方案设计、现象和结论均正确的是( )
A、配合物HCo(CO)3的配体CO中提供孤对电子的是C原子 B、烯制备醛的总反应:RCH=CH2+H2+CO RCH2CH2CHO C、如图循环转化过程中既存在π、σ及配位键的断裂,也存在π、σ及配位键的形成 D、可以用溴的四氯化碳溶液鉴别制得的产物RCH2CH2CHO中是否含有未完全转化RCH=CH225. 下列方案设计、现象和结论均正确的是( )目的
方案设计
现象和结论
A
比较温度对反应速率的影响
取相同大小两支试管,各加2mL0.1mol/LNa2S2O3溶液,再同时加入浓度、体积相等稀硫酸,然后分别置于冷水、热水中,观察现象
置于热水中试管比冷水中先出现沉淀.说明在其它条件相同情况下,升高温度能加快反应速率
B
验证卤代烃的消去反应
在圆底烧瓶中加入适量NaOH乙醇溶液、1-溴丁烷和几片碎瓷片,加热.将产生气体通入酸性高锰酸钾溶液,观察现象
酸性高锰酸钾溶液褪色.证明1-溴丁烷发生消去反应生成了1-丁烯
C
确定Mg、Al元素的金属性强弱
分别将相同浓度的NaOH溶液逐滴加入一定浓度的MgCl2、AlCl3溶液中,直至过量,观察现象
两者均出现白色沉淀:然后AlCl3溶液中沉淀逐渐溶解,MgCl2溶液中沉淀不溶.说明Mg比Al金属性强
D
检验阿司匹林中的酯基(
 )
)取2mL阿司匹林溶液,滴入2滴硫酸,加热,振荡。再向反应液中滴入几滴FeCl3溶液,观察颜色变化
滴入FeCl3溶液,反应液变为血红色。证明阿司匹林分子中含有酯基
A、A B、B C、C D、D二、综合题
-
26. 蛋氨酸铬(III)配合物是一种治疗II型糖尿病的药物,其结构简式如图1,请回答:
 (1)、基态Cr原子的价电子排布图为;铬元素属于周期表的区。(2)、该配合物中心铬离子的配位数为;碳原子的杂化轨道类型有。(3)、某种铬单质可看做由若干个等径圆球堆积而成,其晶体俯视图如图2所示(层内铬原子非密置,相邻两层相互错开堆积)。
(1)、基态Cr原子的价电子排布图为;铬元素属于周期表的区。(2)、该配合物中心铬离子的配位数为;碳原子的杂化轨道类型有。(3)、某种铬单质可看做由若干个等径圆球堆积而成,其晶体俯视图如图2所示(层内铬原子非密置,相邻两层相互错开堆积)。
①请在图3中画出该铬单质的晶胞示意图(用
 表示铬)。
表示铬)。②该立方晶胞的边长为apm,设阿伏加德罗常数的值为NA , 则该晶体密度为g•cm-3。
27. M为三种短周期元素组成的化合物,某实验小组按如图流程进行相关实验:
已知:气体A是由两种常见单质组成的混合物,一种为无色气体,另一种为黄绿色气体。
(1)、组成M的三种元素(填元素符号);M分解的化学方程式。(2)、气体A中黄绿色成分与硫单质反应,生成结构与H2O2相似的产物G,G的电子式 , G遇水反应生成沉淀、气体,写出反应的化学方程式。(3)、写出E→F的离子方程式。(4)、设计实验证明B→C过程中,加入的BaCl2溶液已经过量。28. 氢气是一种理想的能源,探索绿色化制氢是化学界一个热门话题。(本题反应中涉及△H、△S、△G均为298K条件值)。(1)、传统制备氢气方法之一为水煤气法:C(s)+H2O(g)=CO(g)+H2(g) △H=+132kJ·mol-1 , 该反应自发进行的条件是。(2)、利用生物质可再生资源乙醇制备氢气具有良好的开发前景。乙醇在Ni-MgO催化下,制取氢气有如下方法:方法a:水蒸气催化重整CH3CH2OH(g)+H2O(g)4H2(g)+2CO(g) △H1=+257kJ·mol-1△S1=+459J·mol-1·K-1△G1=+122.9kJ·mol-1
方法b:部分催化重整CH3CH2OH(g)+O2(g)3H2(g)+2CO(g) △H2△S2=+400J·mol-1·K-1△G2
已知:298K时,相关物质的相对能量如图1。

①依据图1数据,计算方法b反应的△H2=kJ·mol-1。
②已知体系自由能变化:△G=△H-T△S,△G<0时反应自发进行。请从△G的角度分析方法a、b哪个更有利?。
③在某恒温和恒压(p0)体系中,CH3CH2OH和H2O以系数比投料进行方法a制氢,若平衡时H2的产率为50%,该条件下方法a反应的平衡常数Kp=。[如H2的平衡压强p(H2)= χ(H2)×p,χ(H2)为平衡系统中H2的物质的量分数,p为平衡时总压]
(3)、有化学工作者提出,在Ni-MgO催化剂中添加纳米CaO强化,开展“催化氧化重整”制氢,是一种优化的制氢方法。方法c:CH3CH2OH(g)+2H2O(g)+O2(g)5H2(g)+2CO2(g) △H=-67kJ·mol-1
①下列有关说法正确的是。
A.方法c制氢时,充分提高廉价原料O2的浓度,一定能增加氢气产率
B.方法c与a比,相同条件下方法c能耗更低,制氢速率更快
C.乙醇制氢的三种方法中原子利用率(期望产物的总质量与生成物总质量之比)大小关系为:c>a>b
D.方法c相当于方法b与水煤气变换CO(g)+H2O(g)CO2(g)+H2(g)的优化组合水醇比对乙醇平衡转化率有较大影响
②已知:常压、800K,反应在Ni-MgO催化下,测得乙醇平衡转化率与水醇比关系如图。请在图2中画出相同条件下,添加纳米CaO强化下的乙醇平衡转化率曲线。
 29. 某研究小组用印刷电路板的腐蚀废液(主要含CuCl2、FeCl2、FeCl3)制备Cu(NH4)2SO4•H2O和FeCl2•4H2O。
29. 某研究小组用印刷电路板的腐蚀废液(主要含CuCl2、FeCl2、FeCl3)制备Cu(NH4)2SO4•H2O和FeCl2•4H2O。I.制备流程图
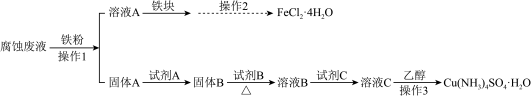
已知1.所加试剂均足量,且部分步骤有省略。
II.Cu(NH4)2SO4•H2O晶体纯度测定
①取a g Cu(NH4)2SO4•H2O晶体,加入适量1 mol·L-1稀硫酸,加热,待溶液冷却后配制成250 mL溶液。
②取25.00 mL溶液,加水50 mL,调节溶液至弱酸性(pH=3~4),加入过量20%KI溶液,避光静置几分钟。
③用c mol·L-1Na2S2O3标准溶液滴定至溶液呈淡黄色,再加入淀粉溶液,继续滴定至溶液变浅蓝色,再加入一定量10%KSCN溶液,蓝色变深,继续滴定至蓝色刚好消失,记录消耗Na2S2O3标准溶液的体积。
④平行滴定三次,消耗Na2S2O3标准溶液的平均体积为V mL。
已知2:①2Cu2++4I-=2CuI↓+I2;I2+2=+2I-。
②CuI和CuSCN均为白色固体;Ksp(CuI)=1.1×10-12 , Ksp(CuSCN)=4.8×10-15。
请回答:
(1)、下列说法正确的是____。A、操作2通过蒸发至出现晶膜后趁热过滤,快速冷却滤液结晶,可得较大FeCl2•4H2O晶体 B、可用KSCN或K3[Fe(CN)6]溶液检验FeCl2•4H2O晶体中是否存在杂质Fe3+ C、溶液C中加入乙醇可以降低Cu(NH4)2SO4•H2O在溶剂中的溶解性,促进晶体析出 D、溶液B中逐滴滴加试剂C至过量的过程中先出现蓝色沉淀后变为深蓝色溶液,这一现象可以说明与Cu2+结合能力大小为:NH3>OH->H2O(2)、测定晶体纯度时,步骤②用KI溶液测定铜含量时,需在弱酸性(pH=3~4)溶液中进行的原因。(3)、下列关于滴定分析的描述,正确的是____。A、加入过量20%KI溶液可以增大I2的溶解性,减少实验滴定误差 B、Na2S2O3标准溶液应盛放在碱式滴定管中 C、滴定时,眼睛应一直观察滴定管中溶液体积的变化 D、若滴定恰好完全时,滴定管尖端悬半滴未滴下,会导致测定结果偏低(4)、结合离子反应方程式并用必要的文字说明滴定过程中加入KSCN溶液的作用。(5)、Cu(NH4)2SO4•H2O(M=246 g•mol-1)晶体样品的纯度为%(用含a、c、V的代数式表示)。30. 某研究小组按下列路线合成药物莫扎伐普坦。
已知:
 甲磺酰基;Et3N:三乙胺。
甲磺酰基;Et3N:三乙胺。请回答:
(1)、下列说法错误的是____。A、A的分子式为C11H10NO3S B、A中引入甲磺酰基的作用是保护氨基 C、B→C为还原反应,产物C中有1个手性碳原子 D、H在足量NaOH溶液中反应生成2种钠盐,在足量盐酸中反应生成2种铵盐(2)、A→B过程涉及两步反应,其反应类型依次为;化合物D的结构简式。(3)、写出F→G的化学反应方程式。(4)、写出同时符合下列条件的E的所有同分异构体的结构简式。①分子中含2个6元环,一个为苯环,另一个为六元含氮杂环:
②1H-NMR谱显示分子有4种不同化学环境的氢原子,且比例为6:1:1:1
(5)、设计以甲醛和甲苯为原料合成有机物 的合成路线(用流程图表示,无机试剂任选)。
的合成路线(用流程图表示,无机试剂任选)。