山东省泰安市2022-2023学年高三上学期开学考试化学试题
试卷更新日期:2022-09-26 类型:开学考试
一、单选题
-
1. 北宋名画《千里江山图》流传千年依旧色彩艳丽璀璨,其中大量使用了石青[主要成分Cu3(CO3)2(OH)2]、石绿[主要成分Cu2(CO3)(OH)2]、赭石[主要成分Fe2O3]、朱砂[主要成分HgS]等颜料。下列叙述错误的是( )A、石青、石绿中“Cu(OH)2”比例不同其颜色不同 B、朱砂燃烧会产生刺激性气味的气体 C、赭石主要成分具有磁性 D、上述颜料中的金属元素均属于过渡元素2. 下列物质的性质或用途的叙述错误的是( )A、盐酸可用于除去水垢中的CaSO4 B、“84”消毒液消毒原理是利用了NaClO的强氧化性 C、Fe2O3常用作油漆、涂料、油墨的红色颜料 D、过氧化钠可用作呼吸面具中的供氧剂3. 现有处于不同主族的短周期元素A、B、C、D、E,其中B原子最外层电子数是电子层数的2倍,C是金属元素,0.1 mol·L-1的D的最高价氧化物的水化物溶液pH<1,五种元素的原子半径与原子序数的关系如图所示。下列推断错误的是( )
 A、原子半径和离子半径均满足:E<C B、由C,E两种元素组成的化合物的水溶液能促进水的电离 C、最高价氧化物对应的水化物的酸性:B<D<E D、B与D形成的化合物BD2中原子的最外层都满足8电子稳定结构4. 苹果酸因其首先从苹果汁中分离出来而得名。它具有促进脑组织能量代谢,改善学习、记忆的作用。其结构如图所示:
A、原子半径和离子半径均满足:E<C B、由C,E两种元素组成的化合物的水溶液能促进水的电离 C、最高价氧化物对应的水化物的酸性:B<D<E D、B与D形成的化合物BD2中原子的最外层都满足8电子稳定结构4. 苹果酸因其首先从苹果汁中分离出来而得名。它具有促进脑组织能量代谢,改善学习、记忆的作用。其结构如图所示: 。下列有关苹果酸的叙述正确的是( ) A、既是乙醇的同系物也是乙二酸的同系物 B、能发生取代反应,不能发生酯化反应 C、
。下列有关苹果酸的叙述正确的是( ) A、既是乙醇的同系物也是乙二酸的同系物 B、能发生取代反应,不能发生酯化反应 C、 + H218O CH3CO18OH +
+ H218O CH3CO18OH + D、相同质量的苹果酸分别与足量钠和碳酸氢钠反应时,放出H2和CO2的物质的量之比为1∶2
5. 氢氟酸可用于雕刻玻璃,其反应原理为4HF+SiO2=SiF4↑+2H2O。下列有关说法正确的是( )A、HF中的共价键为s-pσ键 B、H2O、SiF4均为极性分子 C、SiO2晶体为分子晶体 D、基态氧原子的价层电子轨道表示式为
D、相同质量的苹果酸分别与足量钠和碳酸氢钠反应时,放出H2和CO2的物质的量之比为1∶2
5. 氢氟酸可用于雕刻玻璃,其反应原理为4HF+SiO2=SiF4↑+2H2O。下列有关说法正确的是( )A、HF中的共价键为s-pσ键 B、H2O、SiF4均为极性分子 C、SiO2晶体为分子晶体 D、基态氧原子的价层电子轨道表示式为 6. 玻璃棒是化学实验中常用的仪器之一,其主要用于搅拌、过滤或转移液体时的引流。下列有关实验过程中,肯定不需要使用玻璃棒进行操作的是( )
6. 玻璃棒是化学实验中常用的仪器之一,其主要用于搅拌、过滤或转移液体时的引流。下列有关实验过程中,肯定不需要使用玻璃棒进行操作的是( )①用pH试纸测定Na2CO3溶液的pH
②从氯酸钾和二氧化锰制取氧气的剩余固体中提取KCl
③用饱和FeCl3溶液和沸水制取Fe(OH)3胶体
④配制一定物质的量浓度的氯化钠溶液
⑤取某溶液做焰色试验,检验该溶液中是否含有钠元素
⑥用适量的蔗糖、浓硫酸和水在小烧杯中进行浓硫酸的脱水性实验
⑦促使过饱和的硝酸钾溶液析出晶体
A、①②④⑤ B、③④⑤⑦ C、③⑤ D、⑤⑥⑦7. 弥罗松酚衍生物A具有广谱抗菌活性,其结构如图(键线式中“ ”代表伸向纸面外的单键,“
”代表伸向纸面外的单键,“ ”代表伸向纸面里的单键),下列有关弥罗松酚衍生物A的说法错误的是( )
”代表伸向纸面里的单键),下列有关弥罗松酚衍生物A的说法错误的是( ) A、化学式为 B、能与加成形成羟基腈类化合物 C、能与发生反应 D、弥罗松酚衍生物A与溴水反应,最多可消耗8. 下列实验装置设计不能达到实验目的的是( )
A、化学式为 B、能与加成形成羟基腈类化合物 C、能与发生反应 D、弥罗松酚衍生物A与溴水反应,最多可消耗8. 下列实验装置设计不能达到实验目的的是( )选项
A
B
C
D
实验目的
吸收过量的氨气,防止氨气泄漏到空气中
除去氢气中的少量杂质二氧化硫
提供水蒸气
分离乙醇和苯甲酸乙酯
装置或仪器



 A、A B、B C、C D、D9. 废旧太阳能电池具有较高的回收利用价值,其主要组成为。某探究小组回收处理流程如图:
A、A B、B C、C D、D9. 废旧太阳能电池具有较高的回收利用价值,其主要组成为。某探究小组回收处理流程如图:
已知:是易水解的液体。下列说法错误的是( )
A、是ⅢA族元素,中的化合价为价 B、“调过滤”阶段铜元素以氢氧化铜形式进入滤渣 C、“高温气相沉积”过程中发生反应的化学方程式为 D、“回流过滤”中的作用是将氢氧化物转化为氯化物和作溶剂10. 某种制备H2O2的反应机理如图。下列说法正确的是( ) A、总反应可表示为H2+O2=H2O2 B、该过程中Pd的化合价有0和+4两种 C、①、②、③均为氧化还原反应 D、HCl和Cl-可循环利用11. 如图a、b、c表示相应仪器中加入加入试剂,可用图中装置制取、净化、收集气体的是( )
A、总反应可表示为H2+O2=H2O2 B、该过程中Pd的化合价有0和+4两种 C、①、②、③均为氧化还原反应 D、HCl和Cl-可循环利用11. 如图a、b、c表示相应仪器中加入加入试剂,可用图中装置制取、净化、收集气体的是( )
编号
气体
a
b
c
A
NH3
浓氨水
固体氢氧化钠
浓硫酸
B
CO2
盐酸
碳酸钙
饱和NaHCO3溶液
C
Cl2
浓盐酸
二氧化锰
饱和NaCl溶液
D
NO2
浓硝酸
铜屑
NaOH溶液
A、A B、B C、C D、D12. 废易拉罐(含有Al和少量Fe、Mg杂质)制备明矾,分析流程,正确的是( ) A、为尽量少引入杂质,NaOH溶液应改用KOH或氨水 B、“沉淀”为Al2(CO3)3 C、上述流程中可用过量CO2代替NH4HCO3 D、滤渣的主要成分是Fe(OH)3和Mg(OH)2
A、为尽量少引入杂质,NaOH溶液应改用KOH或氨水 B、“沉淀”为Al2(CO3)3 C、上述流程中可用过量CO2代替NH4HCO3 D、滤渣的主要成分是Fe(OH)3和Mg(OH)2二、多选题
-
13. 改造的噬菌体病毒可用于制造自主装多嵌入点位新型高能电池(见图),下列有关说法正确的是( )
 A、该电池工作效率随温度升高而增强 B、碳纳米管互相搭接构成网状结构能够增强a极区的导电能力 C、放电时a极发生的电极反应为FePO4+M++e-=MFePO4 D、充电时,在新型电解液中,电子的移动方向为b→a14. 某FexNy的晶胞如图1所示,晶胞边长为apm,Cu可以完全替代该晶体中a位置Fe或b位置Fe,形成Cu替代型产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如图2所示,下列说法中正确的是( )
A、该电池工作效率随温度升高而增强 B、碳纳米管互相搭接构成网状结构能够增强a极区的导电能力 C、放电时a极发生的电极反应为FePO4+M++e-=MFePO4 D、充电时,在新型电解液中,电子的移动方向为b→a14. 某FexNy的晶胞如图1所示,晶胞边长为apm,Cu可以完全替代该晶体中a位置Fe或b位置Fe,形成Cu替代型产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如图2所示,下列说法中正确的是( ) A、该FexNy的化学式为Fe2N B、与N等距且最近的N为6个 C、两个a位置Fe的最近距离为apm D、其中较稳定的Cu替代型产物的化学式为FeCu3N15. 室温下,向1.0L0.100mol•L-1NH4HCO3溶液中加入NaOH稀溶液,溶液中主要微粒的分布系数【如A2-的分布系数δ(A2-)=】以及pH随n(NaOH)变化如图。
A、该FexNy的化学式为Fe2N B、与N等距且最近的N为6个 C、两个a位置Fe的最近距离为apm D、其中较稳定的Cu替代型产物的化学式为FeCu3N15. 室温下,向1.0L0.100mol•L-1NH4HCO3溶液中加入NaOH稀溶液,溶液中主要微粒的分布系数【如A2-的分布系数δ(A2-)=】以及pH随n(NaOH)变化如图。
下列叙述正确的是( )
A、0.100mol•L-1NH4HCO3溶液中>1,水电离受到促进 B、加入少量NaOH时,OH-先与HCO发生主要反应 C、Ka2(H2CO3)•Kb(NH3•H2O)>Kw D、加入NaOH稀溶液过程中,溶液满足关系式c(NH)+c(NH3•H2O)=c(CO)+c(HCO)+c(H2CO3)三、综合题
-
16. 氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:(1)、基态N原子中电子占据最高能级的电子云轮廓图为形,基态N原子的轨道表示式为。(2)、B的第一电离能I1(B)=800kJ·mol−1 , 判断I1(Al)800kJ·mol−1(填“>”或“<”),从电子排布的角度说明判断理由。(3)、NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-)。在H、B、N三种元素中:
①电负性由大到小的顺序是。
②原子半径由大到小的顺序是。
③在元素周期表中的分区与其他两种不同的是。
(4)、26Fe、27Co、28Ni、29Cu是目前氨硼烷水解产氢催化剂研究的热点。不同催化剂催化氨硼烷水解产氢的性能如图所示。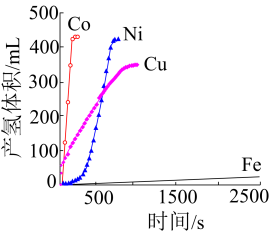
这四种催化剂中:
①催化效果最好的金属基态原子中未成对的电子数为。
②催化效果最差的金属基态原子的价层电子排布式为。
17. 稀土在电子、激光、核工业、超导等诸多高科技领域有广泛的应用。铳(Sc)是一种稀土金属,利用钛尾矿回收金属钪和草酸的工艺流程如图所示。回答下列问题:
已知:①xNH4Cl·yScF3·zH2O是“沉钪”过程中ScF3与氯化物形成的复盐沉淀,在强酸中部分溶解。
②“脱水除铵”是复盐沉淀的热分解过程。
③25℃时,部分物质的相关信息如表所示:
Ksp(PbSO4)
Ksp(PbC2O4)
Ka1(H2C2O4)
Ka2(H2C2O4)
2.0×10-8
5.0×10-10
6.0×10-2
6.25×10-5
(1)、“焙烧”过程生成Sc2O3的化学方程式为。(2)、“脱水除铵”过程中固体质量与温度的关系如图所示,其中在380-400℃过程中会有白烟冒出,保温至无烟气产生,即得到ScF3 , 由图中数据可得x:z=。 (3)、传统制备ScF3的方法是先得到ScF3·6H2O沉淀,再高温脱水得ScF3 , 但通常含有ScOF杂质,原因是。(用化学方程式表示)。流程中“沉钪”后“脱水除铵”可制得纯度很高的ScF3 , 其原因是。(4)、将1.8molPbSO4加到1L含有0.12mol/LH2C2O4的废水中。发生的离子反应为:PbSO4(s)+H2C2O4(aq)PbC2O4(s)+2H+(aq)+SO(aq),该反应的平衡常数的值K=。滤饼经浓硫酸处理后的“沉淀”是(化学式)。18. 二氯异氰尿酸钠[(CNO)3Cl2Na]是常用的杀菌消毒剂,常温下为白色固体,难溶于冷水。利用高浓度的NaClO溶液和异氰尿酸[(CNO) 3H3]固体制备二氯异氰尿酸钠,实验装置如下图所示(部分夹持装置略)。
(3)、传统制备ScF3的方法是先得到ScF3·6H2O沉淀,再高温脱水得ScF3 , 但通常含有ScOF杂质,原因是。(用化学方程式表示)。流程中“沉钪”后“脱水除铵”可制得纯度很高的ScF3 , 其原因是。(4)、将1.8molPbSO4加到1L含有0.12mol/LH2C2O4的废水中。发生的离子反应为:PbSO4(s)+H2C2O4(aq)PbC2O4(s)+2H+(aq)+SO(aq),该反应的平衡常数的值K=。滤饼经浓硫酸处理后的“沉淀”是(化学式)。18. 二氯异氰尿酸钠[(CNO)3Cl2Na]是常用的杀菌消毒剂,常温下为白色固体,难溶于冷水。利用高浓度的NaClO溶液和异氰尿酸[(CNO) 3H3]固体制备二氯异氰尿酸钠,实验装置如下图所示(部分夹持装置略)。
已知:①3Cl2+6NaOH5NaCl+NaClO3+3H2O
②2NaClO+(CNO)3H3=(CNO) 3Cl2Na+NaOH+H2O
回答下列问题:
(1)、装置A中发生反应的离子方程式为。(2)、装置B中盛放的试剂为 , 若撤去该装置,对C中制备实验产生的影响是。(3)、三颈烧瓶液面上出现黄绿色气体时,由上口加入(CNO) 3H3固体,反应过程中仍需不断通入Cl2 , 原因是。(4)、装置C中冰水浴的目的是 。(5)、通过下列实验可测定二氯异氰尿酸钠样品中有效氯的含量(样品中不含NaClO):反应原理:
[(CNO)3Cl2]-+H++2H2O=(CNO)3H3+2HClO
HClO+2I-+H+=I2+Cl-+H2O
I2+2S2O=S4O+2I-
实验步骤:准确称取wg样品配成100mL溶液,取25.00mL于碘量瓶中,加入适量稀硫酸和过量KI溶液,暗处静置充分反应后,用0.1000 mol·L-1Na2S2O3标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗Na2S2O3溶液VmL。
①滴定终点的现象是。
②该样品中有效氯含量的表达式为。(有效氯=100%)。
③若滴定前滴定管尖嘴有气泡,滴定后气泡消失,则有效氯的测定值将(填“偏高”、“偏低”或“无影响”)。
19. 化合物G是用于治疗面部疱疹药品泛昔洛韦的合成中间体,其合成路线如下:
回答下列问题:
(1)、A的名称为 , D→E的反应类型为。(2)、D中官能团的名称为。(3)、B→C的反应方程式为。(4)、F的结构简式为。(5)、C有多种同分异构体,同时满足下列条件的同分异构体有种;①分子中含有苯环。②分子中含有2个-CH2OH。
写出其中一种核磁共振氢谱中峰面积之比为4:3:2:2:1的结构简式。
(6)、参照上述合成路线,设计以苯甲醇和 为原料(无机试剂任选)制备
为原料(无机试剂任选)制备 的路线。 20. 水煤气变换反应可用于大规模制 , 反应原理如下:。(1)、生产中,欲既提高CO的转化率,又提高反应速率,可采取的一项措施是;(2)、实验发现其他条件不变,在体系中投入一定量可以增大的体积分数,从化学平衡的角度解释原因:;(3)、在其他条件相同时,将两种等质量不同粒径的 (纳米级和微米级)投入体系中,体积分数随时间变化如图所示,其中表示纳米级对体积分数产生影响的曲线是(填“a”或“b”),判断理由是。
的路线。 20. 水煤气变换反应可用于大规模制 , 反应原理如下:。(1)、生产中,欲既提高CO的转化率,又提高反应速率,可采取的一项措施是;(2)、实验发现其他条件不变,在体系中投入一定量可以增大的体积分数,从化学平衡的角度解释原因:;(3)、在其他条件相同时,将两种等质量不同粒径的 (纳米级和微米级)投入体系中,体积分数随时间变化如图所示,其中表示纳米级对体积分数产生影响的曲线是(填“a”或“b”),判断理由是。 (4)、水煤气变换反应的机理被广泛研究,其中有一种为甲酸基机理,步骤如下:
(4)、水煤气变换反应的机理被广泛研究,其中有一种为甲酸基机理,步骤如下:①
②
③
④
其中控速步骤为(填方程式代号),用合适的微粒符号补全反应②;
(5)、将加热至 , 部分发生分解,达到平衡时。 , 在一真空密闭容器中加入过量的 , 再充入一定量的 , 加入催化剂使其发生反应:(忽略其他副反应),测得该反应中物质分压如图所示(t时刻前,的分压未给出):
①A点坐标为(t,);
②的平衡转化率为。
③反应的平衡常数。