江苏省扬州市宝应县2022-2023学年高三上学期开学检测化学试题
试卷更新日期:2022-09-26 类型:开学考试
一、单选题
-
1. 北京冬奥会备受世界瞩目。下列说法错误的是( )A、火炬“飞扬”使用的碳纤维属于有机高分子材料 B、冰壶主材料花岗岩属于无机非金属材料 C、冬奥会“同心”金属奖牌属于合金材料 D、运动员餐饮“碗具”选用可降解聚乳酸材料减少对环境污染,该材料属于混合物2. 配合物可用于蚀刻铜,蚀刻后的产物可在氧气中再生,再生反应为。下列说法正确的是( )A、基态Cu的电子排布式为 B、属于共价化合物 C、的空间构型为三角锥形 D、中含键3. 下列氯及其化合物的性质与用途具有对应关系的是( )A、具有氧化性,可用于水体消毒 B、具有酸性,可用于蚀刻线路板上的铜 C、具有还原性,可用于除去铁锈 D、受热易分解,可用作氮肥4. 已知锰酸钾(K2MnO4)在浓的强碱溶液中可稳定存在,碱性减弱时易发生反应:3MnO+2H2O=2MnO+MnO2↓+4OH-。下列用Cl2氧化K2MnO4制备KMnO4的实验原理和装置不能达到实验目的的是( )
 A、用装置甲制取Cl2 B、用装置乙除去 Cl2中的HCl C、用装置丙使K2MnO4转化成KMnO4 D、用装置丁分离出溶液中的MnO25. 实验室用基准配制标准溶液并标定盐酸浓度,应选甲基橙为指示剂,并以盐酸滴定标准溶液。下列说法错误的是( )A、可用移液管取标准溶液置于锥形瓶中 B、应选用配带塑料塞的容量瓶配制标准溶液 C、应选用烧杯而非称量纸称量固体 D、达到滴定终点时溶液显红色,记录体积后重复以上操作2~3次6. 液氨可以微弱的电离产生和 , NH3中的一个H原子若被-NH2取代可形成N2H4(联氨),若被-OH取代可形成NH2OH (羟胺)。NH3经过一定的转化可以形成N2、NO、NO2、N2O4(无色)、HNO3等。下列有关NH3、NH2OH、、的说法正确的是( )A、NH3的键角比中的大 B、NH2OH难溶于水 C、的空间构型为直线形 D、含的溶液都具有强氧化性7. 在指定条件下,下列选项所示的物质间转化可以实现的是( )A、 B、 C、 D、8. 对于反应(无色),下列说法正确的是( )A、该反应即是化合反应,也是氧化还原反应 B、该反应的平衡常数表达式为 C、将反应器容积压缩为原来的一半,气体颜色比压缩前深 D、只改变一个条件,减压或升温平衡均逆向移动,平衡常数均减小9. 为检验某久置过氧化钠样品的成分,学习小组依次进行了有关实验。实验中涉及反应的离子方程式正确的是( )A、将过氧化钠样品完全溶于水,产生气泡: B、向溶液中滴加BaCl2溶液,产生白色沉淀: C、向沉淀中滴加稀醋酸,产生气体: D、将气体通入足量澄清石灰水,出现浑浊现象:10. 室温下,下列实验探究方案及现象能达到探究目的的是( )
A、用装置甲制取Cl2 B、用装置乙除去 Cl2中的HCl C、用装置丙使K2MnO4转化成KMnO4 D、用装置丁分离出溶液中的MnO25. 实验室用基准配制标准溶液并标定盐酸浓度,应选甲基橙为指示剂,并以盐酸滴定标准溶液。下列说法错误的是( )A、可用移液管取标准溶液置于锥形瓶中 B、应选用配带塑料塞的容量瓶配制标准溶液 C、应选用烧杯而非称量纸称量固体 D、达到滴定终点时溶液显红色,记录体积后重复以上操作2~3次6. 液氨可以微弱的电离产生和 , NH3中的一个H原子若被-NH2取代可形成N2H4(联氨),若被-OH取代可形成NH2OH (羟胺)。NH3经过一定的转化可以形成N2、NO、NO2、N2O4(无色)、HNO3等。下列有关NH3、NH2OH、、的说法正确的是( )A、NH3的键角比中的大 B、NH2OH难溶于水 C、的空间构型为直线形 D、含的溶液都具有强氧化性7. 在指定条件下,下列选项所示的物质间转化可以实现的是( )A、 B、 C、 D、8. 对于反应(无色),下列说法正确的是( )A、该反应即是化合反应,也是氧化还原反应 B、该反应的平衡常数表达式为 C、将反应器容积压缩为原来的一半,气体颜色比压缩前深 D、只改变一个条件,减压或升温平衡均逆向移动,平衡常数均减小9. 为检验某久置过氧化钠样品的成分,学习小组依次进行了有关实验。实验中涉及反应的离子方程式正确的是( )A、将过氧化钠样品完全溶于水,产生气泡: B、向溶液中滴加BaCl2溶液,产生白色沉淀: C、向沉淀中滴加稀醋酸,产生气体: D、将气体通入足量澄清石灰水,出现浑浊现象:10. 室温下,下列实验探究方案及现象能达到探究目的的是( )选项
探究方案及现象
探究目的
A
用pH计测量醋酸、盐酸的pH,比较溶液pH大小
醋酸是弱电解质
B
向久置的溶液中加入足量溶液,出现白色沉淀;再加入足量稀盐酸,部分沉淀溶解
不能被空气氧化
C
向NaBr溶液中滴加过量氯水,溶液变橙色,再加入淀粉KI溶液,溶液变蓝色
氧化性:
D
向盛有溶液的试管中滴加几滴KSCN溶液,振荡,再滴加几滴新制氯水,观察溶液颜色变化
具有还原性
A、A B、B C、C D、D11. 实验室用、制备硫酸亚铁铵[],和硫代乙酰胺[CH3CSNH2]反应制取纳米硫化亚铁(FeS),反应流程如下:
下列有关说法错误的是( )
A、n、m的等量关系式是 B、若分别用和与铁粉反应制取等质量的FeS,理论上消耗和的质量比为3∶4 C、pH=9时“反应2”发生: D、该方法得到的产品中常混有少量杂质,添加少量柠檬酸钠可抑制杂质的形成,原因可能是柠檬酸钠与形成配合物,降低了溶液中的浓度12. 化合物(YW4X5Z8·4W2Z)可用于电讯器材、高级玻璃的制造。W、X、Y、Z为短周期元素,原子序数依次增加,4种元素的原子序数之和为21,YZ2分子的总电子数为奇数,常温下为气体。该化合物的热重曲线如图所示,在200℃以下热分解时无刺激性气体逸出。下列叙述错误的是( ) A、W、Y、Z的单质常温下均为气体 B、最高价氧化物的水化物酸性:X<Y C、100~200℃阶段热分解失去4个 D、500℃热分解后生成固体化合物13. 用久置于空气中的生石灰[主要成分为CaO,还含有和]制取的流程如下:
A、W、Y、Z的单质常温下均为气体 B、最高价氧化物的水化物酸性:X<Y C、100~200℃阶段热分解失去4个 D、500℃热分解后生成固体化合物13. 用久置于空气中的生石灰[主要成分为CaO,还含有和]制取的流程如下:
已知75℃时,在碱性条件下会转化为和 , 室温下的溶解度远小于KCl。下列说法正确的是( )
A、氯化反应的离子方程式为 B、转化时发生反应的类型为复分解反应 C、滤液中大量存在的离子是、、和 D、如图所示KCl晶胞中与紧邻的有4个 14. 铀(U)可用作核燃料。核废料中+6价的铀[U(Ⅵ)]可以通过以下两种方法处理。电化学还原法。U(Ⅵ)还原为U(Ⅳ)的电化学装置如图-1所示。
14. 铀(U)可用作核燃料。核废料中+6价的铀[U(Ⅵ)]可以通过以下两种方法处理。电化学还原法。U(Ⅵ)还原为U(Ⅳ)的电化学装置如图-1所示。
阴极上发生反应:、
阴极区溶液中发生反应:、
以恒定电流进行电解,测得阴极区溶液中部分离子的物质的量浓度随时间变化如图-2所示。下列说法错误的是( )
A、反应中,每生成0.1 mol N2转移电子0.4 mol B、阴极区溶液中加入N2H5NO3的目的是消耗反应中生成HNO2 , 防止HNO2与U4+反应 C、电解0~100 min,电路中每转移1 mol e- , 阴极区H+减少2 mol D、100~200 min,c(H+)下降速率低于100 min前,原因是相同时间内,转移等量电子时,比消耗的更少,且生成的HNO2与反应有H+生成二、综合题
-
15. 从铜阳极泥(含铜、银、铂、钯、硒等元素的单质或化合物)中分批提取硒、铂、钯、银、铜的过程如下:
 (1)、焙烧。将阳极泥与浓硫酸按一定比例混合浆化,在回转窑内焙烧。铜、银等元素转变为硫酸盐,同时得到含SeO2、SO2的烟气,烟气用水吸收后,硒元素全部变为单质硒。
(1)、焙烧。将阳极泥与浓硫酸按一定比例混合浆化,在回转窑内焙烧。铜、银等元素转变为硫酸盐,同时得到含SeO2、SO2的烟气,烟气用水吸收后,硒元素全部变为单质硒。①烟气中的硒元素能转变为单质硒的原因是。
②烟气中含有少量相对分子质量为224的硒氧化物,该氧化物的分子式为。
(2)、浸取。其他条件一定,将焙烧所得固体与相同体积水、不同体积硫酸混合,所得浸出液中各元素含量随硫酸加入量变化如图所示。实际浸出铜、银同时回收铂、钯的过程中,只用水作浸取剂而不添加硫酸的原因是。 (3)、转化。向浸出铜、银后所得滤液中加入足量NaCl,使Ag+转化为AgCl沉淀,过滤。向AgCl固体中加入5mol/L氨水[溶质以NH3(aq)计],发生反应:AgCl(s)+2NH3(aq)=Ag(NH3)(aq)+Cl-(aq) K=2.5×10-3。再加入水合肼(N2H4-H2O)还原[Ag(NH3)2]Cl,制得单质银,同时产生N2和NH3两种气体。
(3)、转化。向浸出铜、银后所得滤液中加入足量NaCl,使Ag+转化为AgCl沉淀,过滤。向AgCl固体中加入5mol/L氨水[溶质以NH3(aq)计],发生反应:AgCl(s)+2NH3(aq)=Ag(NH3)(aq)+Cl-(aq) K=2.5×10-3。再加入水合肼(N2H4-H2O)还原[Ag(NH3)2]Cl,制得单质银,同时产生N2和NH3两种气体。①溶解0.1molAgCl(s),至少需加入氨水的体积为(忽略溶液体积的变化)。
②水合肼还原[Ag(NH3)2]Cl的化学方程式为。
16. 电池级碳酸锂是制造LiCoO2等锂离子电池必不可少的原材料。以锂云母浸出液(含Li+、Al3+、Fe3+、Ca2+、等)制取电池级Li2CO3的工艺流程如下:
已知:①HR为酸性磷类有机萃取剂,难溶于水,可萃取Fe3+ , 萃取时发生反应:Fe3++3HR⇌FeR3+3H+ , 生成的FeR3可溶解在HR中。
②Li2CO3、LiHCO3的溶解度如图1所示:
 (1)、HR萃取剂使用前先用一定量的NaOH进行处理的目的是。(2)、沉锂过程中会有Li2CO3、CaCO3和Al(OH)3生成。写出沉锂时生成Al(OH)3反应的离子方程式:。(3)、过滤1后所得沉淀用热水洗涤的目的是。(4)、其他条件相同,向过滤1所得滤渣加入不同体积的去离子水,以一定流速通入CO2气体,测得热分解后电池级Li2CO3的产率随碳化反应固液比[]变化曲线如图2所示。Li2CO3产率随固液比减小而增加的原因是。
(1)、HR萃取剂使用前先用一定量的NaOH进行处理的目的是。(2)、沉锂过程中会有Li2CO3、CaCO3和Al(OH)3生成。写出沉锂时生成Al(OH)3反应的离子方程式:。(3)、过滤1后所得沉淀用热水洗涤的目的是。(4)、其他条件相同,向过滤1所得滤渣加入不同体积的去离子水,以一定流速通入CO2气体,测得热分解后电池级Li2CO3的产率随碳化反应固液比[]变化曲线如图2所示。Li2CO3产率随固液比减小而增加的原因是。 17. 纳米零价铁(ZVI)因其高比表面积、优异的吸附性、较强的还原性和反应活性等优点被广泛应用于污染物的去除。(1)、ZVI可通过FeCl2·4H2O和NaBH4溶液反应制得,同时生成H2、B(OH) , 制备过程中需要不断通入高纯氮气,其目的是。(2)、ZVI电化学腐蚀处理三氯乙烯进行水体修复,H+、O2、等物种的存在会影响效果,水体修复的过程如图所示。有效腐蚀过程中,生成1mol乙烯所转移的电子物质的量为mol,过程④对应的电极反应式为。
17. 纳米零价铁(ZVI)因其高比表面积、优异的吸附性、较强的还原性和反应活性等优点被广泛应用于污染物的去除。(1)、ZVI可通过FeCl2·4H2O和NaBH4溶液反应制得,同时生成H2、B(OH) , 制备过程中需要不断通入高纯氮气,其目的是。(2)、ZVI电化学腐蚀处理三氯乙烯进行水体修复,H+、O2、等物种的存在会影响效果,水体修复的过程如图所示。有效腐蚀过程中,生成1mol乙烯所转移的电子物质的量为mol,过程④对应的电极反应式为。 (3)、ZVI可去除废水中Pb2+ , pH<6时,pH对Pb2+的去除率的影响如图所示。
(3)、ZVI可去除废水中Pb2+ , pH<6时,pH对Pb2+的去除率的影响如图所示。
已知:ⅰ)在水中,ZVI表面的FeOH会因为质子化/去质子化作用而使其表面带正/负电荷,可表示为:FeOH+H+FeOH , FeOHFeO-+H+。pH约为8.1达到等电点,ZVI表面不带电。
ⅱ)pH<6时,ZVI去除Pb2+主要发生表面配位反应和还原反应:
2FeOH+ Pb2+(FeO)2Pb + 4H+
2Fe+ 3Pb2++ 4H2O3Pb+2FeOOH + 6H+
①pH<6时,铁氧化物颗粒不易吸附Pb2+的原因是。
②pH<6时,随着pH增大,Pb2+的去除率会增大至接近100%的原因是。
(4)、催化剂协同ZVI能将水体中的硝酸盐()转化为N2 , 其催化还原反应的过程如图所示。为有效降低水体中氮元素的含量,宜调整水体pH为4.2,当pH<4.2时,随pH减小,N2生成率逐渐降低的原因是。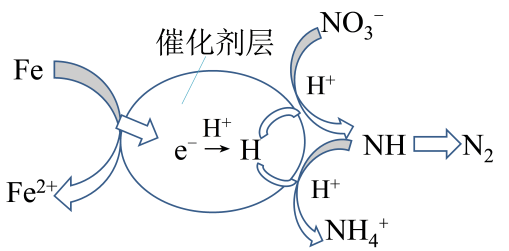 18. Na2S2O3俗称大苏打(海波),是重要的化工原料,无色易溶于水,不溶于乙醇,在中性或碱性环境中稳定,在40~45 ℃熔化,48 ℃分解。实验室用Na2SO3和过量硫粉(不溶于水,可溶于乙醇)在水溶液中加热反应制取Na2S2O3·5H2O晶体【Na2SO3(aq)+S(s) Na2S2O3(aq)】的步骤如下:
18. Na2S2O3俗称大苏打(海波),是重要的化工原料,无色易溶于水,不溶于乙醇,在中性或碱性环境中稳定,在40~45 ℃熔化,48 ℃分解。实验室用Na2SO3和过量硫粉(不溶于水,可溶于乙醇)在水溶液中加热反应制取Na2S2O3·5H2O晶体【Na2SO3(aq)+S(s) Na2S2O3(aq)】的步骤如下:① 称取一定量的Na2SO3于烧杯中,溶于水。
② ②另取过量的硫粉,用少许乙醇润湿后,加到上述溶液中。
③ 如图2所示(部分装置略去),水浴加热,微沸,反应后趁热过滤。
④ 滤液在经过相关实验操作后析出Na2S2O3·5H2O晶体。
⑤ 进行减压过滤并低温干燥。
(图1是有关物质的溶解度曲线)

 (1)、 图2中,仪器B的名称是。(2)、 实验步骤②中,加入的硫粉用乙醇润湿的目的是。(3)、 实验步骤③中,趁热过滤的原因是。(4)、 实验步骤④中,应采取的相关实验操作为。(5)、 实验步骤⑤中,采用低温干燥的目的是。(6)、 产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是。(7)、准确称取2.00 g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000 mol·L-1碘的标准溶液滴定。反应原理为2S2O+I2=S4O+2I-。滴定至终点时,溶液颜色的变化是。消耗碘的标准溶液体积为36.00 mL,产品的纯度为。
(1)、 图2中,仪器B的名称是。(2)、 实验步骤②中,加入的硫粉用乙醇润湿的目的是。(3)、 实验步骤③中,趁热过滤的原因是。(4)、 实验步骤④中,应采取的相关实验操作为。(5)、 实验步骤⑤中,采用低温干燥的目的是。(6)、 产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是。(7)、准确称取2.00 g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000 mol·L-1碘的标准溶液滴定。反应原理为2S2O+I2=S4O+2I-。滴定至终点时,溶液颜色的变化是。消耗碘的标准溶液体积为36.00 mL,产品的纯度为。