河北省邢台市名校联盟2022-2023学年高三上学期开学考试化学试题
试卷更新日期:2022-09-26 类型:开学考试
一、单选题
-
1. 北京冬奥会火炬接力火种灯的创意源于被誉为“中华第一灯”的长信宫灯。西汉长信宫灯设计巧妙环保,是一件既实用、又美观的灯具珍品。下列说法错误的是( )
 A、铝合金的硬度大于纯铝 B、青铜器表面破损易生成铜绿 C、丙烷和动物油脂均属于烃类 D、两灯所用燃料充分燃烧的产物均不污染环境2. 洛伐他汀可减少人体内低密度脂蛋白受体合成增加,减少胆固醇的合成,常用于防治冠心病。其结构简式如图所示。下列关于该化合物的说法错误的是( )
A、铝合金的硬度大于纯铝 B、青铜器表面破损易生成铜绿 C、丙烷和动物油脂均属于烃类 D、两灯所用燃料充分燃烧的产物均不污染环境2. 洛伐他汀可减少人体内低密度脂蛋白受体合成增加,减少胆固醇的合成,常用于防治冠心病。其结构简式如图所示。下列关于该化合物的说法错误的是( ) A、分子中含有3种官能团 B、1mol可与4mol加成 C、可使酸性溶液褪色 D、酸性条件下水解可生成两种产物3. 下列试剂的实验室保存方法错误的是( )A、将少量的白磷保存在水中 B、存放液溴的试剂瓶应加水封 C、氢氟酸密封保存在塑料瓶中 D、新制氯水保存在棕色广口试剂瓶中4. 实验室用标准NaOH溶液滴定食用白醋,测定所含醋酸的浓度,下列说法错误的是( )A、将NaOH固体放在烧杯中用托盘天平称量 B、用量筒量取25.00mL NaOH标准溶液置于锥形瓶中 C、滴定时眼睛一直注视锥形瓶中溶液颜色变化 D、用酚酞作指示剂,滴定终点时溶液为浅红色5. 具有放射性,其衰变反应为。已知半衰期指含放射性原子的样品中,放射性元素原子核有50%发生衰变所需的时间,的半衰期为138天。下列说法错误的是( )A、的相对原子质量为206 B、Po元素的价层电子排布为 C、研究发现烟草中含和 , 它们互为同位素 D、质量为64g的经276天得到的质量为47.09g6. 某工厂采用辉铋矿(主要成分为 , 含有、杂质)与软锰矿(主要成分为)联合焙烧法制备 , 工艺流程如图所示。焙烧时过量的分解为 , 下列说法错误的是( )
A、分子中含有3种官能团 B、1mol可与4mol加成 C、可使酸性溶液褪色 D、酸性条件下水解可生成两种产物3. 下列试剂的实验室保存方法错误的是( )A、将少量的白磷保存在水中 B、存放液溴的试剂瓶应加水封 C、氢氟酸密封保存在塑料瓶中 D、新制氯水保存在棕色广口试剂瓶中4. 实验室用标准NaOH溶液滴定食用白醋,测定所含醋酸的浓度,下列说法错误的是( )A、将NaOH固体放在烧杯中用托盘天平称量 B、用量筒量取25.00mL NaOH标准溶液置于锥形瓶中 C、滴定时眼睛一直注视锥形瓶中溶液颜色变化 D、用酚酞作指示剂,滴定终点时溶液为浅红色5. 具有放射性,其衰变反应为。已知半衰期指含放射性原子的样品中,放射性元素原子核有50%发生衰变所需的时间,的半衰期为138天。下列说法错误的是( )A、的相对原子质量为206 B、Po元素的价层电子排布为 C、研究发现烟草中含和 , 它们互为同位素 D、质量为64g的经276天得到的质量为47.09g6. 某工厂采用辉铋矿(主要成分为 , 含有、杂质)与软锰矿(主要成分为)联合焙烧法制备 , 工艺流程如图所示。焙烧时过量的分解为 , 下列说法错误的是( ) A、和联合焙烧转化为、 B、水浸所得滤液的主要成分是 C、酸浸所得滤渣的主要成分是 , 气体X为 D、向酸浸滤液中加入金属Bi的目的是消耗 , 促进水解7. 材料是人类赖以生存和发展的物质基础。下列说法错误的是( )A、新型陶瓷与传统陶瓷的化学成分不同 B、酚醛树脂和聚酯纤维均属于有机高分子材料 C、聚酰胺纤维中的锦纶是较早通过加聚反应合成的纤维 D、高纯度的单晶硅、二氧化硅属于新型无机非金属材料8. 利用下列装置能达到实验目的的是( )
A、和联合焙烧转化为、 B、水浸所得滤液的主要成分是 C、酸浸所得滤渣的主要成分是 , 气体X为 D、向酸浸滤液中加入金属Bi的目的是消耗 , 促进水解7. 材料是人类赖以生存和发展的物质基础。下列说法错误的是( )A、新型陶瓷与传统陶瓷的化学成分不同 B、酚醛树脂和聚酯纤维均属于有机高分子材料 C、聚酰胺纤维中的锦纶是较早通过加聚反应合成的纤维 D、高纯度的单晶硅、二氧化硅属于新型无机非金属材料8. 利用下列装置能达到实验目的的是( )选项
A
B
C
D
实验装置




实验目的
制溴苯并验证有HBr生成
蒸发溶液制备粉末
喷泉实验
实验室制氨气
A、A B、B C、C D、D9. 硼砂阴离子的球棍模型如图所示,下列说法错误的是( ) A、硼原子的杂化方式为、 B、1、2原子之间的化学键为配位键 C、硼砂阴离子间可结合成链状结构,则阴离子间以氢键结合 D、该阴离子中存在的化学键类型有极性键、配位键、氢键10. W、X、Y、Z是原子序数依次增大的短周期主族元素,其最外层电子数之和为18,W、X、Y分别位于不同周期,X与Y同主族,W的最低负价与Z的最高正价的代数和等于6,下列说法错误的是( )A、W分别与X、Y形成的简单化合物的键角:前者大于后者 B、Y与Z形成的化合物中各原子不一定满足8电子稳定结构 C、Z分别与X、Y形成的化合物均可与水反应生成两种酸 D、Y的一种单质分子呈正四面体结构,键角为60°11. 电镀行业产生的酸性废水含有毒性较强的Cr(Ⅵ),图所示为电解处理酸性含铬废水的装置,应用该装置使Cr(Ⅵ)转化为沉淀除去。图为不同pH的溶液中铬元素去除率与通电时间(t)的关系。下列说法错误的是( )
A、硼原子的杂化方式为、 B、1、2原子之间的化学键为配位键 C、硼砂阴离子间可结合成链状结构,则阴离子间以氢键结合 D、该阴离子中存在的化学键类型有极性键、配位键、氢键10. W、X、Y、Z是原子序数依次增大的短周期主族元素,其最外层电子数之和为18,W、X、Y分别位于不同周期,X与Y同主族,W的最低负价与Z的最高正价的代数和等于6,下列说法错误的是( )A、W分别与X、Y形成的简单化合物的键角:前者大于后者 B、Y与Z形成的化合物中各原子不一定满足8电子稳定结构 C、Z分别与X、Y形成的化合物均可与水反应生成两种酸 D、Y的一种单质分子呈正四面体结构,键角为60°11. 电镀行业产生的酸性废水含有毒性较强的Cr(Ⅵ),图所示为电解处理酸性含铬废水的装置,应用该装置使Cr(Ⅵ)转化为沉淀除去。图为不同pH的溶液中铬元素去除率与通电时间(t)的关系。下列说法错误的是( ) A、铁板为阳极,电极反应为 B、电解法去除Cr(Ⅵ)的最佳pH范围为4~6 C、曲线Ⅳ铬元素去除率低的原因可能是氧化性较弱 D、除去Cr(Ⅵ)的主要反应为
A、铁板为阳极,电极反应为 B、电解法去除Cr(Ⅵ)的最佳pH范围为4~6 C、曲线Ⅳ铬元素去除率低的原因可能是氧化性较弱 D、除去Cr(Ⅵ)的主要反应为二、多选题
-
12. 有机物M与N在NaOH溶液中发生如图所示的反应,生成有机物L。下列说法正确的是( )
 A、N还有3种含苯环的同分异构体 B、L分子存在顺反异构体 C、M、N、L均可与溴水发生加成反应 D、L分子中的所有碳原子可能在同一平面上13. 向一定体积的的草酸溶液中滴加的NaOH溶液,溶液中、、的物质的量分数(δ)随pH变化的关系如图所示。下列说法错误的是( )
A、N还有3种含苯环的同分异构体 B、L分子存在顺反异构体 C、M、N、L均可与溴水发生加成反应 D、L分子中的所有碳原子可能在同一平面上13. 向一定体积的的草酸溶液中滴加的NaOH溶液,溶液中、、的物质的量分数(δ)随pH变化的关系如图所示。下列说法错误的是( )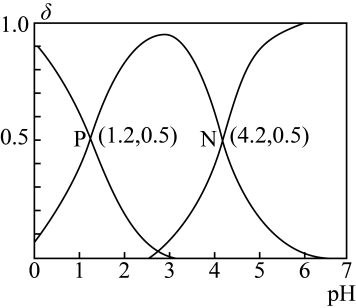 A、水的电离程度:N>M>P B、的水解平衡常数 C、N点: D、向的溶液中持续滴加NaOH溶液,水的电离程度持续变大
A、水的电离程度:N>M>P B、的水解平衡常数 C、N点: D、向的溶液中持续滴加NaOH溶液,水的电离程度持续变大三、实验题
-
14. 是国际公认的一种安全、低毒的绿色消毒剂。熔点为―59.5℃,沸点为11.0℃,高浓度时极易爆炸,极易溶于水,遇热水易分解。实验室可用如图所示的装置制备(装置A的酒精灯加热装置略去)。回答下列问题:
 (1)、下列关于分子结构和性质的说法错误的是____。A、分子中只含σ键 B、分子具有极性 C、可与水分子间形成氢键 D、分子的空间结构为V形(2)、实验开始即向装置A中通入氮气,目的是。(3)、装置A中反应的化学方程式为。(4)、装置B的作用是 , 装置C中使用冷水的目的是。(5)、装置D中吸收尾气的反应也可用于制备 , 反应的离子方程式为。(6)、我国规定自来水厂用处理后,出厂水中余量为。针对消毒的水中含有、、等多种含氯微粒,我国科学工作者研制出能将这些微粒区别测定的碘量法。应用碘量法检测水中的浓度,实验步骤如下:
(1)、下列关于分子结构和性质的说法错误的是____。A、分子中只含σ键 B、分子具有极性 C、可与水分子间形成氢键 D、分子的空间结构为V形(2)、实验开始即向装置A中通入氮气,目的是。(3)、装置A中反应的化学方程式为。(4)、装置B的作用是 , 装置C中使用冷水的目的是。(5)、装置D中吸收尾气的反应也可用于制备 , 反应的离子方程式为。(6)、我国规定自来水厂用处理后,出厂水中余量为。针对消毒的水中含有、、等多种含氯微粒,我国科学工作者研制出能将这些微粒区别测定的碘量法。应用碘量法检测水中的浓度,实验步骤如下:Ⅰ.取某地自来水样100mL于锥形瓶中,用微量的稀硫酸溶液调至pH为1~3,然后加入一定量的碘化钾,并加入几滴淀粉溶液。
Ⅱ.向25mL滴定管中加入的溶液,用该标准液滴定步骤Ⅰ中的溶液至终点,消耗溶液20.00mL。
已知:①在酸性条件下的还原产物为;
②。
计算水样中的浓度是。步骤Ⅱ滴定终点的判断依据是 , 如果滴定结束时仰视读取滴定管中溶液的体积,则测定结果将(填“偏大”、“偏小”或“无影响”)。
四、综合题
-
15. 钛是一种性能优越的金属,在国防、化工、医疗等领域有广泛的应用。钛铁矿(主要成分为 , 还含少量的、、等杂质)是提炼钛的主要矿石,由钛铁矿制备金属钛的工艺流程如图所示。回答下列问题:
 (1)、滤液1的主要成分是(填化学式)。(2)、“酸浸”后钛主要以存在,写出“酸浸”主要反应的离子方程式。(3)、受热易水解,“水解(90℃)”得到的固体化学式为 , 验证“洗涤”达到目的的操作为。(4)、“高温氯化”反应的化学方程式为 , “冶炼”加入的试剂B为。(5)、已知的熔点为-25℃,沸点为135.25℃,分析说明能否直接电解液态制备金属钛。(6)、的晶胞如图所示,其组成元素的第一电离能由大到小顺序为 , Ti的配位数为。
(1)、滤液1的主要成分是(填化学式)。(2)、“酸浸”后钛主要以存在,写出“酸浸”主要反应的离子方程式。(3)、受热易水解,“水解(90℃)”得到的固体化学式为 , 验证“洗涤”达到目的的操作为。(4)、“高温氯化”反应的化学方程式为 , “冶炼”加入的试剂B为。(5)、已知的熔点为-25℃,沸点为135.25℃,分析说明能否直接电解液态制备金属钛。(6)、的晶胞如图所示,其组成元素的第一电离能由大到小顺序为 , Ti的配位数为。 16. 甲醛有毒,被世界卫生组织列为一类致癌物。但甲醛是重要的工业原料,在化工、纺织、医疗等领域有广泛应用。(1)、Ⅰ.回收利用是一种减弱温室效应的有效途径。科学家研究发现可利用回收的与反应制备甲醛。
16. 甲醛有毒,被世界卫生组织列为一类致癌物。但甲醛是重要的工业原料,在化工、纺织、医疗等领域有广泛应用。(1)、Ⅰ.回收利用是一种减弱温室效应的有效途径。科学家研究发现可利用回收的与反应制备甲醛。已知:①甲醛的燃烧热为
②的燃烧热为
③
与制备甲醛的反应: 。
(2)、在2L恒容密闭容器中通入0.2mol和0.4mol , 在三种不同条件下发生(1)中反应,测得的转化率与时间的关系如图所示。曲线X对应温度下反应的平衡常数K= , 由曲线Y到曲线X采取的措施可能是;由曲线Z到曲线X采取的措施可能是。 (3)、反应速率 , , 、分别为正、逆向反应速率常数,计算m点。(4)、Ⅱ.甲醇直接脱氢是工业上合成甲醛的一种新方法,该法得到无水甲醛的同时得到副产品氢气。
(3)、反应速率 , , 、分别为正、逆向反应速率常数,计算m点。(4)、Ⅱ.甲醇直接脱氢是工业上合成甲醛的一种新方法,该法得到无水甲醛的同时得到副产品氢气。在一个2L恒容密闭容器中投入2mol , 在催化剂作用下发生反应: , 同时存在副反应:。。20min后,测得甲醇的转化率与甲醛的选择性分别与温度的关系如图所示。温度高于650℃,甲醇的转化率升高,甲醛的产率 , 原因可能是。
 (5)、甲醛被称为室内污染“第一杀手”。室内甲醛的含量可以通过传感器来监测。一种燃料电池型甲醛气体传感器的工作原理如图所示,则a电极反应式为。国家标准是室内甲醛不能超过 , 传感器在室内空间测定,电路中有电子通过,该室内甲醛含量为。
(5)、甲醛被称为室内污染“第一杀手”。室内甲醛的含量可以通过传感器来监测。一种燃料电池型甲醛气体传感器的工作原理如图所示,则a电极反应式为。国家标准是室内甲醛不能超过 , 传感器在室内空间测定,电路中有电子通过,该室内甲醛含量为。 17. 布洛芬具有抗炎,痛、解热作用。以有机物A(
17. 布洛芬具有抗炎,痛、解热作用。以有机物A( )为原料制备布洛芬的一种合成路线如图所示。回答下列问题:
)为原料制备布洛芬的一种合成路线如图所示。回答下列问题:
已知:(ⅰ)

(ⅱ)环氧羧酸酯在一定条件下可发生反应:

 (1)、A的名称为 , 布洛芬分子中含有个手性碳原子。(2)、A→B的反应类型为 , B的结构简式为 , B中所含官能团的名称为。(3)、D与银氨溶液反应的化学方程式为。(4)、苯环上的一氯代物只有一种的A的同分异构体有种,写出其中任意一种的结构简式。(5)、2-苯基-1-丙醇(
(1)、A的名称为 , 布洛芬分子中含有个手性碳原子。(2)、A→B的反应类型为 , B的结构简式为 , B中所含官能团的名称为。(3)、D与银氨溶液反应的化学方程式为。(4)、苯环上的一氯代物只有一种的A的同分异构体有种,写出其中任意一种的结构简式。(5)、2-苯基-1-丙醇( )是一种重要的有机合成原料,请以苯乙酮(
)是一种重要的有机合成原料,请以苯乙酮( )和为原料,设计合成2-苯基-1-丙醇(
)和为原料,设计合成2-苯基-1-丙醇( )的合成路线(无机试剂、含有两个及两个以下碳的有机试剂任选)。
)的合成路线(无机试剂、含有两个及两个以下碳的有机试剂任选)。
-