河北省唐山市2022-2023学年高三上学期摸底考试化学试题
试卷更新日期:2022-09-26 类型:开学考试
一、单选题
-
1. 化学和生活、生产密切相关。下列有关说法错误的是( )A、燃煤“气化”、“脱硫”、“钙基固硫”等措施有利于减少排放和酸雨形成 B、华为5G手机芯片的主要成分是二氧化硅 C、医用酒精常为体积分数为75%的乙醇溶液,可用于杀菌消毒 D、肉类食品在加工过程中可加入适量保鲜防腐2. 有机化合物在生产生活中有重要的应用,下列有关说法正确的是( )A、乙烯和聚乙烯均可使溴水褪色 B、苯及其同系物均不能使酸性溶液褪色 C、石油的催化裂化是为了提高轻质油的产量和质量 D、糖类、油脂、蛋白质在一定条件下均可水解3. NA为阿伏加德罗常数的值,下列有关说法正确的是( )A、18g重水中含有的质子数为10NA B、标准状况下,中分子数为NA C、与S完全反应,转移的电子数为0.2NA D、密闭容器中,与充分反应后,混合气体中氧原子数为4NA4. 下列操作规范且能达到实验目的的是( )
A
B
C
D




测定中和热
除去中的
实验室制
制备溴苯并验证
A、A B、B C、C D、D5. 氮及其化合物的“价—类”二维图如图所示,下列有关说法错误的是( )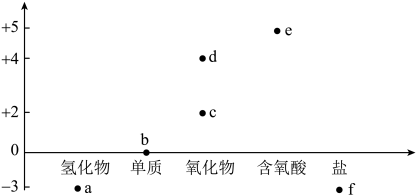 A、常温下,a、c、d均为刺激性气味的气体 B、由b生成a或c的过程均属于氮的固定 C、实验室e的浓溶液需保存在棕色试剂瓶中 D、f的氯化物与的反应为吸热反应6. 下图所示离子对应的钾盐易溶于水,常被用来鉴别Z元素某种离子。其中X、Y、Z为前四周期原子序数依次增大的三种元素,X、Y为相邻元素,Z原子核外电子数是X、Y原子质子数之和的2倍。下列说法错误的是( )
A、常温下,a、c、d均为刺激性气味的气体 B、由b生成a或c的过程均属于氮的固定 C、实验室e的浓溶液需保存在棕色试剂瓶中 D、f的氯化物与的反应为吸热反应6. 下图所示离子对应的钾盐易溶于水,常被用来鉴别Z元素某种离子。其中X、Y、Z为前四周期原子序数依次增大的三种元素,X、Y为相邻元素,Z原子核外电子数是X、Y原子质子数之和的2倍。下列说法错误的是( ) A、与Y同周期的主族元素中,只有一种元素的第一电离能大于Y的第一电离能 B、简单氢化物沸点: C、基态Z原子的电子排布式: D、该离子中σ键与π键的个数比为1∶17. 关于有机化合物a(
A、与Y同周期的主族元素中,只有一种元素的第一电离能大于Y的第一电离能 B、简单氢化物沸点: C、基态Z原子的电子排布式: D、该离子中σ键与π键的个数比为1∶17. 关于有机化合物a( )、b(
)、b( )、c(
)、c( ),下列说法正确的是( ) A、等质量的a、b完全燃烧,a消耗氧气多 B、a与b互为同系物,a与c互为同分异构体 C、a、b的二氯取代产物均有三种同分异构体(不考虑立体异构) D、c中所有原子不可能位于同一平面上8. 类比是一种重要的学习方法,下列“类比”中正确的是( )A、CO2通入溶液中不产生沉淀,则SO2通入溶液中也不产生沉淀 B、钠在空气中加热能生成过氧化钠,则锂在空气中加热也能生成过氧化锂 C、可用固体与浓硫酸加热制气体,则可用固体与浓硫酸加热制气体 D、CO2中C为sp杂化,SiO2中Si也是sp杂化9. 下列有关实验操作、现象的解释或结论正确的是( )
),下列说法正确的是( ) A、等质量的a、b完全燃烧,a消耗氧气多 B、a与b互为同系物,a与c互为同分异构体 C、a、b的二氯取代产物均有三种同分异构体(不考虑立体异构) D、c中所有原子不可能位于同一平面上8. 类比是一种重要的学习方法,下列“类比”中正确的是( )A、CO2通入溶液中不产生沉淀,则SO2通入溶液中也不产生沉淀 B、钠在空气中加热能生成过氧化钠,则锂在空气中加热也能生成过氧化锂 C、可用固体与浓硫酸加热制气体,则可用固体与浓硫酸加热制气体 D、CO2中C为sp杂化,SiO2中Si也是sp杂化9. 下列有关实验操作、现象的解释或结论正确的是( )选项
实验操作
现象
解释或结论
A
将通入酸性高锰酸钾溶液中
溶液褪色
具有漂白性
B
除去表面氧化膜的铝箔,在酒精灯上充分加热
铝不能滴落下来
铝熔点高不能熔化
C
将稀硫酸滴入淀粉溶液中,加热一段时间,再加入新制的悬浊液并加热
溶液中未出现砖红色沉淀
淀粉未水解
D
向盛有的溶液的试管中滴加4~5滴溶液,再向其中滴加4~5滴的溶液
先有白色沉淀成,后又产生黄色沉淀
A、A B、B C、C D、D10. 以某冶金工业产生的废渣(含)为原料制备的流程如下图所示。已知碱浸后溶液中主要存在的阴离子是:、。
下列说法正确的是( )
A、“氧化”步骤,氧化剂与还原剂的比值为2∶3 B、“除杂”时,生成的离子方程式为: C、过滤时,为加快过滤速率,可用玻璃棒搅拌 D、的溶解度小于11. 有机化合物M、N、P之间满足如下转化关系,下列有关说法错误的是( ) A、M的分子式为 B、最多可消耗 C、P在一定条件下可与乙醇缩聚形成高聚物 D、N、P均可与溶液反应
A、M的分子式为 B、最多可消耗 C、P在一定条件下可与乙醇缩聚形成高聚物 D、N、P均可与溶液反应二、多选题
-
12. 下列叙述正确的是( )
 A、和分子中所有原子的最外层都达到8电子稳定结构 B、和都是正四面体分子且键角都为 C、和是等电子体,均为平面正三角形结构 D、金属镁采取的是六方最密堆积,晶胞结构如上图所示,配位数为1213. 以甲烷燃料电池为电源电解溶液制备的工作原理如图所示,下列叙述错误的是( )
A、和分子中所有原子的最外层都达到8电子稳定结构 B、和都是正四面体分子且键角都为 C、和是等电子体,均为平面正三角形结构 D、金属镁采取的是六方最密堆积,晶胞结构如上图所示,配位数为1213. 以甲烷燃料电池为电源电解溶液制备的工作原理如图所示,下列叙述错误的是( ) A、燃料电池通入氧气的电极接电解池的Y电极 B、N室中: C、膜I、III为阳离子交换膜,膜II为阴离子交换膜 D、理论上每生成1mol产品,需消耗甲烷的体积为(标况)14. 常温下,二元弱酸与形成的混合体系中(如图),只有未电离的能自由通过该膜。
A、燃料电池通入氧气的电极接电解池的Y电极 B、N室中: C、膜I、III为阳离子交换膜,膜II为阴离子交换膜 D、理论上每生成1mol产品,需消耗甲烷的体积为(标况)14. 常温下,二元弱酸与形成的混合体系中(如图),只有未电离的能自由通过该膜。
当达到平衡时,下列叙述正确的是( )
A、溶液I中 B、溶液I和II中的不相等 C、溶液I和II中的之比为 D、溶液I和II中的相等三、综合题
-
15. 是制备金属钛及其化合物的重要中间体。已知反应: , 在耐高温陶瓷管内加入粉末和碳粉制备。装置如图(夹持装置略去)。

已知:
①的熔、沸点分别为、 , 遇潮湿空气产生白色烟雾;
②的熔、沸点分别为、 , 与互溶。
请回答下列问题:
(1)、装置A中反应的离子反应方程式为 ,(2)、装置C中所盛试剂为 , 装置D仪器名称。(3)、装置E中碱石灰的作用是。装置F中生成了金属单质和两种酸性气体,写出其反应的化学方程式为。(4)、制备时副反应生成。实验结束后提纯的操作是(填操作名称)。(5)、测定产品纯度:测定产品密度为。准确量取产品,溶于盛有足量盐酸的容量瓶中。摇至无烟雾后加水稀释至刻度线,摇匀得到含溶液。取配好的溶液加入过量金属铝,将全部转化为。再加适量盐酸待过量金属铝完全溶解并冷却后得无色溶液,加入指示剂,用标准溶液滴定至终点,将氧化为。记录消耗标准溶液的体积。重复操作2~3次,消耗标准溶液平均体积为。①滴定时所用的指示剂为(填标号)。
a.酚酞溶液 b.甲基橙 c.溶液 d.溶液
②滴定到达终点的现象是。
③产品中的纯度为。
16. 钼系催化剂主要用于石油炼制和化学工业中。从废催化剂(主要成分为、和)中提取钼酸钠晶体。工艺流程如下:
回答下列问题:
(1)、“研磨”的目的为(2)、“焙烧”中各金属元素转化为对应含氧酸钠盐(、等),写出转化的化学方程式。(3)、混合气体X通入沉铝步骤前,应经过溶液的处理。通常认为溶液中离子浓度不大于为沉淀完全。铝元素恰好完全转化为沉淀时滤液的pH为。{已知:①;②}(4)、沉钒步骤中的滤渣2主要成分为;获得粗产物的操作1是、过滤、洗涤、干燥。(5)、为减少反应中废气对环境的污染问题,用足量的碱性溶液在加热条件下处理废催化剂也可以制备钼酸钠。请写出制备钼酸钠的离子方程式。17. 正丁烷除直接用作燃料外,还用作亚临界生物技术提取溶剂、制冷剂和有机合成原料。已知:反应1:

反应2:

反应3:

回答下列问题:
(1)、设为物质的量分数平衡常数,对于反应 , 其表达式写法: , 为各组分的物质的量分数。反应1、2、3以物质的量分数表示的平衡常数与温度的变化关系如图所示:

①反应1,正反应的活化能逆反应的活化能(填“大于”、“等于”或“小于”)
②稳定性AB(填“大于”或“小于”):
③的数值范围是(填标号)
A. B.-1~0 C.0~1 D.
(2)、为研究上述反应体系的平衡关系,向某反应容器中加入2mol正丁烷,控制一定温度,测得正丁烷的平衡转化率为。已知反应3的平衡常数 , 则平衡体系中A的物质的量为mol,反应2的平衡常数。同温同压下,再向该容器中充入一定量惰性气体He,反应2的化学平衡将(填“正向移动”“逆向移动”或“不移动”)。平衡时,与A物质的量浓度之比。18. 医药中间体G( )是一种合成镇痛药的主要原料,其中一种用苯酚合成G的路线如图:
)是一种合成镇痛药的主要原料,其中一种用苯酚合成G的路线如图:
已知:①(R为H或烃基,下同)
②
 (1)、A的化学名称为 , B中所含官能团名称是 , C的结构简式为。(2)、在反应①②③④⑤中有属于加成反应的是(填序号)。(3)、写出反应⑥的化学方程式为。(4)、等量的F分别与足量氢氧化钠溶液、氢气反应,消耗氢氧化钠与氢气的物质的量之比为。检验G中是否含有F的试剂为。(5)、写出两种满足下列条件的B的同分异构体。
(1)、A的化学名称为 , B中所含官能团名称是 , C的结构简式为。(2)、在反应①②③④⑤中有属于加成反应的是(填序号)。(3)、写出反应⑥的化学方程式为。(4)、等量的F分别与足量氢氧化钠溶液、氢气反应,消耗氢氧化钠与氢气的物质的量之比为。检验G中是否含有F的试剂为。(5)、写出两种满足下列条件的B的同分异构体。①属于芳香族化合物;
②能发生银镜反应和水解反应;
③核磁共振氢谱中有4组吸收峰,且峰面积之比为6∶3∶2∶1。
(6)、参照上述合成路线和信息,以 和苯酚为原料(无机试剂任选),设计制备
和苯酚为原料(无机试剂任选),设计制备 的合成路线。
的合成路线。