广西桂林市联盟校2022-2023学年高三上学期9月入学统一检测化学试题
试卷更新日期:2022-09-26 类型:开学考试
一、单选题
-
1. 2022年3月,嫦娥五号任务顺利完成,化学功不可没。下列说法正确的是( )A、探测器装有太阳能电池板,该电池能将太阳能转化为电能 B、返回器带回的月壤中含有 , 它与地球上的性质完全相同 C、运载火箭使用了煤油液氧推进剂,其中煤油是由石油分馏而得,这个过程属于化学变化 D、嫦娥五号所携带的国旗主要成分为国产高性能芳纶纤维材料,该材料是高分子材料,属于纯净物2. 下列过程在一定条件下能自发进行但不能用熵增解释的是( )A、花香四溢 B、冰块融化 C、Na2CO3·10H2O风化 D、水蒸气冷凝3. 以下应用与盐类水解无关的是( )A、用热碱去除废铁屑表面油污 B、配制Na2S溶液时需将Na2S溶于NaOH浓溶液 C、用硫酸铝溶液和碳酸氢钠溶液混合灭火 D、用FeCl3溶液刻蚀铜制电路板4. 合成氨反应为: 。下列有关该反应的说法正确的是( )A、催化剂增大了正、逆反应的活化能 B、升高温度,该反应的平衡常数增大 C、正反应的活化能小于逆反应的活化能 D、升温或增压均可提高的平衡转化率5. 用表示阿伏加德罗常数的值。下列叙述中正确的是( )A、盐酸与足量共热,转移的电子数为 B、电解精炼铜时,若阳极质量减少64g,则阴极得到的电子数为 C、0.1mol和0.1mol于密闭容器中充分反应后,其分子总数为 D、反应中生成3mol转移的电子数为6. 化合物M(结构式如图所示)是常用的还原剂,其中X、Y、Z是原子序数依次减小的不同短周期的主族元素,X与W、Z与W均能形成原子个数比为1∶1和2∶1的化合物,W原子的最外层电子数是电子层数的3倍。下列叙述正确的是( )
 A、Z元素位于第三周期第VIIA族 B、X和Z形成的化合物的水溶液呈酸性 C、化合物M不能与Z2W2反应 D、Y的最高价氧化物对应的水化物为一元弱酸7. 生活因化学更美好。下列生活用途及化学原理都正确且具有对应关系的是( )
A、Z元素位于第三周期第VIIA族 B、X和Z形成的化合物的水溶液呈酸性 C、化合物M不能与Z2W2反应 D、Y的最高价氧化物对应的水化物为一元弱酸7. 生活因化学更美好。下列生活用途及化学原理都正确且具有对应关系的是( )选项
生活用途
化学原理
A
维生素C帮助人体将Fe3+转化为易吸收的Fe2+
维生素C具有还原性
B
小苏打可作食品膨松剂
小苏打可水解产生二氧化碳
C
过氧化钠用作呼吸面具中的供氧剂
过氧化钠分解产生氧气
D
明矾可用作净水剂和消毒剂
铝离子水解生成氢氧化铝胶体
A、A B、B C、C D、D8. 2022年北京冬奥会场馆建设中用到一种耐腐、耐高温的表面涂料是以某双环烯酯为原料生产的,该双环烯酯的结构如图所示,下列说法正确的是( ) A、该双环烯酯的分子式为C14H22O2 B、该双环烯酯完全加氢后,产物的一氯代物有9种 C、该双环烯酯分子中有2种含氧官能团 D、该双环烯酯分子中所有碳原子共平面9. 我国“祝融号”火星车成功着陆火星,其矿脉中含有原子序数依次增大的短周期主族元素W、X、Y、Z。已知W、Z同主族,且Z的原子序数是W的2倍,X的氢化物可用于蚀刻玻璃,Y与Z最外层电子数之和等于8。下列说法正确的是( )A、离子半径:Z>Y>W>X B、同周期第一电离能小于Z的元素有4种 C、X与Y可形成共价化合物YX2 D、简单氢化物的还原性:W的氢化物>Z的氢化物10. 类比法是化学上研究物质的重要方法之一,下列类比结果正确的是( )A、将溶液蒸干灼烧后得到CuO固体,则将溶液蒸干灼烧后得到固体 B、与反应生成与 , 则与反应生成与 C、工业上电解熔融的冶炼Mg,则电解熔融的冶炼Al D、镁和铝与稀硫酸所形成的原电池中镁作负极,则镁和铝与氢氧化钠溶液所形成的原电池中镁作负极11. 下列实验装置图正确且能达到相应实验目的的是( )
A、该双环烯酯的分子式为C14H22O2 B、该双环烯酯完全加氢后,产物的一氯代物有9种 C、该双环烯酯分子中有2种含氧官能团 D、该双环烯酯分子中所有碳原子共平面9. 我国“祝融号”火星车成功着陆火星,其矿脉中含有原子序数依次增大的短周期主族元素W、X、Y、Z。已知W、Z同主族,且Z的原子序数是W的2倍,X的氢化物可用于蚀刻玻璃,Y与Z最外层电子数之和等于8。下列说法正确的是( )A、离子半径:Z>Y>W>X B、同周期第一电离能小于Z的元素有4种 C、X与Y可形成共价化合物YX2 D、简单氢化物的还原性:W的氢化物>Z的氢化物10. 类比法是化学上研究物质的重要方法之一,下列类比结果正确的是( )A、将溶液蒸干灼烧后得到CuO固体,则将溶液蒸干灼烧后得到固体 B、与反应生成与 , 则与反应生成与 C、工业上电解熔融的冶炼Mg,则电解熔融的冶炼Al D、镁和铝与稀硫酸所形成的原电池中镁作负极,则镁和铝与氢氧化钠溶液所形成的原电池中镁作负极11. 下列实验装置图正确且能达到相应实验目的的是( )



A.验证原电池电子移动方向
B.实验室制备并检验乙烯
C.保护铁片(牺牲阳极的阴极保护法)
D.用已知浓度的盐酸测定未知浓度的NaOH溶液(含无色酚酞)
A、A B、B C、C D、D12. 下列各组澄清溶液中的离子能大量共存,且加入(或通入)X试剂后发生反应的离子方程式书写正确的是( )选项
离子组
X试剂
离子方程式
A
、、、
NaOH溶液
B
、、、
过量氨水
C
、、、
少量盐酸
D
、、、
足量
A、A B、B C、C D、D13. 碳酸二甲酯(DMC)的结构简式为 , 其化学性质非常活泼,极易水解。用电解法制备碳酸二甲酯的模拟装置如图所示。下列说法正确的是( ) A、左侧电极为阴极,右侧电极为阳极 B、质子通过交换膜从阴极区移向阳极区 C、离子液体必须是水溶液,目的是传递电荷 D、阳极发生的反应:14. 硫酸甲酯是制造染料的甲基化试剂,在有存在的条件下,和的反应历程如图所示(分子间的作用力用“…”表示)。下列说法错误的是( )
A、左侧电极为阴极,右侧电极为阳极 B、质子通过交换膜从阴极区移向阳极区 C、离子液体必须是水溶液,目的是传递电荷 D、阳极发生的反应:14. 硫酸甲酯是制造染料的甲基化试剂,在有存在的条件下,和的反应历程如图所示(分子间的作用力用“…”表示)。下列说法错误的是( ) A、与反应的 B、a、b、c三种中间产物中,a最稳定 C、该反应最高能垒(活化能)为19.06eV D、由d转化为f过程中,有硫氧键的生成15. 1,3-丁二烯在环己烷溶液中与溴发生加成反应时,会生成两种产物M和N(不考虑立体异构),其反应机理如图1所示;室温下,M可以缓慢转化为N,能量变化如图2所示。下列有关说法正确的是( )
A、与反应的 B、a、b、c三种中间产物中,a最稳定 C、该反应最高能垒(活化能)为19.06eV D、由d转化为f过程中,有硫氧键的生成15. 1,3-丁二烯在环己烷溶液中与溴发生加成反应时,会生成两种产物M和N(不考虑立体异构),其反应机理如图1所示;室温下,M可以缓慢转化为N,能量变化如图2所示。下列有关说法正确的是( ) A、室温下,M的稳定性强于N B、
A、室温下,M的稳定性强于N B、 C、1mol 1,3-丁二烯完全燃烧需消耗的物质的量为5.5mol
D、有机物M的核磁共振氢谱中有四组峰,峰面积之比为2∶1∶2∶2
16. 2021 年9月,我国科学家团队在实验室中利用二氧化碳人工合成淀粉获得成功。如图是合成过程的相关反应路径(部分反应条件、产物等均已略去)。下列有关说法正确的是( )
C、1mol 1,3-丁二烯完全燃烧需消耗的物质的量为5.5mol
D、有机物M的核磁共振氢谱中有四组峰,峰面积之比为2∶1∶2∶2
16. 2021 年9月,我国科学家团队在实验室中利用二氧化碳人工合成淀粉获得成功。如图是合成过程的相关反应路径(部分反应条件、产物等均已略去)。下列有关说法正确的是( ) A、人工合成淀粉的化学式可表示为(C6H12O6)n B、反应①、②、③的原子利用率均为100% C、CO2→CH3OH→ HCHO的转化过程中碳元素均被还原 D、过氧化氢酶使H2O2及时分解,防止其氧化其它酶,同时增大O2的利用率17. 科学家利用过渡金属氮化物(TMNS)在常温下催化实现氨的合成,其反应机理如图所示。下列有关说法错误的是( )
A、人工合成淀粉的化学式可表示为(C6H12O6)n B、反应①、②、③的原子利用率均为100% C、CO2→CH3OH→ HCHO的转化过程中碳元素均被还原 D、过氧化氢酶使H2O2及时分解,防止其氧化其它酶,同时增大O2的利用率17. 科学家利用过渡金属氮化物(TMNS)在常温下催化实现氨的合成,其反应机理如图所示。下列有关说法错误的是( ) A、TMNS大大降低了合成氨反应的焓变 B、TMNS表面上的N原子最终被还原为氨 C、TMNS表面上氨脱附产生的空位有利于吸附N2 D、用同位素标记后的15N2进行该合成反应,产物中不只有15NH318. 常温下,向1L pH=10的NaOH溶液中持续通入气体。通入的体积(V)与溶液中水电离出的的关系如图所示。下列叙述错误的是( )
A、TMNS大大降低了合成氨反应的焓变 B、TMNS表面上的N原子最终被还原为氨 C、TMNS表面上氨脱附产生的空位有利于吸附N2 D、用同位素标记后的15N2进行该合成反应,产物中不只有15NH318. 常温下,向1L pH=10的NaOH溶液中持续通入气体。通入的体积(V)与溶液中水电离出的的关系如图所示。下列叙述错误的是( ) A、a点溶液中:水电离出的 B、b点溶液中: C、c点溶液中: D、d点溶液中:19. 某化学小组的同学测定0.1mol/L 溶液在先升温再降温过程中的pH(不将虑温度变化过程中溶液体积的变化),数据如表,下列有关说法中正确的是( )
A、a点溶液中:水电离出的 B、b点溶液中: C、c点溶液中: D、d点溶液中:19. 某化学小组的同学测定0.1mol/L 溶液在先升温再降温过程中的pH(不将虑温度变化过程中溶液体积的变化),数据如表,下列有关说法中正确的是( )时刻
①
②
③
④
温度/℃
25
30
40
25
pH
9.66
9.52
9.37
9.25
A、①与④的值不相等 B、④的pH与①不同,是浓度减小造成的 C、①→③的过程中,温度和浓度的变化对水解平衡移动方向的影响一致 D、溶液中存在水解平衡:20. 已知常温下二元弱酸H2A溶液中,H2A、HA-、A2-的分布分数(δ)随pH变化如图所示[如A2-分布分数:δ(A2-)=],下列说法错误的是( )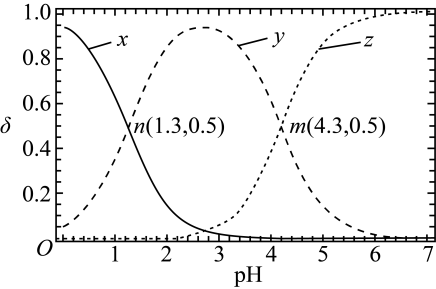 A、曲线x代表H2A,曲线z代表A2- B、pH从3升高至4,的值一直减小 C、n点对应的溶液中水电离出的c(H+)=10-12.7mol·L-1 D、将浓度均为0.05mol·L-1的NaHA溶液与Na2A溶液等体积混合后,所得溶液pH>4.3
A、曲线x代表H2A,曲线z代表A2- B、pH从3升高至4,的值一直减小 C、n点对应的溶液中水电离出的c(H+)=10-12.7mol·L-1 D、将浓度均为0.05mol·L-1的NaHA溶液与Na2A溶液等体积混合后,所得溶液pH>4.3二、实验题
-
21. 摩尔盐是一种常见的复盐。以下是摩尔盐的制备流程。请回答相关问题。
 (1)、步骤2的名称应为。(2)、抽滤装置如图所示。和普通过滤相比,抽滤的优点是。
(1)、步骤2的名称应为。(2)、抽滤装置如图所示。和普通过滤相比,抽滤的优点是。 (3)、加热浓缩时所用到的主要仪器中属于硅酸盐材质的有酒精灯、玻璃棒和。(4)、生成摩尔盐的化学反应方程式为。(5)、步骤3抽滤后用乙醇洗涤的原因是。(6)、含量是影响产品品质的关键指标。定量测定方法是:取1.00g产品于烧杯中,加入适量盐酸溶解,并加入3滴KSCN溶液,定容至50mL,取溶液置于比色管中,与标准色阶进行目视比色,确定产品级别。可以根据颜色确定产品级别的原理是。(7)、取28.00g所制得的固体于小烧杯中,加入适量稀硫酸,溶解后在250L容量瓶中定容。取25.00mL于锥形瓶中,用的 , 溶液滴定至终点。平行操作三次,消耗溶液的平均体积为16.00mL。此样品中含量为%。下列操作可能导致测定结果偏大的是。
(3)、加热浓缩时所用到的主要仪器中属于硅酸盐材质的有酒精灯、玻璃棒和。(4)、生成摩尔盐的化学反应方程式为。(5)、步骤3抽滤后用乙醇洗涤的原因是。(6)、含量是影响产品品质的关键指标。定量测定方法是:取1.00g产品于烧杯中,加入适量盐酸溶解,并加入3滴KSCN溶液,定容至50mL,取溶液置于比色管中,与标准色阶进行目视比色,确定产品级别。可以根据颜色确定产品级别的原理是。(7)、取28.00g所制得的固体于小烧杯中,加入适量稀硫酸,溶解后在250L容量瓶中定容。取25.00mL于锥形瓶中,用的 , 溶液滴定至终点。平行操作三次,消耗溶液的平均体积为16.00mL。此样品中含量为%。下列操作可能导致测定结果偏大的是。A.配溶液定容时俯视刻度线
B.取摩尔盐溶液的滴定管没有润洗
C.取待测液的锥形瓶洗净后未干燥
D.酸式滴定管滴定前读数正确,滴定后仰视读数
三、综合题
-
22. 锌灰是热镀锌厂和电解锌厂在生产过程中产生的一种副产品,主要成分为ZnO、ZnCl2 , 还含有SiO2、CuO、PbO和FeO。工业上利用锌灰制ZnSO4·7H2O晶体,进而获取ZnO,并探索氢电极增压还原氧化锌电解法制锌的方法,工艺流程如图所示:

已知:Cu++Cl-=CuCl↓。回答下列问题:
(1)、酸浸时,H2SO4应选用(填“浓硫酸”或“稀硫酸”)。(2)、滤渣1的主要成分有。(3)、写出“沉铜”时的离子方程式:。(4)、“氧化”后,加入聚丙烯酰胺絮凝剂并加热搅拌,其目的是。(5)、氢电极增压还原氧化锌的装置如图所示,储罐内ZnO溶解后形成Zn(OH) 离子,每溶解1molZnO需消耗molKOH。电解池中的总反应离子方程式为。 (6)、该工艺废水中含有Zn2+ , 排放前需处理。向废水中加入CH3COOH和CH3COONa组成的缓冲溶液调节pH,通入H2S发生反应:Zn2++H2S⇌ZnS(s)+2H+。处理后的废水中部分微粒浓度为
(6)、该工艺废水中含有Zn2+ , 排放前需处理。向废水中加入CH3COOH和CH3COONa组成的缓冲溶液调节pH,通入H2S发生反应:Zn2++H2S⇌ZnS(s)+2H+。处理后的废水中部分微粒浓度为微粒
H2S
CH3COOH
CH3COO-
浓度/(mol·L-1)
0.10
0.05
0.10
处理后的废水的pH= , c(Zn2+)=。[已知:Ksp(ZnS)=1.0×10-23 , Ka1(H2S)=1.0×10-7 , Ka2(H2S)=1.0×10-14 , Ka(CH3COOH)=2.0×10-5]
23. 研究的综合利用、实现资源化,是能源领域的重要发展方向,也是力争2030年前实现碳达峰、2060年前实现碳中和的方向之一、已知:反应I:
反应II:
反应III:
(1)、反应III中,kJ/mol。(2)、在体积为2L的刚性密闭容器中,充入1mol CO和2mol , 发生反应II,能判断反应达到平衡状态的是(填字母序号)。a. b.容器内压强保持不变
c.保持不变 d.的质量分数保持不变
(3)、在体积为2L的恒压密闭容器中,起始充入1mol 和3mol , 发生反应III,该反应在不同温度下达到平衡时,各组分的体积分数随温度的变化如图所示。
①表示和的体积分数随温度变化的曲线分别是(填字母序号)。
②A、B、C三点对应的化学平衡常数、、由大到小的顺序为 , 判断的理由是。
③240℃时,反应达到平衡后,容器中气体的总物质的量为mol,的平衡转化率为。若平衡时总压为P,该反应的平衡常数(列出计算式。用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
24. 钛、铜、锌及其化合物在生产生活中有着广泛的应用,回答下列问题:(1)、基态铜原子的价电子排布式;元素铜和锌的第二电离能:(填“>”、“>”或“=”)(2)、硫酸铜溶于氨水可形成络合物。中N原子的杂化轨道类型为 , 阴离子的立体构型为;1mol中含有键的数目为。(3)、钛与卤素形成的化合物熔点如表,则的熔点比高的原因可能是。熔点℃
377
―24
38.3
153
(4)、某含钛半夹心结构催化剂R能催化乙烯、丙烯等的聚合,其结构如图所示:则组成R的元素中,除Ti之外元素的电负性从大到小的顺序是(填元素符号)。 (5)、硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图所示,该晶胞中硒原子的配位数为;若该晶胞边长为a pm,NA代表阿伏加德罗常数的值,则晶胞密度为。
(5)、硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图所示,该晶胞中硒原子的配位数为;若该晶胞边长为a pm,NA代表阿伏加德罗常数的值,则晶胞密度为。 25. 间氨基苯乙炔(K)是新型抗肿瘤药物盐酸厄洛替尼的关键中间体。用苯为原料的合成路线之一如图所示:
25. 间氨基苯乙炔(K)是新型抗肿瘤药物盐酸厄洛替尼的关键中间体。用苯为原料的合成路线之一如图所示: (1)、化合物B的化学名称为;化合物C的结构简式为。(2)、D→E的反应类型为 , 化合物K中所含官能团名称为。(3)、F→G反应的化学方程式为(注明反应的具体条件)。(4)、G的同分异构体中,满足下列条件的同分异构体有种。
(1)、化合物B的化学名称为;化合物C的结构简式为。(2)、D→E的反应类型为 , 化合物K中所含官能团名称为。(3)、F→G反应的化学方程式为(注明反应的具体条件)。(4)、G的同分异构体中,满足下列条件的同分异构体有种。①与G含有相同的官能团
②属于二取代芳香族化合物
写出其中核磁共振氢谱有4种峰,其峰值面积比为1∶2∶2∶2的所有结构简式:。
(5)、设计由 、乙醛、无水乙醚和本题合成路线中的无机试剂制备
、乙醛、无水乙醚和本题合成路线中的无机试剂制备 的合成路线:(合成需要四步)。
的合成路线:(合成需要四步)。
-