浙江省精诚联盟2022-2023学年高二上学期开学联考化学试题
试卷更新日期:2022-09-26 类型:开学考试
一、单选题
-
1. 下列物质中,含有共价键的盐是( )A、 B、 C、 D、2. 下列物质属于非电解质的是( )A、 B、 C、 D、医用酒精3. 在粗盐提纯实验中用不到的仪器是( )A、
 B、
B、 C、
C、 D、
D、 4. 北京冬奥会成功举办、“天宫课堂”如期开讲及“华龙一号”核电海外投产等,均展示了我国科技发展的巨大成就。下列相关叙述正确的是( )A、冬奥会“飞扬”火炬所用的燃料H2为氧化性气体 B、冬奥会短道速滑服使用的超高分子聚乙烯属于天然有机高分子材料 C、乙酸钠过饱和溶液析出晶体并放热的过程仅涉及化学变化 D、核电站反应堆所用轴棒中含有的与互为同位素5. 下列化学用语正确的是( )A、乙醇的空间填充模型:
4. 北京冬奥会成功举办、“天宫课堂”如期开讲及“华龙一号”核电海外投产等,均展示了我国科技发展的巨大成就。下列相关叙述正确的是( )A、冬奥会“飞扬”火炬所用的燃料H2为氧化性气体 B、冬奥会短道速滑服使用的超高分子聚乙烯属于天然有机高分子材料 C、乙酸钠过饱和溶液析出晶体并放热的过程仅涉及化学变化 D、核电站反应堆所用轴棒中含有的与互为同位素5. 下列化学用语正确的是( )A、乙醇的空间填充模型: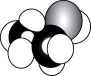 B、的结构示意图:
B、的结构示意图: C、次溴酸的结构式:H-Br-O
D、用电子式表示的形成过程:
C、次溴酸的结构式:H-Br-O
D、用电子式表示的形成过程: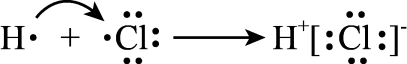 6. 下列说法错误的是( )A、蜡烛中石蜡的主要成分是含碳原子数较多的烯烃 B、工业上常用电解熔态氧化铝来冶炼金属铝 C、煤的液化、石油的裂化和油脂的皂化都属于化学变化 D、非处方药不需要凭医生处方,消费者可自行购买和使用,其包装上有“”标识7. 下列说法正确的是( )A、和是同种物质 B、足球烯和纳米碳管互为同分异构体 C、冰和干冰互为同素异形体 D、硬脂酸和乙酸互为同系物8. 下列说法错误的是( )A、液氨气化时吸收大量的热,因此液氨可用作制冷剂 B、钠的导电性好,所以液态钠可用作核反应堆的传热介质 C、不锈钢是最常见的一种合金钢,可制造医疗器械、厨房用具和餐具等 D、5G网络的普及加快了信息传递的速度,光导纤维的主要成分是二氧化硅9. 下列说法正确的是( )A、制备玻璃的主要原料是黏土、石灰石 B、实验室中可通过加热氯化铵固体制取氨气 C、海水淡化的方法主要有蒸馏法、电渗析法和离子交换法等 D、常温下,可以用铝罐贮存浓硫酸和浓硝酸,说明铝与浓硫酸和浓硝酸不反应10. 关于反应 , 下列说法正确的是( )A、既是氧化产物又是还原产物 B、氧化剂与还原剂的物质的量之比为3∶1 C、该反应中被NO氧化的O3占消耗掉O3的1/4 D、反应时转移电子数为11. 硫及其化合物的分类与相应硫元素的化合价关系如图所示。下列说法正确的是( )
6. 下列说法错误的是( )A、蜡烛中石蜡的主要成分是含碳原子数较多的烯烃 B、工业上常用电解熔态氧化铝来冶炼金属铝 C、煤的液化、石油的裂化和油脂的皂化都属于化学变化 D、非处方药不需要凭医生处方,消费者可自行购买和使用,其包装上有“”标识7. 下列说法正确的是( )A、和是同种物质 B、足球烯和纳米碳管互为同分异构体 C、冰和干冰互为同素异形体 D、硬脂酸和乙酸互为同系物8. 下列说法错误的是( )A、液氨气化时吸收大量的热,因此液氨可用作制冷剂 B、钠的导电性好,所以液态钠可用作核反应堆的传热介质 C、不锈钢是最常见的一种合金钢,可制造医疗器械、厨房用具和餐具等 D、5G网络的普及加快了信息传递的速度,光导纤维的主要成分是二氧化硅9. 下列说法正确的是( )A、制备玻璃的主要原料是黏土、石灰石 B、实验室中可通过加热氯化铵固体制取氨气 C、海水淡化的方法主要有蒸馏法、电渗析法和离子交换法等 D、常温下,可以用铝罐贮存浓硫酸和浓硝酸,说明铝与浓硫酸和浓硝酸不反应10. 关于反应 , 下列说法正确的是( )A、既是氧化产物又是还原产物 B、氧化剂与还原剂的物质的量之比为3∶1 C、该反应中被NO氧化的O3占消耗掉O3的1/4 D、反应时转移电子数为11. 硫及其化合物的分类与相应硫元素的化合价关系如图所示。下列说法正确的是( ) A、葡萄酒中添加适量c可以起到杀菌和抗氧化的作用 B、工业制备f的最后一步是用水吸收d C、将c通入紫色石蕊试液中,溶液先变红后褪色 D、可用f的浓溶液干燥a12. 下列说法错误的是( )A、制备有毒气体时,在通风橱内进行 B、向正在燃烧的酒精灯添加酒精 C、实验时将剩余的钠及时放回原试剂瓶 D、对于含重金属(如铅、汞或镉)离子的废液,可利用沉淀法进行处理13. 下列反应的离子方程式书写正确的是( )A、向明矾的水溶液中滴加溶液至完全沉淀: B、碳酸钙与醋酸反应: C、向溴化亚铁溶液中通入足量的氯气 D、室温下用稀溶解铜:14. 设表示阿伏加德罗常数的值。下列叙述正确的是( )A、60g乙酸与足量乙醇发生酯化反应,充分反应后生成的乙酸乙酯分子数目为 B、常温下,18g重水含有中子数为9 C、蔗糖溶液中所含分子数为 D、标准状况下,中含有键的数目为15. 下列说法错误的是( )A、棉花、羊毛、蚕丝等天然纤维的成分都是纤维素 B、疫苗一般应冷藏存放,以避免蛋白质变性 C、植物油通过催化加氢可转变为氢化油 D、在一定条件下,氨基酸之间能发生聚合反应,生成更为复杂的多肽16. 阿司匹林是一种重要的合成药物,具有解热镇痛作用。其结构简式如图,下列说法错误的是( )
A、葡萄酒中添加适量c可以起到杀菌和抗氧化的作用 B、工业制备f的最后一步是用水吸收d C、将c通入紫色石蕊试液中,溶液先变红后褪色 D、可用f的浓溶液干燥a12. 下列说法错误的是( )A、制备有毒气体时,在通风橱内进行 B、向正在燃烧的酒精灯添加酒精 C、实验时将剩余的钠及时放回原试剂瓶 D、对于含重金属(如铅、汞或镉)离子的废液,可利用沉淀法进行处理13. 下列反应的离子方程式书写正确的是( )A、向明矾的水溶液中滴加溶液至完全沉淀: B、碳酸钙与醋酸反应: C、向溴化亚铁溶液中通入足量的氯气 D、室温下用稀溶解铜:14. 设表示阿伏加德罗常数的值。下列叙述正确的是( )A、60g乙酸与足量乙醇发生酯化反应,充分反应后生成的乙酸乙酯分子数目为 B、常温下,18g重水含有中子数为9 C、蔗糖溶液中所含分子数为 D、标准状况下,中含有键的数目为15. 下列说法错误的是( )A、棉花、羊毛、蚕丝等天然纤维的成分都是纤维素 B、疫苗一般应冷藏存放,以避免蛋白质变性 C、植物油通过催化加氢可转变为氢化油 D、在一定条件下,氨基酸之间能发生聚合反应,生成更为复杂的多肽16. 阿司匹林是一种重要的合成药物,具有解热镇痛作用。其结构简式如图,下列说法错误的是( ) A、分子式为 B、分子中含有3个碳碳双键 C、能与溶液反应 D、分子中所有原子不可能处于同一平面17. 短周期主族元素X、Y、Z、W的原子序数依次增大,X、Y、W的原子核外最外层电子数为互不相等的偶数,X原子的最外层电子数是其内层电子总数的3倍,W元素在地壳中的含量位居第二,Z的单质是目前使用量最大的主族金属元素。下列叙述正确的是( )A、元素W的氧化物既能与酸反应,又能与碱反应,因此属于两性氧化物 B、元素Y的单质与空气中均可反应,且产物中不可能有单质 C、最简单氢化物的稳定性: D、简单离子半径大小顺序:18. 已知某反应中能量变化如图所示,下列叙述正确的是( )
A、分子式为 B、分子中含有3个碳碳双键 C、能与溶液反应 D、分子中所有原子不可能处于同一平面17. 短周期主族元素X、Y、Z、W的原子序数依次增大,X、Y、W的原子核外最外层电子数为互不相等的偶数,X原子的最外层电子数是其内层电子总数的3倍,W元素在地壳中的含量位居第二,Z的单质是目前使用量最大的主族金属元素。下列叙述正确的是( )A、元素W的氧化物既能与酸反应,又能与碱反应,因此属于两性氧化物 B、元素Y的单质与空气中均可反应,且产物中不可能有单质 C、最简单氢化物的稳定性: D、简单离子半径大小顺序:18. 已知某反应中能量变化如图所示,下列叙述正确的是( ) A、该图像可用于表示所有分解反应的能量变化情况 B、因生成物的总能量高于反应物的总能量,故该反应需加热才能发生 C、固体与反应的能量变化趋势与该图示一致 D、反应过程中形成新化学键放出的总能量大于断裂旧化学键吸收的总能量19. 下列“类比”合理的是( )A、Na与水反应生成 , 则与水蒸气反应生成 B、能与溶液反应,则也能与溶液反应 C、与反应生成和 , 则与反应生成和 D、镁、铝、稀硫酸组成原电池时镁作负极,则镁、铝、溶液组成原电池时镁也作负极20. 化学与人类生活、生产和社会可持续发展密切相关,下列说法错误的是( )A、利用“侯氏联合制碱法”制备纯碱 B、绿色化学倡导从源头减少或消除环境污染 C、福尔马林是一种良好的杀菌剂,常用于制作生物标本和饮用水消毒 D、化石燃料的脱硫脱氮、的回收利用和的催化转化都是减少酸雨产生的措施21. 探究化学反应中的能量转化,实验装置(装置中的试剂及用量完全相同)及实验数据如下(注:注射器用于收集气体并读取气体体积)。
A、该图像可用于表示所有分解反应的能量变化情况 B、因生成物的总能量高于反应物的总能量,故该反应需加热才能发生 C、固体与反应的能量变化趋势与该图示一致 D、反应过程中形成新化学键放出的总能量大于断裂旧化学键吸收的总能量19. 下列“类比”合理的是( )A、Na与水反应生成 , 则与水蒸气反应生成 B、能与溶液反应,则也能与溶液反应 C、与反应生成和 , 则与反应生成和 D、镁、铝、稀硫酸组成原电池时镁作负极,则镁、铝、溶液组成原电池时镁也作负极20. 化学与人类生活、生产和社会可持续发展密切相关,下列说法错误的是( )A、利用“侯氏联合制碱法”制备纯碱 B、绿色化学倡导从源头减少或消除环境污染 C、福尔马林是一种良好的杀菌剂,常用于制作生物标本和饮用水消毒 D、化石燃料的脱硫脱氮、的回收利用和的催化转化都是减少酸雨产生的措施21. 探究化学反应中的能量转化,实验装置(装置中的试剂及用量完全相同)及实验数据如下(注:注射器用于收集气体并读取气体体积)。
项目
时间/
装置①
装置②
气体体积/
溶液温度/
气体体积/
溶液温度/
0
0
22.0
0
22.0
8.5
30
24.8
50
23.8
10.5
50
26.0
-
-
下列说法错误的是( )
A、装置②中的Cu表面有气泡产生,而装置①中的Cu表面无气泡 B、装置①和②中发生反应的离子方程式都为: C、原电池反应能加快化学反应速率,导致装置①中反应的平均速率比装置②中的小 D、由实验数据可知,原电池的化学能全部转化为电能22. 下列说法正确的是( )A、与水反应过程中,有共价键的断裂和形成 B、所有烷烃分子内都含有极性共价键和非极性共价键 C、和的水溶液都能导电,所以它们都属于离子化合物 D、和的分子结构中,每个原子最外层都具有8电子稳定结构23. 恒温恒容的密闭容器中,在某催化剂表面上发生氨的分解反应: , 测得不同起始浓度和催化剂表面积下氨浓度随时间的变化,如下表所示,下列说法错误的是( )编号

0
20
40
60
80
①
a
2.40
2.00
1.60
1.20
0.80
②
a
1.20
0.80
0.40
③
2.40
1.60
0.80
0.40
0.40
A、实验①, , B、由实验数据可知相同条件下,增加氨的浓度,该反应速率一定增大 C、由实验数据可知,相同条件下,减小催化剂的表面积,该反应速率减小 D、实验③达到平衡后,N2的体积分数约为22.7%24. 由含硒废料(主要含等)制取硒的流程如图:
下列有关说法错误的是( )
A、“分离”时得到含硫煤油的方法是过滤 B、“酸溶”时能除去废料中的全部氧化物杂质 C、“浸取”发生反应的化学方程式为: D、“酸化”的离子反应为:25. 下列各实验操作、现象及所得结论都正确的是( )选项
实验操作
现象
结论
A
用玻璃棒蘸取某无色溶液进行焰色试验
焰色呈黄色
溶液中含有钠元素
B
向黄色的溶液中滴加氢碘酸(水溶液),再滴入几滴淀粉溶液
溶液变为蓝色
氧化性:
C
向溶液中加入稀硫酸,将产生的气体直接通入硅酸钠溶液中
产生白色浑浊
非金属性:
D
纯锌与稀硫酸反应时,向溶液中滴入几滴溶液
产生气泡的速度加快
是锌与稀硫酸反应的催化剂
A、A B、B C、C D、D二、填空题
-
26. 请按要求填空:(1)、乙醛的结构简式是。(2)、钠投入乙醇中发生反应的化学方程式是。(3)、饱和碳酸钠溶液中通入足量气体,反应的离子方程式是。(4)、研究表明,通过碘循环系统(如图)可以吸收工业废气中的制备一种重要的化工原料A,同时完成氢能源再生。则整个系统反应的总方程式为。

三、综合题
-
27. 化合物X(仅含两种元素)可通过淡黄色固体单质甲与浊液共热的方法来制备,为探究X的组成和性质,设计并完成如下实验(流程图中部分产物已经略去)。

已知:气体乙在标准状况下的密度为;气体丙是无色、有刺激性的气味,可用于漂白纸浆等物质。
请回答:
(1)、写出组成X的元素符号 , 乙的电子式。(2)、X与足量盐酸反应的化学方程式为。(3)、气体丙与溶液反应的离子方程式为。(4)、请设计实验方案检验溶液丁中的金属阳离子。28. 某研究性学习小组在实验室中利用下图装置(部分装置省略)制备和 , 并探究二者氧化性的强弱。
请回答:
(1)、组装好仪器后,应先(填操作),再加入试剂进行实验。(2)、a中的反应,体现了酸性和(填“氧化”或“还原”)性,b的作用是。(3)、c、d反应条件及产物差异说明氯气与碱反应的规律是 , c中反应的离子方程式是。(4)、e中可选用试剂是____(填标号)。A、 B、 C、 D、(5)、取少量和溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变,2号试管溶液变为棕色。可知,该条件下的氧化能力(填“大于”或“小于”)。29. 烃A是D的同系物,C是一种高分子化合物。由A和D为原料合成F(丙烯酸乙酯)的转化关系如下。
请回答:
(1)、A的分子式是 , A生成B的反应类型是。(2)、E所含官能团的名称是。(3)、B与E反应生成F的化学方程式是。(4)、下列说法正确的是____。A、等质量的C和D完全燃烧消耗氧气的质量相等 B、碳酸钠溶液中滴加少量E可产生能使澄清石灰水变浑浊的气体 C、仅用水无法鉴别B和F D、丙烯酸乙酯具有香味,能使酸性溶液褪色 E、工业上通常由石油的裂化生产A(5)、有机物G是比F多2个氢原子的酯类物质,它可在酸性条件下水解,且水解产物之一是食醋的主要成分。写出满足上述条件的有机物G的可能结构简式。(6)、F发生加聚反应的化学方程式是。30. 中国力争2030年前实现碳达峰。CO2催化加氢制甲醇,有利于减少温室气体CO2排放。某温度下,CO2加氢制甲醇的总反应为。在体积为的密闭容器中,充入和 , 测得的物质的量随时间变化如图。 (1)、末时,(填“>”、“<”或“=”)。(2)、在恒温恒容条件下,能说明该反应已达平衡状态的是____。A、CO2体积分数保持不变 B、容器中浓度与浓度之比为1∶1 C、容器中气体压强保持不变 D、混合气体的密度保持不变 E、的生成速率是生成速率的3倍(3)、请在图中画出从反应开始到时混合气体平均摩尔质量随时间的变化趋势图(无须计算数值)。
(1)、末时,(填“>”、“<”或“=”)。(2)、在恒温恒容条件下,能说明该反应已达平衡状态的是____。A、CO2体积分数保持不变 B、容器中浓度与浓度之比为1∶1 C、容器中气体压强保持不变 D、混合气体的密度保持不变 E、的生成速率是生成速率的3倍(3)、请在图中画出从反应开始到时混合气体平均摩尔质量随时间的变化趋势图(无须计算数值)。 (4)、甲醇是优质的清洁燃料,可制作碱性甲醇燃料电池,工作原理如图所示。电极A的反应式为。
(4)、甲醇是优质的清洁燃料,可制作碱性甲醇燃料电池,工作原理如图所示。电极A的反应式为。
四、计算题
-
31. 完成下列问题。(1)、已知完全断裂物质的量均为1mol的中的化学键时吸收能量分别为。则在该条件下,与完全反应会(填“吸收”或“放出”)能量。(2)、将和的混合粉末完全溶于盐酸中,生成标准状况下(假设气体被完全收集);反应后的溶液中滴入2滴溶液后不显血红色。请通过分析计算回答:
①则混合粉末中Fe的物质的量是mol;
②若在反应后的混合液中加入锌,则理论上最多可溶解锌的质量是g。
-