辽宁省六校2022-2023学年高二上学期期初考试化学试题
试卷更新日期:2022-09-26 类型:开学考试
一、单选题
-
1. 化学与人类的生产、生活息息相关,下列说法正确的是( )A、绿色化学的核心是对环境污染进行综合治理 B、“温室效应”“酸雨”的形成都与氮氧化合物有关 C、高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路” D、汽车的排气管。上装有“催化转化器”,使有毒的CO和NO反应生成和2. 下列反应对应的离子方程式能用“”表示的是( )A、醋酸和氢氧化钠溶液反应 B、氢氧化镁和盐酸反应 C、硫酸氢钠和氢氧化钾溶液的反应 D、氢氧化钡和稀硫酸反应3. 若NA表示阿伏加德罗常数的值,下列叙述正确的是( )
①标准状况下,2.24L四氯化碳含碳原子数为0.1NA
②标准状况下,aL氧气和氮气的混合气含有的分子数约为aNA/22.4
③1mol/L Mg(NO3)2溶液中含有NO3-的数目为2NA
④同温同压下,体积相同的氢气和氩气所含的原子数相等
⑤46gNO2和N2O4混合气体中含有原子数为3NA
⑥1 L 0.5 mol·L−1 Na2SO4溶液中,含有的氧原子总数为2NA
A、②⑥ B、②⑤ C、②③ D、②③⑥4. 莽草酸可作为抗病毒、抗癌药物中间体,天然存在于木兰科植物八角等的干燥成熟果实中,结构简式见图,下列关于该有机物的说法正确的是( )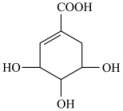 A、分子中含有两种官能团 B、该有机物能与发生反应 C、在水溶液中,羧基和羟基均能电离出H+ D、该有机物能发生取代反应、加成反应、氧化反应和加聚反应5. 门捷列夫在描述元素周期表时,许多元素尚未发现,但他为第四周期的三种元素留下了空位,并对它们的一些性质做了预测,X是其中的一种“类硅”元素,后来被德国化学家文克勒发现,并证实门捷列夫当时的预测相当准确。根据元素周期律,下列有关X性质的描述中错误的是:( )A、X单质不易与水反应 B、XO2可被碳或氢还原为X C、XCl4的沸点比SiCl4的高 D、XH4的稳定性比SiH4的高6. 下列实验操作或者结论正确的是( )A、配制一定物质的量浓度的溶液时,容量瓶必须洁净、干燥,使用前还要检验是否漏水 B、实验室配制100.0 g,20%的氯化钠溶液,可取20.0 g的NaCl于烧杯中,再加入80.0 mL的水,充分搅拌后即可 C、实验室里需要480 mL 2.0 mol·L-1的氢氧化钠溶液,配制溶液时先称量氢氧化钠固体38.4 g,然后再按照溶解、冷却、移液、定容、摇匀等步骤进行操作 D、实验室配制500 mL 0.2 mol·L-1的硫酸亚铁溶液,如果在称量时把砝码和硫酸亚铁固体放反(其他操作都符合题意),则最终溶液浓度会偏大7. 下列关于∆H的判断正确的是( )
A、分子中含有两种官能团 B、该有机物能与发生反应 C、在水溶液中,羧基和羟基均能电离出H+ D、该有机物能发生取代反应、加成反应、氧化反应和加聚反应5. 门捷列夫在描述元素周期表时,许多元素尚未发现,但他为第四周期的三种元素留下了空位,并对它们的一些性质做了预测,X是其中的一种“类硅”元素,后来被德国化学家文克勒发现,并证实门捷列夫当时的预测相当准确。根据元素周期律,下列有关X性质的描述中错误的是:( )A、X单质不易与水反应 B、XO2可被碳或氢还原为X C、XCl4的沸点比SiCl4的高 D、XH4的稳定性比SiH4的高6. 下列实验操作或者结论正确的是( )A、配制一定物质的量浓度的溶液时,容量瓶必须洁净、干燥,使用前还要检验是否漏水 B、实验室配制100.0 g,20%的氯化钠溶液,可取20.0 g的NaCl于烧杯中,再加入80.0 mL的水,充分搅拌后即可 C、实验室里需要480 mL 2.0 mol·L-1的氢氧化钠溶液,配制溶液时先称量氢氧化钠固体38.4 g,然后再按照溶解、冷却、移液、定容、摇匀等步骤进行操作 D、实验室配制500 mL 0.2 mol·L-1的硫酸亚铁溶液,如果在称量时把砝码和硫酸亚铁固体放反(其他操作都符合题意),则最终溶液浓度会偏大7. 下列关于∆H的判断正确的是( )S(s)+O2(g)=SO2(g) ∆H1
S(g)+O2(g)=SO2(g) ∆H2
∆H3
∆H4
A、∆H1<0,∆H2<0,且∆H1<∆H2 B、∆H1>∆H2 C、∆H3<0,∆H4>0 D、∆H3>∆H48. 根据所给的实验装置,下列有关实验的相关叙述正确的是( ) A、实验室可以用装置甲和药品来制取氨气 B、利用装置乙定量测定锌和稀硫酸反应的化学反应速率 C、在装置丙实验过程中,把温度计上的酸冲洗干净后再测量氢氧化钠溶液的温度 D、将装置丁中浓盐酸换成浓硫酸时现象相同9. 已知:①2H2O(g)=2H2(g)+O2(g) ΔH=+483.6 kJ·mol-1 ②H2S(g)=H2(g)+S(g) ΔH=+20.1 kJ·mol-1下列判断正确的是( )A、氢气的燃烧热:ΔH=-241.8 kJ·mol-1 B、相同条件下,充分燃烧1 mol H2(g)与1 mol S(g)的混合物比充分燃烧1 mol H2S(g)放热多20.1 kJ C、由①②知,水的热稳定性小于硫化氢 D、②中若生成固态硫,ΔH将增大10. “绿水青山就是金山银山”,当前氮的氧化物的污染日趋严重,某企业处理该污染物的原理设计为燃料电池如图所示。在处理过程中石墨Ⅰ电极上生成氧化物Y,Y 可循环使用。下列说法错误的是( )
A、实验室可以用装置甲和药品来制取氨气 B、利用装置乙定量测定锌和稀硫酸反应的化学反应速率 C、在装置丙实验过程中,把温度计上的酸冲洗干净后再测量氢氧化钠溶液的温度 D、将装置丁中浓盐酸换成浓硫酸时现象相同9. 已知:①2H2O(g)=2H2(g)+O2(g) ΔH=+483.6 kJ·mol-1 ②H2S(g)=H2(g)+S(g) ΔH=+20.1 kJ·mol-1下列判断正确的是( )A、氢气的燃烧热:ΔH=-241.8 kJ·mol-1 B、相同条件下,充分燃烧1 mol H2(g)与1 mol S(g)的混合物比充分燃烧1 mol H2S(g)放热多20.1 kJ C、由①②知,水的热稳定性小于硫化氢 D、②中若生成固态硫,ΔH将增大10. “绿水青山就是金山银山”,当前氮的氧化物的污染日趋严重,某企业处理该污染物的原理设计为燃料电池如图所示。在处理过程中石墨Ⅰ电极上生成氧化物Y,Y 可循环使用。下列说法错误的是( ) A、该电池放电时电子流动的方向是:石墨Ⅰ电极→负载→石墨Ⅱ电极→熔融NaNO3→石墨Ⅰ电极 B、石墨Ⅱ附近发生的反应:O2+4e-+2N2O5= 4NO3- C、O2在石墨Ⅱ附近发生还原反应,Y 为N2O5 D、相同条件下,放电过程中消耗的NO2和O2的体积比为4∶111. N2O和CO可在催化剂 (Pt2O+)表面转化为无害气体,其反应原理为: , 下列有关该反应说法正确的是( )A、催化剂能改变反应的∆H B、通入过量CO,可使N2O转化率达100% C、保持温度和容器体积不变,通入He增大压强,反应速率不变 D、保持温度和压强不变,通入He反应速率不变12. 乳酸(
A、该电池放电时电子流动的方向是:石墨Ⅰ电极→负载→石墨Ⅱ电极→熔融NaNO3→石墨Ⅰ电极 B、石墨Ⅱ附近发生的反应:O2+4e-+2N2O5= 4NO3- C、O2在石墨Ⅱ附近发生还原反应,Y 为N2O5 D、相同条件下,放电过程中消耗的NO2和O2的体积比为4∶111. N2O和CO可在催化剂 (Pt2O+)表面转化为无害气体,其反应原理为: , 下列有关该反应说法正确的是( )A、催化剂能改变反应的∆H B、通入过量CO,可使N2O转化率达100% C、保持温度和容器体积不变,通入He增大压强,反应速率不变 D、保持温度和压强不变,通入He反应速率不变12. 乳酸(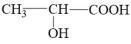 )成为近年来研究热点之一。下列说法错误的是( ) A、乳酸的分子式为C3H6O3 B、1 mol乳酸分别与足量Na和NaHCO3反应产生的气体物质的量之比为2:1 C、乳酸既可以与乙醇又可以与乙酸发生酯化反应 D、乳酸可与铁粉反应制备补铁剂13. 分子式C5H12O的同分异构体中,能与金属钠反应生成氢气,又能被氧化为醛有
)成为近年来研究热点之一。下列说法错误的是( ) A、乳酸的分子式为C3H6O3 B、1 mol乳酸分别与足量Na和NaHCO3反应产生的气体物质的量之比为2:1 C、乳酸既可以与乙醇又可以与乙酸发生酯化反应 D、乳酸可与铁粉反应制备补铁剂13. 分子式C5H12O的同分异构体中,能与金属钠反应生成氢气,又能被氧化为醛有 ( ) A、种 B、种 C、种 D、种14. 下列有关烷烃的叙述中,正确的是( )
( ) A、种 B、种 C、种 D、种14. 下列有关烷烃的叙述中,正确的是( )①在烷烃分子中,所有的化学键都是单键
②烷烃中除甲烷外,很多都能使酸性KMnO4溶液的紫色褪去
③分子通式为CnH2n+2的烃不一定是烷烃
④所有的烷烃在光照条件下都能与氯气发生取代反应
⑤光照条件下,乙烷通入溴水中,可使溴水褪色.
A、①③⑤ B、②③ C、①④ D、①②④15. 向绝热恒容的密闭容器中,加入足量的碳和一定量NO,发生如下反应 , 测得CO2浓度随时间变化如表,下列说法正确的是( )反应时间/s
CO2浓度
A、该反应100s后才到达平衡 B、用来表示反应的速率为 C、达到平衡状态时, D、混合气体的压强不再随时间变化而变化,该反应一定达到了平衡状态二、综合题
-
16. 高纯二氧化硅可用来制造光纤。某蛇纹石的成分见下表:
组分
SiO2
MgO
Na2O
K2O
Fe2O3
质量分数/%
59.20
38.80
0.25
0.50
0.8
通过下图流程可由蛇纹石制备较纯净的二氧化硅。
 (1)、蛇纹石中涉及的可溶性金属氧化物有(写化学式)。(2)、步骤①中涉及SiO2反应的离子方程式为。(3)、滤渣的成分有(填化学式)。(4)、步骤②中洗涤沉淀的方法是(5)、步骤③反应的化学方程式为;实验室进行步骤③需要用到的主要仪器有、泥三角、酒精灯和17. 某同学为了验证Fe3+是否能将H2SO3氧化成 , 用50mL0.1mol∙L-1FeCl3溶液吸收制取SO2气体的尾气后,进行以下实验:(1)、取少量样品溶液于试管中,先滴入足量的稀盐酸,再滴入氯化钡溶液,如果有白色沉淀生成,由此证据可证明Fe3+能够把H2SO3氧化成。(2)、由此可写出该反应的化学方程式为 , 反应中的氧化产物是(写化学式)。(3)、该同学为了探究吸收液中其他成分(Fe3+、Fe2+、H2SO3)的可能组合进行了以下探究:
(1)、蛇纹石中涉及的可溶性金属氧化物有(写化学式)。(2)、步骤①中涉及SiO2反应的离子方程式为。(3)、滤渣的成分有(填化学式)。(4)、步骤②中洗涤沉淀的方法是(5)、步骤③反应的化学方程式为;实验室进行步骤③需要用到的主要仪器有、泥三角、酒精灯和17. 某同学为了验证Fe3+是否能将H2SO3氧化成 , 用50mL0.1mol∙L-1FeCl3溶液吸收制取SO2气体的尾气后,进行以下实验:(1)、取少量样品溶液于试管中,先滴入足量的稀盐酸,再滴入氯化钡溶液,如果有白色沉淀生成,由此证据可证明Fe3+能够把H2SO3氧化成。(2)、由此可写出该反应的化学方程式为 , 反应中的氧化产物是(写化学式)。(3)、该同学为了探究吸收液中其他成分(Fe3+、Fe2+、H2SO3)的可能组合进行了以下探究:①提出假设。
假设1:溶液中存在Fe2+。
假设2:溶液中存在Fe3+、Fe2+。
假设3:溶液中存在。
②设计方案,进行实险,验证假设。请写出实验步骤以及预期现象和结论(可不填满)。限选实验试剂和仪器:试管、滴管、0.1mol∙L-1KMnO4溶液、0.1mol∙L-1KSCN溶液、品红稀溶液。
已知:H2SO3可使品红溶液由红色变为无色。
实验步骤
预期现象和结论
步骤1:用试管取样品溶液2~3mL,并滴入
若出现红色,则假设2成立,假设1、3不成立;若未出现红色,则假设2不成立,假设1或3成立
步骤2:
三、综合题
-
18.(1)、I.某研究性学习小组的同学对Zn、Cu、稀硫酸组成的原电池进行了探究,其中甲同学利用如图所示装置进行探究,乙同学经过查阅资料后设计了图装置进行探究(盐桥内含有某种电解质的饱和溶液,起到连通电路的作用)。

实验表明,图中铜电极上有气泡产生,说明反应中有一部分化学能转化为能。锌电极为极(填写“正”或“负”),电极反应为:。
(2)、图中实验过程中只有极上产生气泡,则是溶液,正极上的电极反应式为。(3)、当图装置中的溶液质量增加时,生成氢气L(标准状况);当图中锌电极的质量减少时,电路中转移的电子为(4)、II.已知反应:已知下列数据:
化学键
断裂化学键吸收的能量kJ/mol
若反应生成(释放或者吸收)能量。
(5)、在一定温度下,向密闭容器中充入达到平衡,平衡时,测得的体积分数为。内,的平均反应速率为 , 平衡时的转化率为。19. 有机化合物、、、、间的转化关系如下图。气体在标准状况下的密度为是一种有机高分子材料。
已知:2R-COOH+2CH2=CH22R-COO-CH=CH2+2H2O
请回答:
(1)、写出中官能团的名称。(2)、B在一定的条件下可转化为 , 其反应类型为。(3)、由葡萄糖制的化学方程式为。(4)、下列说法正确的是。a.可用碳酸钠鉴别、、
b.、、都能与溴水反应使其褪色
分子中所有原子都在同一个平面上,通过加聚反应可制得塑料
葡萄糖可由淀粉或纤维素水解制得,可用新制氢氧化铜检验葡萄糖的生成
(5)、写出葡萄糖的结构简式。