江西省省重点校联盟2022-2023学年高二上学期入学联考化学试题
试卷更新日期:2022-09-26 类型:开学考试
一、单选题
-
1. 资源、能源、材料、环保、健康、安全等是当今社会重要的研究课题,下列说法错误的是( )A、当前,新能源使用量已超过化石能源,成为人类使用的主要能源 B、合理施用化肥和农药是保障农作物增产、减少农作物损失的重要措施 C、处方药需要凭医生处方才能从药房或药店获得,并要在医生的指导下使用 D、在规定范围内合理使用食品添加剂,一般对人体健康不会产生不良影响2. 第24届冬奥会于2月4日-2月20日在北京举行,我国冰雪健儿获得9枚金牌;该届奥运金牌采用金镶玉工艺制作,奖牌挂带采用传统桑蚕丝织造,奖牌正面浅刻装饰纹样,其中冰雪纹表现了冬奥会的特征,祥云纹传达了吉祥的寓意。下列说法错误的是( )
 A、金牌的主要成分金和玉都属于无机物 B、制作金牌挂带的桑蚕丝属于天然有机物 C、祥云纹中涉及的云会产生丁达尔现象 D、冰雪纹中提到的雪属于纯净物3. 航天员王亚平在太空授课时,用一根粘有结晶核的棉棒触碰失重的过饱和醋酸钠溶液小球,使其迅速结晶为发热的结晶球。下列说法错误的是( )
A、金牌的主要成分金和玉都属于无机物 B、制作金牌挂带的桑蚕丝属于天然有机物 C、祥云纹中涉及的云会产生丁达尔现象 D、冰雪纹中提到的雪属于纯净物3. 航天员王亚平在太空授课时,用一根粘有结晶核的棉棒触碰失重的过饱和醋酸钠溶液小球,使其迅速结晶为发热的结晶球。下列说法错误的是( ) A、形成结晶球是一个放热过程 B、过饱和醋酸钠溶液属于电解质 C、醋酸与碳酸钠反应可生成醋酸钠 D、醋酸钠晶体中存在离子键、共价键4. 设NA表示阿伏加德罗常数的值。下列说法正确的是( )A、标准状况下,11.2 LC2H5OH中含-OH,数目为0.5NA B、1 L0.2 mol/LNaHCO3溶液中,H+的数目为0.2NA C、常温常压下,31g白磷(P4)中含P-P键的数目为1.5NA D、1 mol浓硝酸与足量铜反应转移电子的数目为0.5NA5. 关于非金属元素及其化合物的性质,下列说法正确的是( )A、SiO2既能与HF反应又能与NaOH溶液反应,因此为两性氧化物 B、工业上可用浓氨水检验氯气管道是否泄漏 C、S与足量的O2反应可生成SO3 D、因为海水中氯的含量高,所以氯被称为“海洋元素”6. 下列化学反应对应的离子方程式正确的是( )A、向溶液中滴入少量盐酸: B、向溶液中滴入过量氨水: C、用醋酸清除水壶中的水垢: D、在澄清石灰水中加入足量:7. 几种短周期元素的原子半径及主要化合价如表所示:
A、形成结晶球是一个放热过程 B、过饱和醋酸钠溶液属于电解质 C、醋酸与碳酸钠反应可生成醋酸钠 D、醋酸钠晶体中存在离子键、共价键4. 设NA表示阿伏加德罗常数的值。下列说法正确的是( )A、标准状况下,11.2 LC2H5OH中含-OH,数目为0.5NA B、1 L0.2 mol/LNaHCO3溶液中,H+的数目为0.2NA C、常温常压下,31g白磷(P4)中含P-P键的数目为1.5NA D、1 mol浓硝酸与足量铜反应转移电子的数目为0.5NA5. 关于非金属元素及其化合物的性质,下列说法正确的是( )A、SiO2既能与HF反应又能与NaOH溶液反应,因此为两性氧化物 B、工业上可用浓氨水检验氯气管道是否泄漏 C、S与足量的O2反应可生成SO3 D、因为海水中氯的含量高,所以氯被称为“海洋元素”6. 下列化学反应对应的离子方程式正确的是( )A、向溶液中滴入少量盐酸: B、向溶液中滴入过量氨水: C、用醋酸清除水壶中的水垢: D、在澄清石灰水中加入足量:7. 几种短周期元素的原子半径及主要化合价如表所示:元素代号
X
Y
Z
W
原子半径/pm
186
160
75
74
主要化合价
+1
+2
+5、-3
-2
下列叙述正确的是( )
A、X、Y的最高价氧化物对应水化物的碱性:X<Y B、简单离子半径:Z<W<X<Y C、X与W形成的某种化合物可作呼吸面具的供氧剂 D、Y与Z形成的化合物为共价化合物8. 关于如图所示的原电池甲和乙,下列说法正确的是( ) A、甲、乙中铜片上均发生还原反应 B、两池中铁片均发生反应:Fe-2e-=Fe2+ C、装置甲中电子由Cu→灯泡→Fe D、两池所得Fe、Cu金属活泼性相反9. 随着氮肥的大量使用,废水中增大导致水体污染。工业上常用氧化法废水脱氮,即在废水中加入过量通过反应:________________________ , 将转化为而除去。下列说法中正确的是( )A、氧化性: B、反应中n(氧化产物)∶n(还原产物)=3∶1 C、反应中每转移3mol , 生成11.2L D、氧化法处理的废水可以直接排放10. 海带中含有碘元素。从海带中提取碘的实验过程如下图所示:
A、甲、乙中铜片上均发生还原反应 B、两池中铁片均发生反应:Fe-2e-=Fe2+ C、装置甲中电子由Cu→灯泡→Fe D、两池所得Fe、Cu金属活泼性相反9. 随着氮肥的大量使用,废水中增大导致水体污染。工业上常用氧化法废水脱氮,即在废水中加入过量通过反应:________________________ , 将转化为而除去。下列说法中正确的是( )A、氧化性: B、反应中n(氧化产物)∶n(还原产物)=3∶1 C、反应中每转移3mol , 生成11.2L D、氧化法处理的废水可以直接排放10. 海带中含有碘元素。从海带中提取碘的实验过程如下图所示: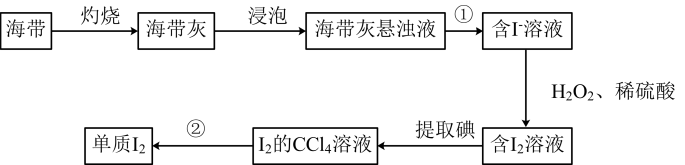
下列说法正确的是( )
A、灼烧海带时用到的硅酸盐仪器有:酒精灯、蒸发皿、泥三角 B、向含溶液中加入和稀硫酸时发生反应: C、步骤①是过滤,可将海带灰中的硫酸盐、碳酸盐等与含溶液分离 D、碘易溶于乙醇,提取碘时也可将换成乙醇11. 下列实验操作能达到相应实验目的的是( )A
B
C
D




检验乙醇中是否含少量水
制备并收集乙酸乙酯
实验室分馏石油
验证甲烷和氯气在光照条件下能发生反应
A、A B、B C、C D、D二、多选题
-
12. 类推时要注意物质的相似性和特殊性,下列类推结论正确的是( )
选项
化学事实
类推结论
A
在中燃烧生成
在中燃烧也生成
B
属于碳酸盐,也属于正盐
也属于碳酸盐和正盐
C
受热分解为和
也能受热分解生成和
D
与反应放出
与反应也放出
A、A B、B C、C D、D13. 有机化合物X、Y、Z,在一定条件下可以发生如下转化:
下列说法正确的是( )
A、有机物X分子中含有三种官能团 B、X与足量Na或反应均可生成Y C、Z与为同分异构体 D、X与互为同系物14. 葡萄糖→乙醇乙酸乙酯,根据转化关系判断下列说法正确的是( )A、可以是淀粉或纤维素,两者互为同分异构体 B、可以利用银镜反应证明反应①的最终产物为葡萄糖 C、将烧黑的铜丝趁热插入乙醇中可得到乙醛 D、乙酸乙酯属于油脂三、综合题
-
15. 元素周期表体现了元素位、构、性的关系,揭示了元素间的内在联系;运用元素周期律研究元素及其化合物的性质具有重要的意义。

上图为元素周期表的一部分,根据表中给出的9种元素,回答下列问题:
(1)、元素⑦在周期表中的位置为第周期第族,其氧化物属于(填“酸性”“碱性”或“两性”)氧化物。(2)、周期表所给九种元素中原子半径最大的元素是(填元素名称);最高价含氧酸酸性最强的是(填化学式)。(3)、写出元素⑥的单质与元素④的最高价氧化物对应水化物反应的离子方程式:。(4)、元素③⑦⑧形成简单氢化物的稳定性:>>(填化学式)。(5)、由元素①④⑧形成的化合物属于(填“离子”或“共价”)化合物,该化合物中含有的化学键类型有。(6)、下列不能说明⑤⑥两种元素金属性相对强弱的是____(填字母)。A、⑤的氧化物是碱性氧化物,⑥的氧化物是两性氧化物 B、最高价氧化物对应水化物碱性:⑤>⑥ C、与同浓度的盐酸反应,⑤的单质比⑥剧烈 D、⑤和⑥均可以从溶液中置换出铜单质16. 为探究H2O2、SO2、Br2氧化性强弱,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验)。
实验操作
实验现象
ⅰ.打开A中分液漏斗活塞,滴加浓硫酸
A中有气泡产生,B中红棕色溴水褪色,C中有白色沉淀
ⅱ.取C中沉淀加入盐酸
C中白色沉淀不溶解
ⅲ.打开B中分液漏斗活塞,逐滴滴加H2O2
开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色
(1)、A中发生反应的化学方程式是。(2)、甲同学通过C中产生白色沉淀,得出结论,氧化性:H2O2>SO2。①乙同学认为不能得出此结论,认为在滴加浓硫酸之前应增加一步操作,该操作是。
②丙同学认为还应该在B和C之间增加洗气瓶D,D中盛放的试剂是。
③将乙和丙同学改进后的方案进行实验,C中产生白色沉淀,得出结论:氧化性H2O2>SO2。
(3)、ⅲ中滴入少量H2O2没有明显变化。提出假设:观点1:H2O2的量少不能氧化Br―
观点2:B中有未反应的H2SO3
为验证观点2,应进行的实验操作及现象是。
(4)、通过上述全部实验,得出结论:H2O2、SO2、Br2氧化性由强到弱的顺序是。17. 1905年哈伯实现了以氨气和氢气为原料合成氨气,生产的氮制造氨肥服务于农业,养活了地球三分之一的人口,哈伯也因此获得了1918年的诺贝尔化学奖。一百多年过去了,对合成氨的研究依然没有止步。(1)、工业合成氨的反应如下:。已知断裂1mol 中的共价键吸收的能量为946kJ,断裂1mol 中的共价键吸收的能量为436kJ,形成1mol N—H键放出的能量为391kJ,则由和生成2mol的能量变化为kJ。下图能正确表示该反应中能量变化的是(填“A”或“B”)。 (2)、反应在三种不同条件下进行,、的起始浓度为0,反应物的浓度随时间(min)的变化情况如下表所示。
(2)、反应在三种不同条件下进行,、的起始浓度为0,反应物的浓度随时间(min)的变化情况如下表所示。序号
温度
时间
0
10
20
30
40
50
60
I
400℃
1.0
0.80
0.67
0.57
0.50
0.50
0.50
II
400℃
1.0
0.60
0.50
0.50
0.50
0.50
0.50
III
500℃
1.0
0.40
0.25
0.20
0.20
0.20
0.20
根据上表数据回答:
①实验I、II中,有一个实验使用了催化剂,它是实验(填序号);在实验Ⅱ中,从0~20min用表示的速率。
②在不同条件下进行的氨的分解反应。根据在相同时间内测定的结果,判断该反应的速率由大到小的顺序是(填字母)。
A. B.
C. D.
③在恒温恒容条件下,判断该反应达到化学平衡状态的标志是(填字母)。
a.的正反应速率等于逆反应速率 b.混合气体的密度不变
c.混合气体的压强不变 d.
18. A、B、C、D是四种常见有机物,它们的模型如下:
根据上述物质,回答下列问题:
(1)、A的电子式是 , C中官能团的名称是。(2)、B的结构简式是 , 该物质发生加聚反应的化学方程式为。(3)、某化学课外小组在实验室中用25gC、30gD和适量浓硫酸混合,反应后得到一种有香味的油状液体E.制备E的装置如图。
①C和D发生反应生成E的化学方程式为 , 反应类型为。
②图中使用装置丙的优点是 , 烧杯丁中盛放的液体是。
③在实验中发现装置乙中溶液逐渐变黑,某同学猜测其原因可能是由浓硫酸的性(填“吸水”“脱水”或“强氧化”)造成的;将反应产生的气体通入酸性溶液,观察到的现象是。
(4)、E提纯后称量其质量为22g,则E的产率为。(产率÷×100%)