广西南宁市2022-2023学年高二上学期开学质量调研化学试题
试卷更新日期:2022-09-26 类型:开学考试
一、单选题
-
1. “十四五”时期生态文明建设强调绿色发展、减少碳排放和改善生态环境质量。下列关于碳排放的说法错误的是( )A、我国科学家利用CO2合成淀粉,能促进实现2030年“碳达峰”的目标 B、大力推进新能源汽车代替传统燃油汽车,有利于实现“碳中和”,改善生态环境 C、通过煤的干馏、煤的气化和煤的液化,可以从根本上杜绝碳排放 D、积极开发使用风能、太阳能、生物能等新型能源,有利于减少碳排放2. 按照物质的组成分类,KIO3属于( )A、氧化物 B、酸 C、碱 D、盐3. 在100mL小烧杯中加入40mL蒸馏水,将烧杯中蒸馏水加热至沸腾,向沸水中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至液体呈红褐色,停止加热,得到的分散系为( )A、浊液 B、溶液 C、胶体 D、无法确定4. 下列与实验相关的操作或方案正确的是( )
A.配制一定物质的量浓度的溶液
B.组成Zn-Cu原电池
C.实验室制取乙酸乙酯
D.比较S、C、Si的非金属性强弱
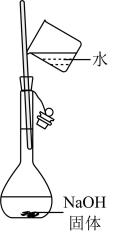


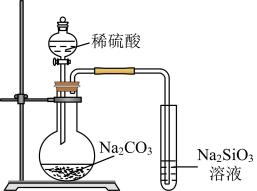 A、A B、B C、C D、D5. 下列离子方程式中,正确的是( )A、将铜片插入溶液中: B、将醋酸滴在石灰石上: C、将一块绿豆大的钠放入水中: D、将硝酸银溶液与氯化钠溶液混合:6. 下列说法错误的是( )A、在化学反应过程中,发生物质变化的同时不一定发生能量变化 B、化学键的断裂与形成是化学反应中能量变化的主要原因 C、当生成物总能量高于反应物总能量时,反应吸热 D、化学反应能量变化多少与反应物和生成物的聚集状态有关7. 2021年12月9日,我国宇航员在中国空间站直播了泡腾片水球实验。泡腾片中含有柠檬酸(结构如图所示)等物质。下列说法错误的是( )
A、A B、B C、C D、D5. 下列离子方程式中,正确的是( )A、将铜片插入溶液中: B、将醋酸滴在石灰石上: C、将一块绿豆大的钠放入水中: D、将硝酸银溶液与氯化钠溶液混合:6. 下列说法错误的是( )A、在化学反应过程中,发生物质变化的同时不一定发生能量变化 B、化学键的断裂与形成是化学反应中能量变化的主要原因 C、当生成物总能量高于反应物总能量时,反应吸热 D、化学反应能量变化多少与反应物和生成物的聚集状态有关7. 2021年12月9日,我国宇航员在中国空间站直播了泡腾片水球实验。泡腾片中含有柠檬酸(结构如图所示)等物质。下列说法错误的是( )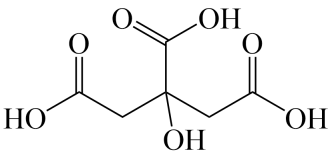 A、柠檬酸的分子式为 B、1mol柠檬酸最多可消耗3molNaOH C、柠檬酸分子中有3种官能团 D、一定条件下可发生氧化、取代反应8. 下列实验操作对应的现象和结论均正确的是( )
A、柠檬酸的分子式为 B、1mol柠檬酸最多可消耗3molNaOH C、柠檬酸分子中有3种官能团 D、一定条件下可发生氧化、取代反应8. 下列实验操作对应的现象和结论均正确的是( )选项
实验操作
现象
结论
A
将铜片放入盛有稀硝酸的试管中
试管口出现红棕色气体
铜片与稀硝酸反应产生NO2
B
向盛有无色透明溶液的试管中滴加澄清石灰水
生成白色沉淀
溶液中一定存在
C
向盛有少量蔗糖的烧杯中加入几滴水,再加入适量浓硫酸,搅拌
蔗糖变黑,体积膨胀,产生有刺激性气味的气体
浓硫酸具有脱水性和强氧化性
D
加热盛有NH4Cl固体的试管
试管底部固体消失,试管口有晶体凝结
NH4Cl固体可以升华
A、A B、B C、C D、D9. 一定条件下,在恒容密闭容器中,能表示反应一定达到化学平衡状态的是( )A、单位时间内生成2nmolSO3 , 同时消耗nmolO2 B、SO2、O2、SO3的物质的量之比为2:1:2 C、SO2、O2、SO3的浓度不再发生变化 D、容器中的气体密度不再发生变化10. 为阿伏加德罗常数的值,下列说法正确的是( )A、0.1molCl2与铁完全反应转移电子数目为0.2 B、11.2L乙烯气体中所含碳氢键数目为2 C、溶液中含有的Na+数目为0.1 D、固体中阴离子数目为0.211. 下列物质的制备与工业生产不相符的是( )A、NH3NOHNO3 B、海水→MgOMg C、饱和食盐水 D、石油乙烯聚乙烯塑料12. 科学家发现某些生物酶体系可以促进和的转移(如a、b和c),能将海洋中的转化为N2进入大气层,反应过程如图所示。下列说法正确的是( )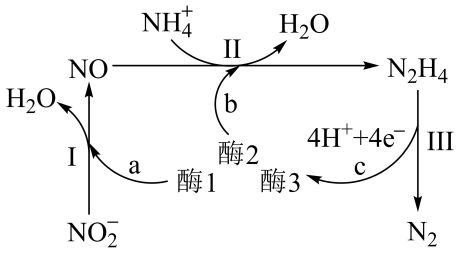 A、过程I中NO为氧化产物 B、过程III中每生成1molN2转移6mol电子 C、过程II的离子方程式: D、过程II中发生还原反应
A、过程I中NO为氧化产物 B、过程III中每生成1molN2转移6mol电子 C、过程II的离子方程式: D、过程II中发生还原反应二、多选题
-
13. 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图所示。该电池工作时,下列说法正确的是( )
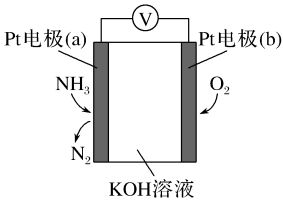 A、电极(a)为正极 B、NH3在电极(a)_上发生氧化反应 C、电子由电极(a)经导线移动向电极(b) D、K+向电极(a)移动14. 短周期主族元素X、Y、Z、W在元素周期表中的位置如图所示,Y原子最外层电子数是其电子层数的3倍。下列关于这四种元素及其化合物的说法中正确的是( )
A、电极(a)为正极 B、NH3在电极(a)_上发生氧化反应 C、电子由电极(a)经导线移动向电极(b) D、K+向电极(a)移动14. 短周期主族元素X、Y、Z、W在元素周期表中的位置如图所示,Y原子最外层电子数是其电子层数的3倍。下列关于这四种元素及其化合物的说法中正确的是( ) A、X、Y、Z、W中可能存在金属元素 B、化合物ZW2分子中所有原子都达到8电子稳定结构 C、气态氢化物的稳定性:Z>W>X>Y D、Y、Z可形成具有漂白性的化合物15. 室温下,下列各组离子在指定条件下一定能大量共存的是( )A、与铝反应产生氢气的溶液: B、无色透明溶液: C、pH=1的溶液: D、新制饱和氯水:
A、X、Y、Z、W中可能存在金属元素 B、化合物ZW2分子中所有原子都达到8电子稳定结构 C、气态氢化物的稳定性:Z>W>X>Y D、Y、Z可形成具有漂白性的化合物15. 室温下,下列各组离子在指定条件下一定能大量共存的是( )A、与铝反应产生氢气的溶液: B、无色透明溶液: C、pH=1的溶液: D、新制饱和氯水:三、填空题
-
16. 部分短周期元素的原子序数与主要化合价的关系如图所示:

请回答下列问题:
(1)、元素a~j中非金属性最强的是(填元素符号),元素i在元素周期表中的位置为 , j的原子结构示意图为。(2)、b、d、e、j四种元素的简单离子半径的大小顺序为(填元素符号)。(3)、元素e与j形成化合物,其电子式为 , 所含化学键的类型为。(4)、b的同主族元素碲(Te)与碘元素同周期,下列有关说法正确的是____A、单质碲在常温下是液体 B、酸性: C、稳定性: D、和互为同位素(5)、f元素的氧化物与氢氧化钠溶液反应的离子方程式为。17.(1)、I.某温度时,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。
请回答下列问题:
该反应的化学反应方程式为。
(2)、1min时,Y的正反应速率Y的逆反应速率(填“>”“<”或“=”)(3)、反应从开始至2min,用X的浓度变化表示的平均反应速率为。(4)、II.油气开采、石油化工、煤化工等行业废气普遍含有硫化氢,通常将其回收生产硫单质(S2)。目前较为普遍的方法是克劳斯工艺和高温热分解H2S,克劳斯工艺的原理是利用以下两步反应生产单质硫:①
②
请回答下列问题:
下列措施可以加快反应②的速率的是____。
A、升高温度 B、保持容积不变,充入N2使体系压强增大 C、及时从体系中分离出S2(g) D、加入合适的催化剂(5)、高温热分解H2S的化学反应方程式是。(6)、在1470K、100kPa反应条件下,在一容积为2L的恒容容器中充入1molH2S进行高温热分解反应,反应5分钟后达到平衡,平衡时混合气体中H2S与H2的物质的量相等,H2S平衡转化率为。四、综合题
-
18. 某校化学研究学习小组设计实验验证NH3能还原CuO,实验装置如下图。

请回答下列问题:
(1)、A装置中反应的化学方程式为。(2)、B装置中盛放的试剂是;D装置仪器的名称为。(3)、甲同学认为该实验装置不严谨,应在装置D后连接一个盛有浓硫酸的试剂瓶,其目的是。(4)、证明NH3能与CuO反应的实验现象是。(5)、若NH3还原CuO的还原产物唯一且生成无毒无污染气体,则C反应中氧化产物与还原产物的物质的量之比为。(6)、已知该反应受NH3用量和反应温度影响,有时会生成副产物Cu2O,Cu2O为砖红色,易对实验结论产生干扰。已知Cu2O在酸性溶液中不稳定: , 请设计实验方案验证CuO完全反应后的红色固体产物中是否含有Cu2O。19. 金属及其化合物在生产生活中占有极其重要的地位,请结合金属及其化合物的相关知识回答下列问题:(1)、目前使用量最大的合金是____。A、钢 B、青铜 C、镁合金 D、铝合金(2)、某溶液中有Mg2+、Fe2+、Al3+、Cu2+等离子,向其中加入足量的Na2O2后,过滤,将滤渣投入足量的盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是____。A、Mg2+ B、Fe2+ C、Al3+ D、Cu2+(3)、高铁酸钠()是一种新型水处理剂。某兴趣小组欲利用废金属屑(主要成分为Fe和Cu,含有少量)制取高铁酸钠并回收金属Cu,其工艺流程如下:
①试剂a为(填化学式,下同),滤渣II的主要成分为。
②在过滤操作中要使用玻璃棒,其作用是。
③检验滤液I中是否存在Fe3+的试剂是。
④制备的反应原理是:当反应中转移电子总数约为时,则生成的物质的量为mol。
(4)、纳米铁粉可用于处理废水中的。酸性条件下,纳米铁粉与废水中反应生成Fe3+与 , 其反应的离子方程式是。20. 烃A(结构简式:)是有机化学工业的基本原料,可从石油中获得。烃A可发生如下图所示的一系列化学反应。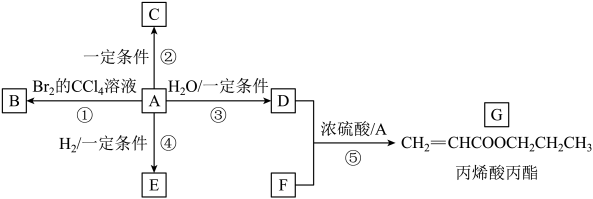
请回答下列问题:
(1)、B的分子式为 , ①的反应类型是。(2)、E的名称是 , 可鉴别A、E两种物质的试剂是(填一种)。(3)、C是A通过加聚反应制得的有机高分子材料,其结构简式为。(4)、G的官能团是(填名称),D与F反应的化学方程式是。